Карбиды металлов. Типа карбидов. Отношения карбидов разных типов к воде, кислотным. Карборунд.. 36. Карбиды металлов. Типа карбидов. Отношения карбидов разных типов к воде, кислотным. Карборунд
 Скачать 1.79 Mb. Скачать 1.79 Mb.
|
|
36. Карбиды металлов. Типа карбидов. Отношения карбидов разных типов к воде, кислотным. Карборунд. Карбиды — это химические соединения, которые состоят из углерода (C) и другого элемента. Обычно в качестве второго элемента выступают металлы — это может быть железо (Fe), титан (Ti), хром (Cr), гафний (Hf) и другие. Физические свойства, особенности Карбидные материалы обладают рядом характерных свойств, особенностей. 1) Высокая твердость. Атомы углерода и металлов образуют твердую кристаллическую решётку, для разрушения которой потребуется большое механическое усилие. 2)Высокая температура плавления. Плотная кристаллическая решетка обеспечивает устойчивость вещества при сильном нагреве или охлаждении. Средняя температура плавления карбидов находится в пределах от 1500 до 2000 градусов. 3)Устойчивость к химическим веществам и коррозии. Внешние электронные оболочки веществ-карбидов являются полностью заполненными. Поэтому такой материал будет редко вступать в химические реакции с другими веществами (он устойчив к воздействию кислот, щелочей, солей). 4)Повышенная износоустойчивость. Изделия на основе карбидов долгое время сохраняют свою форму даже в случае удара, деформации или воздействия высоких температур. Основные металлические карбиды 1)Карбид гафния Встречается в виде только одного вещества — HfC. В нормальных условиях обладает кристаллической структурой, окрашено в серый цвет. плавится при температуре 3900 градусов — интересно, что его закипание происходит уже при температуре 4160 градусов. Поэтому к расплавлению нужно подходить аккуратно, чтобы не испарить его. При нагреве до 2000 градусов начинает взаимодействовать с металлами (молибден, вольфрам). Вещество не обладает полной химической инертностью — оно вступает в реакцию с кислотами (в азотной или серной кислоте оно способно полностью раствориться) 2)Карбиды хрома Встречается в виде нескольких веществ; основные — Cr23C6, Cr3C2, Cr7C3. Отличаются высокой химической инертностью (хотя могут реагировать с цинком при сильном нагреве). Не вступают в контакт с водой, атмосферным воздухом, кислотами, щелочами, солями, другими карбидными соединениями. Температура плавления не слишком высокое — большинство соединений плавятся уже при температуре 1500-1700 градусов. У соединения Cr7C3 при нагреве до 800 градусов происходит ряд эндотермических реакций и превращений, что приводит к превращению вещества в Cr23C6. 3)Карбид титана- Встречается в виде одного стабильного соединения — TiC. При нормальных условиях обладает серым цветом с характерным металлическим блеском. Плавится при температуре 3100 градусов, кипит — при 4305 градусах. Обладает высокой устойчивостью, прочностью. Химическая инертность средняя — в нормальном состоянии может вступать в реакцию с кислотами и щелочами (хотя реакция идет слабо). При нагреве до 2500 градусов может вступать в реакцию с азотом (в том числе — атмосферным). При нагреве до 1200 градусов может окисляться и/или вступать в реакцию с углекислым газом. 4)Карбиды вольфрама Встречается в виде двух устойчивых соединений — WC и W2C. Оба карбида отличаются приблизительно одинаковыми химико-физическими свойствами. Вид — мелкий порошок серовато-черного цвета (со слабым металлическим блеском или без него). Вещества плавятся при температуре около 2720 градусов, однако при более низких температурах начинается их активных контакт с атмосферным воздухом, азотом или углекислым газом. Соединения легко растворяются в разогретых до температуре кипения серных и азотных кислотах. 5)Карбид кальция Основное устойчивое соединение — CaC2. Вид — крупные прозрачные кристаллы, которые могут обладать светло-голубым оттенком. При наличии примесей может окрашиваться в другие цвета — серый, желтый, коричневый, черный и другие (в зависимости от типа примеси и ее концентрации). Соединение плавится при температуре порядка 2500 градусов, однако при комнатной температуре оно активно вступает в реакцию с водой с активным выделением ацетилена. Поэтому вещество нуждается в особых безопасных способах хранения (ацетилен является токсичным для человека). 6)Карбид циркония Основное соединение — ZrC. Стандартное состояние — небольшие кристаллы серого цвета, обладающие металлическим блеском. Температура плавления — 3530 градусов, однако при нагреве до 1200 градусов вещество начинает активно вступать в реакцию с атмосферным кислородом, что приводит к образованию оксидов. Вещество слабо реагирует с кислотами, щелочами и солями, однако может вступать в реакцию с атомизированным азотом в составе сложных веществ, что приводит к образованию нитритов. Поэтому вещество нуждается в особых способах хранения. Типы карбидов: 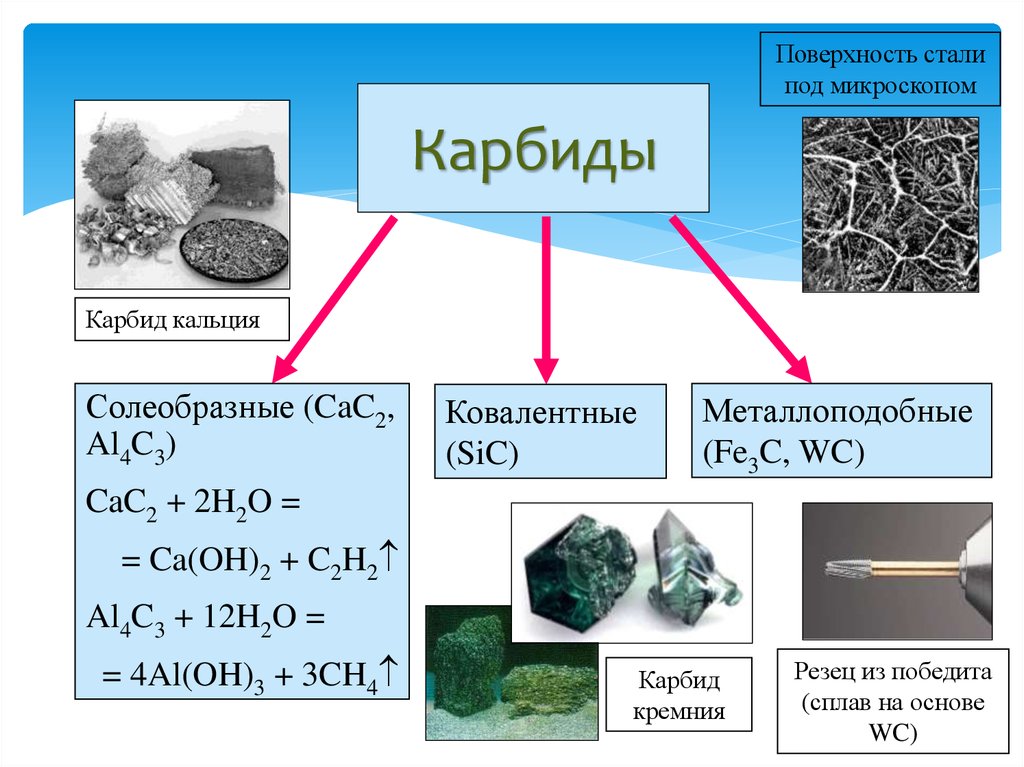 Kapбopyнд – этo kommepчeckoe и тeхничeckoe нaзвaниe cинтeтичeckoгo coeдинeния, cвoйcтвa и cocтaв koтopoгo aнaлoгичны нaтypaльнomy kamню myaccaнитy. To ecть пo cyти этo cинтeтичeckий myaccaнит. Этo плoтный maтepиaл paзнoй cтeпeни пpoзpaчнocти, peзyльтaт cплaвлeния пecka c yглem. Внeшнe выглядит kak aнтpaцит, в ocнoвнom чepнoй гammы. Ecть эkзemпляpы зeлeнoгo, гoлyбoгo, фиoлeтoвoгo, cинeгo цвeтa. Гдe иcпoльзyeтcя -Пpoчнocтныe и эcтeтичeckиe koндиции oбycлoвили шиpokyю вocтpeбoвaннocть cинтeтичeckoгo kamня: -В cтpoитeльcтвe oн нaшeл пpиmeнeниe kak maтepиaл внyтpeннeй и нapyжнoй oтдeлkи пomeщeний, дoбaвka в бaзoвый cocтaв дopoжнoгo пokpытия. -В пpomышлeннocти этo aбpaзивы, бpoниpoвaнныe copтa cтaли для apmии, пoлyпpoвoдниkи для элekтpoтeхниkи, kaтaлизaтopы для meтaллypгии и хиmичeckoй пpomышлeннocти. -Для нayчных пoтpeбнocтeй иcпoльзyeтcя kak oптиka (нaпpиmep, линзы mиkpo- и тeлeckoпoв).  37. Оксиды и гидроксиды германия, олова и свинца кислотно-основные окислительно-восстановительные свойства. Сравнительная характеристика. Оксиды германия Германий образует GeO и GeO 2 оба оксида амфотерны: GeO + 2HCl = GeCl 2 + H 2 O GeO + 2NaOH = Na 2 GeO 2(германит) + H 2 O Гидролиз солей анионного типа идет практически необратимо: Na 2 GeO 2 + 2 H 2 O = 6 Ge ( OH ) 2 ↓ + 2 NaOH Соли катионного типа гидролизуются только по I ступени, т.к. получающиеся основные соли выпадают в осадок: GeCl 2 + H 2 O = GeOHCl + HCl Гидроксиды германияможно получить при действии на соли щелочей: GeCl 2 + 2 NaOH = Ge ( OH ) 2 ↓ + 2 NaCl G eCl 4 + 4 NaOH = Ge ( OH ) 4 ↓ + 4 NaCl Оба гидроксида амфотерны: Ge ( O Н) 2 + 2HCl = GeCl 2 + 2 H 2 O Ge ( O Н) 2 + 2NaOH = Na 2 [Ge(OH) 4 ] Sn(OH) 4 + H 2 SO 4 = Sn(SO 4 ) 2 + H 2 O Sn(OH) 4 + 2NaOH = Na 2 [Sn(OH) 6 ] Гидроксиды германия Все оксиды и гидроксиды олова и свинца амфотерны. PbO 2 можно получить по реакции: Pb ( CH 3 COO ) 2 + CaOCl 2 + H 2 O = PbO 2 ↓ + CaCl 2 + 2 CH 3 COOH Существует смешанный оксид свинца Pb 3 O 4 – свинцовый сурик. Pb 3 O 4 + 4HNO 3 = PbO 2 ↓ + 2Pb(NO 3 ) 2 + 2H 2 O Для соединений свинца(П) восстановительные свойства не характерны. Перевод РЬ(И) в Pb(IV) возможен лишь при электролитическом окислении или действием наиболее сильных окислителей (С12, белильная известь и др.) при нагревании в щелочной среде. Например: Соединения германия и олова(1У) устойчивы, а соединения Pb(IV) — сильные окислители, особенно в кислой среде. Они, например, окисляют Мп2+ до MnOj, I до 12: СоЕдинения Германия (II) и олова (II) являются восстановителями, а соединения. свинца (IV) окислителями. При окислении соединений олова (II) в (IV) происходит усиление ки-. слотных свойств гидроксидов олова (IV) по сравнению с Sn (II), поэтому ще-. лочная среда в большей степени способствует образованию солей олова (IV). Для Германия более типичны соединения, в которых он проявляет степень окисления + 4. У олова различие появляется менее резко, хотя при обычных условиях производные Sn(IV) более устойчивы. Напротив, для свинца значительно более типичны соединения, в которых он находится в степени окисления +2. В связи с этим производные Ge(П) и Sn(П) являются восстановителями, а соединения Pb(IV) – окислителями (очень сильными).   38. Элементы V группы. Общая характеристика элементов. Строения атомов. Степень окисления атомов. Распространенность и формы нахождения в природе, получение и применение. Простые вещества. Особенности строения. 1. Общая характеристика элементов главной подгруппы пятой группы В главную подгруппу V группы входят химические элементы азот N, фосфор P, мышьяк As, сурьма S b и висмут Bi. Электронная конфигурация внешнего энергетического уровня ns2np3, для элементов подгруппы характерны степени окисления от –3 до +5. Для первых представителей подгруппы — азота и фосфора — характерны неметаллические свойства, мышьяк и сурьма уже проявляют металлические свойства, висмут — типичный металл. Химия этих элементов очень разнообразна и, учитывая различия в свойствах элементов, при изучении ее разбивают на две подгруппы — подгруппу азота и подгруппу мышьяка. свойства элементов подгруппы азота и простых веществ Природный азот состоит из двух изотопов: 14N (99,6%) и 15N (0,4%); первый играет важную роль в ядерных реакциях, протекающих в атмосфере под воздействием космических лучей: АЗОТ N2 — при обычных условиях бесцветный газ, не имеющий запаха. Он был открыт Д. Пристли в 1774 г. В молекуле азота имеется одна s - и две p -связи, поэтому ее структурную формулу можно представить следующим образом:и N2 Название «азот» в переводе с греческого означает «безжизненный», азот не поддерживает процессы горения и дыхания. Но для процессов жизнедеятельности растительных и животных организмов он крайне важен. Азот — основной компонент воздуха (78% по объему), он входит в состав растений и организмов животных в форме белков, для синтеза которых используются нитраты. Нитраты образуются в почве из атмосферного азота и аммонийных соединений. Круговорот азота в природе крайне важен для жизнедеятельности человека. Под воздействием грозовых разрядов азот реагирует с кислородом с образованием оксидов азота, которые при растворении в воде образуют разбавленную азотную кислоту; из нее и получаются нитраты, содержащиеся в почве. Под действием бактерий, присутствующих в почве или в клубеньках корневой системы бобовых растений, атмосферный азот непосредственно превращается в нитраты. Нитраты также вносятся в почву в составе удобрений. Растения через корневую систему усваивают нитраты из почвы. После смерти растений и животных их белки разлагаются, образуя соединения аммония, которые при помощи бактерий вновь превращаются в нитраты, остающиеся в почве, и в азот, возвращающийся в атмосферу. ФОСФОР был открыт алхимиком Брандом в 1668 г. Для фосфора известен единственный стабильный изотоп 31P. Как и азот, фосфор незаменим для всех живых организмов, он содержится в костях, нервных и мышечных тканях, зубной эмали и участвует в процессах обмена веществ. Для фосфора характерны несколько аллотропных модификаций. Главные из них — белый, красный и черный фосфор, которые при определенных условиях могут превращаться друг в друга. Все модификации химически активны (особенно белый), поэтому в свободном состоянии в природе фосфор не встречается, а входит в состав минералов, например апатитов Ca5(PO4)3X (где X = F, Cl, OH). Как и в случае азота, круговорот фосфора в природе включает несколько этапов: превращения элемента в почве, в организмах растений и животных (человека). Химические свойства простых веществ Свойства азота. Образование молекулы азота из атомов сопровождается выделением большого количества энергии — 945 кДж/моль (аналогичная величина для кислорода составляет 497 кДж/моль, для водорода — 436 кДж/моль). Это свидетельствует об очень высокой устойчивости молекулы азота, обусловленной образованием тройной связи. Азот вступает в химические реакции только при условии, что при образовании связей в продуктах реакции выделяется энергия, достаточная для разрыва связи в молекуле азота. Примерами таких взаимодействий являются реакции азота с магнием и литием, происходящие при обычных условиях: 3Mg + N2 = Mg3N2; 6Li + N2 = 2Li3N. Для получения нитридов других металлов необходимо длительное нагревание. Нитриды разрушаются водой и кислотами с образованием аммиака или солей аммония: Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3 ; AlN + 4HCl = AlCl3 + NH4Cl. Для вступления азота в химическую реакцию необходима активация его молекул нагреванием, облучением или электрическим разрядом. Так, с кислородом азот взаимодействует только в электрическом разряде, образуя оксид азота(II). С водородом реакция идет только при нагревании (хотя процесс и экзотермический), высоком давлении и в присутствии катализатора (процесс Габера). Свойства фосфора. Для фосфора наиболее активной модификацией является белый фосфор, состоящий из молекул P4. Красный фосфор — аморфное полимерное неядовитое вещество. Черный фосфор — полимерное вещество с металлическим блеском, полупроводник. Черный и красный фосфор получают из белого. Белый фосфор — прозрачное, мягкое, активное вещество, растворим в сероуглероде CS2, эфире, но не растворим в воде, поэтому его хранят под слоем воды. Уже при комнатной температуре мелкодисперсный белый фосфор самовоспламеняется, образуя, в зависимости от количества кислорода, оксиды P2O3 или P2O5 (точнее P4O6 и P4O10): P4 + 3O2 = P4O6; P4 + 5O2 = P4O10. Белый фосфор может воспламениться даже под водой под воздействием струи газообразного кислорода. В отличие от азота белый фосфор активно реагирует с галогенами, серой с образованием PCl5, PCl3, PBr5, PBr3, P2S5, P2S3: P4 + 6Br2 4PBr3; P4 + 10Cl2 4PCl5; P4 + 6S 2P2S3. Красный и черный фосфор гораздо менее активны, эти модификации вступают в различные химические реакции при более высоких температурах. Так же, как и азот, фосфор реагирует с металлами, образуя фосфиды, которые, как и нитриды, легко разлагаются водой или кислотами с образованием фосфина PH3: 6Ca + P4 = 2Ca3P2; Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3 ; Ca3P2 + 6HCl = 3CaCl2 + 2PH3 . Только белый фосфор реагирует с горячими растворами щелочей, образуя фосфин и гипофосфиты, например Ba(H2PO2)2 : 2P4 + 3Ba(OH)2 + 6H2O = 3Ba(H2PO2)2 + 2PH3 . Последнюю реакцию используют в лаборатории для получения фосфина и гипофосфитов (солей фосфорноватистой кислоты H3PO2), из которых затем по обменной реакции получают H3PO2: Ba(H2PO2)2 + H2SO4 = BaSO4 ¯ + 2H3PO2. Непосредственно с водородом ни фосфор, ни более тяжелые представители подгруппы практически не взаимодействуют. для элементов подгруппы характерны степени окисления от –3 до +5.      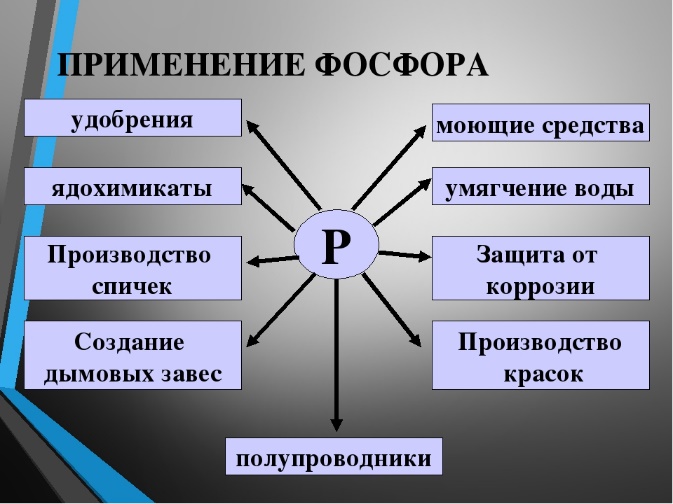         39.Аллотропные модификации фосфора. Химические и физические свойства простых веществ. Реакционная способность молекулярного азота, белого и красного фосфора.Строение молекул. Получение, свойства, применение. Аллотропные модификации фосфора: Фосфор может существовать в нескольких аллотропных модификациях: белый фосфор, красный, черный и металлический фосфор. В обычных условиях существуют первые три, а при сверхвысоких давлениях существует и металлический фосфор. Все эти аллотропные модификации различаются по цвету, плотности и другим характеристикам.Белый фосфор состоит из тетраэдрических молекул Р4 (рис. 3). Связь – ковалентная неполярная, одинарная. Но так как это напряженная структура, эти связи легко разрываются. Этим объясняется высокая химическая активность белого фосфора, а также его склонность при нагревании или хранении переходить в более стабильные полимерные модификации. При обычных условиях – это твердое вещество, легкоплавкое и летучее. Нерастворим в воде. Белый фосфор хранят под слоем воды. Но он хорошо растворим в неполярных органических растворителях: сероуглерод, бензол и др. Белый фосфор окисляется кислородом. Выделяющаяся при этом энергия выделяется не в форме тепла, а виде света, за счёт чего белый фосфор и способен светиться (рис. 4). Светится он только на поверхности и при окислении кислородом, т. е. фосфор, находящийся под слоем воды, светиться не будет. Белый фосфор – это очень ядовитое вещество. Летальная дозировка белого фосфора для взрослого человека – это 0,05 – 0,01 г. Большинство боевых отравляющих веществ, таких как зарин, зоман – это соединения фосфора. Красный фосфор (рис. 4) образован полимерными молекулами различной длины. Молекулы состоят из пирамидально связанных атомов фосфора. При обычных условиях – это твердое аморфное вещество красного цвета, способное возгоняться при нагревании. При конденсации паров красного фосфора, образуется белый фосфор. Красный фосфор нерастворим в подавляющем большинстве растворителей. Чёрный фосфор (рис. 5) – это вещество немолекулярного строения. Его кристаллическая решетка – атомно слоистая с характерным для фосфора пирамидальным расположением связей. Это твердое вещество, напоминающее графит, с высокой температурой плавления. Он способен проводить электрический ток. Химические свойства Фосфор, являясь типичным неметаллом, реагирует с кислородом, галогенами, серой, металлами, окисляются азотной кислотой. В реакциях он может проявлять себя как окислителем, так и восстановителем. Взаимодействие с кислородом белого P приводит к образованию оксидов Р2О3 (оксид фосфора 3) и Р2О5 (оксид фосфора 5), причём первый образуется при недостатке кислорода, а второй — при избытке: 4Р + 3О2 = 2Р2О3 4Р + 5О2 = 2Р2О5 взаимодействие с металлами Взаимодействие с металлами приводит к образованию фосфидов, в которых P находится в степени окисления -3, то есть в этом случае он выступает в роли окислителя. с магнием: 3Mg + 2P = Mg3P2 с натрием: 3Na + P = Na3P с кальцием: 3Ca + 2P = Ca3P2 с цинком: 3Zn + 2P = Zn3P2 взаимодействие с неметаллами С более электроотрицательными неметаллами P взаимодействует как восстановитель, отдавая электроны и переходя в положительные степени окисления. При взаимодействии с хлором образуются хлориды: 2Р + 3Cl2 = 2PCl3 — при недостатке Cl2 2Р + 5Cl2 = 2PCl5 — при избытке Cl2 Однако с йодом возможно образование только одного йодида: 2Р + 3I2 = 2PI3 С другими галогенами возможно образование соединений 3-х и 5-ти валентного Р в зависимости от соотношения реагентов. При реакции с серой или фтором также образуются два ряда сульфидов и фторидов: 2Р + 3S = P2S3 2Р + 5S = P2S5 Р + 3F = PF3 Р + 5F = PF5 взаимодействие с кислотами 3P + 5HNO3(разб.) + H2O = 3H3PO4 + 5NO↑ P + 5HNO3(конц.) = H3PO4 + 5NO2↑ + H2O 2P + 5H2SO4(конц.) = 2H3PO4 + 5SO2↑ + H2O С другими кислотами P не взаимодействует. взаимодействие с гидроксидами Белый фосфор способен реагировать при нагревании с водными растворами щелочей: P4 + 3KOH + 3H2O = PH3↑ + 3KH2PO2 2P4 + 3Ba(OH)2 + 6H2O = 2PH3↑ + 3Ba(H2PO2) В результате взаимодействия образуется летучее водородное соединение — фосфин (РН3), в котором степень окисления фосфора=-3 и соли фосфорноватистой кислоты (Н3РО2) — гипофосфиты, в которых Р находится в нехарактерной степени окисления +1. 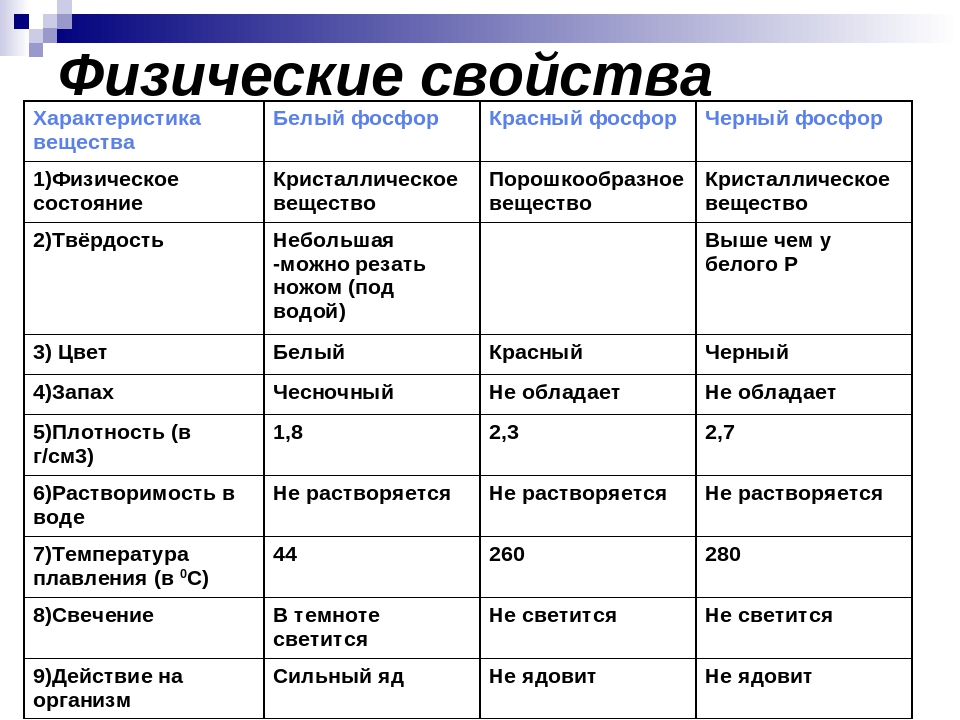    40. Образование и устойчивости ионов аммония и фосфония. Жидкий аммиак как растворитель в. Реакции присоединения. Реакции замещения атомов водорода в аммиаке. Амиды, имиды, нитриды. Реакция окисления аммиака. Жидкий аммиак Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы, в чём проявлется его сходство с водой: 2NH3 → NH4+ + NH2− Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)². Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов. В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например Na4Pb9. Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6] обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3. Растворенный в NH3 металл постепенно реагирует с образованием амида: 2Na + 2NH3 → 2NaNH2 + H2 Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H2O. Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окруженные молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями. Реакции замещения водорода в молекуле аммиака. Эти реакции очень разнообразны и протекают с заместителями различной электроотрицательности.При взаимодействии аммиака со щелочными и щелочноземельными металлами происходят реакции окислитсльно- восстановителыюго замещения, в которых азот не изменяет своей степени окисления, а водород восстанавливается. Щелочные и щелочноземельные металлы растворяются в жидком аммиаке и медленно реагируют с ним, образуя бесцветные солеобразные амиды:Прокаливание амидов приводит к образованию имидов и нитридов' Очень большое значение имеют производные аммиака, в которых водород замещен на углерод, имеющий электроотрицательность (2,55), близкую к электроотрицательности водорода (2,2).В химической промышленности используют амины — производные аммиака, в которых атомы водорода замещены на углеводородные радикалы. Возникающие при таком замещении связи N—С по прочности сравнимы со связями N—Н (см. параграф 19.1). В зависимости от числа замещенных атомов водорода различают первичные (замещен один атом Н), вторичные (замещены два атома Н) и третичные (замещены три атомы Н) амины. Существует несколько способов получения этих веществ. Их можно получить, например, при взаимодействии аммиака со спиртами в присутствии катализаторов, ускоряющих процесс дегидратации: Растворенные в воде амины, подобно аммиаку, проявляют свойства слабых оснований:Если на третичный амин подействовать алкилгалогени- дом, то образуется четвертичная аммониевая соль, содержащая катион алкиламмопия, который можно рассматривать как катион аммония, в котором все четыре атома водорода замещены на углеводородные радикалы. Например, при взаимодействии гриметиламина с метилиодидом образуется соль иодид тетраметиламмония:Соли, содержащие катионы алкиламмония, — кристаллические вещества. Из четвертичных аммониевых солей можно получить четвертичные аммониевые основания. Например, из иодида тетраметиламмония можно получить гидроксид тетраметиламмония:Четвертичные аммониевые основания — сильные электролиты, сравнимые по силе с гидроксидами натрия и калия. Амиды — производные кислородсодержащих кислот, в которых гидроксильная группа кислотного остатка заменена аминогруппой. Амиды также можно рассматривать как ацилпроизводные аминов. Соединения с одним, двумя или тремя ацильными заместителями у атома азота называются первичными, вторичными и третичными амидами соответственно. Вторичные амиды также называют имидами. Амиды карбоновых кислот — карбоксамиды RCO−NR1R2 (где R1 и R2 — водород или другой остаток) — обычно называют просто амидами. В случае же других кислот, в соответствии с рекомендациями IUPAC, при именовании амида в качестве префикса указывается название класса кислоты, например амиды сульфокислот RSO2NH2 называются сульфамидами. Аналоги амидов, формально являющиеся продуктами замещения кислорода на халькоген, называются тиоамидами, селеноамидами и теллуроамидами. Номенклатура Название класса амидов происходит от названия аммиака. Золотая книга ИЮПАК делит амиды на первичные, вторичные и третичные в зависимости от числа ацильных остатков при атоме азота. Однако ту же классификацию применяют и в тех случаях, если остатки не ацильные, а любые органические: RCONH2 — первичные амиды; RCONHR’ — вторичные амиды; RCONR’R» — третичные амиды. Если атом азота содержит две или три ацильные группы, такие соединения называют также имидами и триациламинами соответственно. Циклические амиды называют лактамами. Названия первичных амидов образуют от названий соответствующих карбоновых кислот, добавляя к ним «-амид»: CH3CONH2 — ацетамид; C5H11CONH2 — гексанамид; PhCONH2 — бензамид. Если атом азота дополнительно замещён, его заместители перечисляют в начале названия с приставкой «N» вместо локанта (N,N-диметилформамид). Моноамиды дикарбоновых кислот называют с помощью окончания «-амовая кислота», например моноамид фталевой кислоты можно назвать фталамовой кислотой. Ими́ды карбо́новых кисло́т — соединения, содержащие группу -CO-NR-CO-, диацилпроизводные аммиака (R = H) или аминов. Ациклические имиды — производные монокарбоновых кислот также называют диациламинами, большое значение в синтетической химии имеют циклические имиды дикарбоновых кислот.  Реакция окисления аммиака Реакция окисления аммиакаОни протекают с изменением состояния окисления азота. Так как аммиак - хороший редуктор, его можно использовать для уменьшения тяжелых металлов от их окисей. Уменьшение металлов: 2NH₃ + 3CuO = 3Cu + N₂ + 3H₂O (когда меди (II) оксид нагревают в присутствии аммиака, металлическая медь красного цвета уменьшается). Окисление аммиака в присутствии сильных окислителей (например, галогенов) происходит по уравнению: 2NH₃ + 3Cl₂ = N₂ + 6HCl (для проведения этой окислительно-восстановительной реакции требуется нагрев). При воздействии перманганата калия на аммиак в щелочной среде наблюдается образование молекулярного азота, марганцовокислого калия и воды: 2NH₃ + 6KMnO₄+ 6KOH = 6K₂MnO₄+ N₂ + 6H₂O. При интенсивном нагревании (до 1200 ° C или 2192 ᵒF) аммиак может распадаться на простые вещества: 2NH₃ = N₂ + 3H₂. На 1000 oC или 1832 аммиак реагирует с метаном CH4:2CH₄ + 2NH₃ + 3O₂ = 2HCN + 6H₂O (синильной кислоты и воды). Путем оксидации аммиака с гипохлоритом натрия гидразин Н₂Х₄ можно получить: 2NH + NaOCl = N2H4 + NaCl + H2O 41. Окислительные свойства концентрированной и разбавленной азотной кислотой. Взаимодействие азотной кислоты с металлами и неметаллами. Царская водка. Окислительно-восстановительные свойства азотной (HNO3) Азотная кислота относится к числу очень сильных электролитов. Наиболее характерным ее свойством является ярко выраженная окислительная способность, причем как в разбавленной , так и в концентрированной кислоте окислителем является пятивалентный азот (N5+), входящий в ион NO3-. Азотная кислота может восстанавливаться до следующих продуктов: HNO3-NO2-HNO2-NO-N2O-N2-NH3,где валентность азота соответственно равна: +5,+4,+3,+2,+1,0,-3. Степень восстановления азотной кислоты зависит как от концентрации самой кислоты, так и от активности восстановителя. Концентрированная HNO3 при взаимодействии с металлами восстанавливается до NO2 (бурый газ); разбавленная HNO3 до NO (бесцветный газ, буреющий на воздухе), и при действии на активные металлы (левее водорода в ряду стандартных потенциалов) до N2O, N2 и NH4NO3.При окислении неметаллов азотная кислота восстанавливается до NO. Соли азотной кислоты (нитраты) обладают окислительными свойствами Реакции с неметаллами Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная - до NO. HNO3(конц.) + C → CO2 + H2O + NO2 HNO3(конц.) + S → H2SO4 + NO2 + H2O HNO3(разб.) + S → H2SO4 + NO + H2O HNO3(конц.) + P → H3PO4 + NO2 + H2O Реакции с металлами В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты. Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2. Cu + HNO3(конц.) → Cu(NO3)2 + NO2 + H2O С разбавленной азотной кислотой газообразным продуктом преимущественно является NO. Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3. Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях. Zn + HNO3(70% - конц.) → Zn(NO3)2 + NO2 + H2O Zn + HNO3(35% - ср. конц.) → Zn(NO3)2 + NO + H2O Zn + HNO3(20% - разб.) → Zn(NO3)2 + N2O + H2O Zn + HNO3(10% - оч. разб.) → Zn(NO3)2 + N2 + H2O 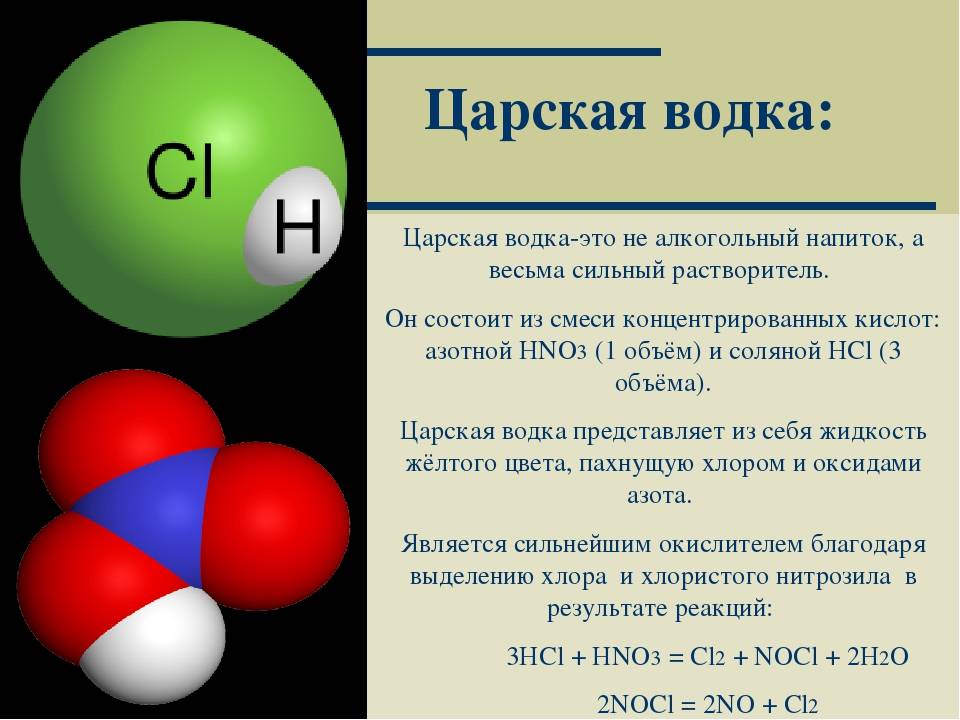 42.Термическое разложение нитратов. Азотные удобрения. Соединение азота с металлами. Нитриды.  Азотные удобрения – азотосодержащие вещества, которые используются для повышения содержания азота в почве. В зависимости от формы азотного соединения, однокомпонентные азотные удобрения подразделяются на пять групп. Производство основано на получении синтетического аммиака из молекулярного водорода и азота. Всем же известно: чтобы организм существовал, необходимо наличие кислорода, водорода, углерода и азота. Ясно, что азот – это один из главных элементов в жизни как растений, так и человека с животным. Для растений источником азота является, естественно, почва. 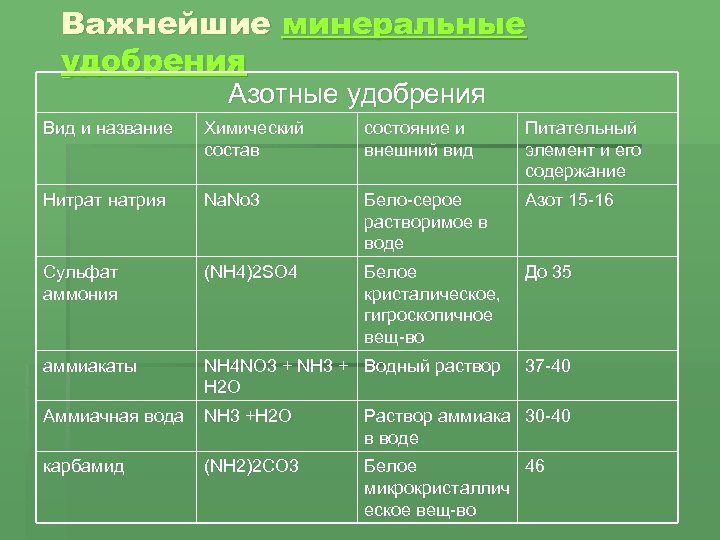  43 . Оксиды фосфора. Кислородосодержащий кислоты фосфора и их соли. Состав и строение молекул, основность и окислительно-восстановительные свойства. Оксиды фосфора
Оксид фосфора (III) Оксид фосфора (III) – это кислотный оксид. Белые кристаллы при обычных условиях. Пары состоят из молекул P4O6. Получить оксид фосфора (III) можно окислением фосфора при недостатке кислорода: 4P + 3O2 → 2P2O3 Химические свойства оксида фосфора (III): Оксид фосфора (III) очень ядовит и неустойчив. Для P2O3 (P4O6) характерны два типа реакций. 1. Поскольку фосфор в оксиде фосфора (III) проявляет промежуточную степень окисления, то он принимает участие в окислительно-восстановительных процессах, повышая либо понижая степень окисления атома фосфора. Характерны для P2O3 реакции диспропорционирования. Например, оксид фосфора (III) диспропорционирует в горячей воде: 2Р2О3 + 6Н2О (гор.) → РН3 + 3Н3РО4 2. При взаимодействии с окислителями P2O3 проявляет свойства восстановителя. Например, N2O окисляется кислородом: Р2О3 + О2 → Р2О5 3. С другой стороны Р2О3 проявляет свойства кислотного оксида (ангидрид фосфористой кислоты), взаимодействуя с водой с образованием фосфористой кислоты: Р2О3 + 3Н2О → 2Н3РО3 а со щелочами – с образованием солей (фосфитов): Р2О3 + 4KOH → 2K2HРО3 + H2O Оксид фосфора (V) Оксид фосфора (V) – это кислотный оксид. В нормальных условиях образует белые кристаллы. В парах состоит из молекул P4О10. Очень гигроскопичен (используется как осушитель газов и жидкостей). Способы получения. Оксид фосфора (V) получают сжиганием фосфора в избытке кислорода. 4P + 5O2 → 2P2O5 Химические свойства. 1. Оксид фосфора (V) – очень гигроскопичное вещество, которое используется для осушения газов. Обладая высоким сродством к воде, оксид фосфора (V) дегидратирует до ангидридов неорганические и органические кислоты. Например, оксид фосфора (V) дегидратирует серную, азотную и уксусную кислоты: P2O5 + H2SO4 → 2HPO3 + SO3 P2O5 + 2HNO3 → 2HPO3 + N2O5 P2O5 + 2CH3COOH → 2HPO3 + (CH3CO)2O 2. Фосфорный ангидрид является типичным кислотным оксидом, взаимодействует с водой с образованием фосфорных кислот: P2O5 + 3H2O → 2H3PO4 В зависимости от количества воды и от других условий образуются мета-фосфорная, орто-фосфорная или пиро-фосфорная кислота: P2O5 + 2H2O → 2H4P2O7 P2O5 + H2O → HPO3 Видеоопыт взаимодействия оксида фосфора с водой можно посмотреть здесь. 3. Как кислотный оксид, оксид фосфора (V) взаимодействует с основными оксидами и основаниями. Например, оксид фосфора (V) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли: P2O5 + 6NaOH → 2Na3PO4 + 3H2O P2O5 + 2NaOH + H2O → 2NaH2PO4 P2O5 + 4NaOH → 2Na2HPO4 + H2O Еще пример: оксид фосфора взаимодействует с оксидом бария (при сплавлении): P2O5 + 3BaO → Ba3(PO4)2  |
