АЛГЕБРА 3. НОД И НОК ЦЕЛЫХ ЧИСЕЛ. ОСНОВНЫЕ СВОЙСТВА И АЛГОРИТМ ЕВКЛИДА. ПРИВЕСТИ ПРИМЕРЫ МЕТОДОВ НАХОЖДЕНИЯ НОД И НОК В ШКОЛЬНОМ КУРСЕ МАТЕМАТИКИ
Всякое целое число c, которое делит каждое из чисел 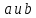 , называется их общим делителем. Целесообразно ограничиться рассмотрением натуральных делителей. Множество всех делителей является конечным, в нем присутствует наибольший, его и называют НОД. , называется их общим делителем. Целесообразно ограничиться рассмотрением натуральных делителей. Множество всех делителей является конечным, в нем присутствует наибольший, его и называют НОД.
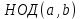 называют такой общий делитель называют такой общий делитель 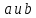 , который делится на любой их общий делитель. , который делится на любой их общий делитель.
НОК. Целое число c называется наименьшим общим кратным целых чисел 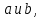 если оно делится на каждое из этих чисел. если оно делится на каждое из этих чисел.
Перечислим некоторые свойства НОД и НОК.
1. Любое общее кратное чисел a и b делится на их наименьшее общее кратное.
2. Любой общий делитель чисел a и b является делителем НОД(a;b).
3. Произведение НОД и НОК чисел a и b равно произведения этих чисел.
4. Если числа a и b имеют общий делитель k, т.е. 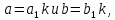 то то
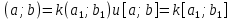
Рассмотрим один из способов нахождения НОД, а именно алгоритм Евклида:
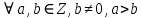
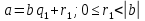
При 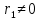 , то , то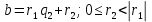
При 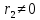 , то , то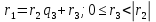
Остатки 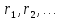 слева ограничены 0 и являются убывающими. слева ограничены 0 и являются убывающими.
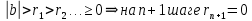
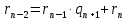
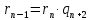
Покажем, что 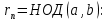
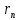 общий делитель общий делитель
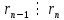 в последнем равенстве в последнем равенстве
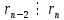 в предпоследнем в предпоследнем
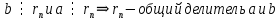

Пусть d – общий делитель 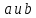 : :  . .
Найдём наибольший общий делитель чисел 140 и 96: 
Последний делитель равен 4 - это значит, что НОД (140, 96) = 4.
Чтобы найти наибольший общий делитель трёх и более данных чисел, используем следующий порядок действий:
Сперва находим наибольший общий делитель любых двух чисел из нескольких данных.
Затем находим НОД найденного делителя и какого-нибудь третьего данного числа.
Затем находим НОД последнего найденного делителя и четвёртого данного числа и так далее.
Найдём НОК (12, 16, 24) .
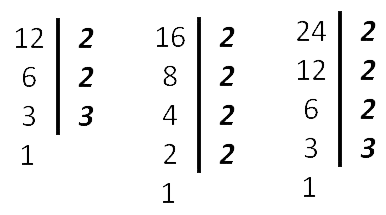
Как видим из разложения чисел, все множители 12 вошли в разложение 24 (самого большего из чисел), поэтому в НОК добавляем только одну 2 из разложения числа 16 .
НОК (12, 16, 24) = 2*2*2*3*2 = 48
Ответ: НОК (12, 16, 24) = 48
6.МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ. ИДЕАЛЬНЫЙ ГАЗ. ПАРАМЕТРЫ СОСТОЯНИЯ. УРАВНЕНИЕ СОСТОЯНИЯ ДЛЯ ИДЕАЛЬНОГО ГАЗА. ИЗОПРОЦЕССЫ. АНАЛИЗ И МЕТОДИКА ИЗУЧЕНИЯ ТЕМЫ.
Молекулярная физика - раздел физики, в котором изучаются физические свойства тел в различных агрегатных состояниях на основе их молекулярного строения.
Тепловое движение - беспорядочное (хаотическое) движение атомов или молекул вещества.
Молекулярно-кинетической теорией (МКТ) называется теория, объясняющая строение и свойства тел движением и взаимодействием частиц, из которых состоят тела.
В основе МКТ лежат следующие основные положения:
все тела состоят из частиц, разделенных промежутками;
частицы вещества находятся в непрерывном хаотическом движении;
частицы взаимодействуют между собой.
В молекулярно – кинетической теории используется идеализированная модель идеального газа.
Идеальным газом называется газ, молекулы которого не взаимодействуют друг с другом на расстоянии и имеют ничтожно малые собственные размеры. У реальных газов молекулы испытывают действия силы межмолекулярного взаимодействия. Однако H2, He, O2, N2 при н. у. (Т=273К, Р=1,01 ·105 Па) можно приблизительно считать идеальным газом.
Основными параметрами газа, характеризующими его состояние, являются объем, давление и температура. p, V, T. Эти параметры закономерно связаны друг с другом, так что изменение одного из них влечет за собой изменение другого. Эта связь аналитически может быть задана в виде функции:
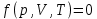
Соотношение, дающее связь между параметрами какого-либо тела, называется уравнением состояния. Следовательно, данное соотношение является уравнением состояния идеального газа.
Давление (P). В газе давление возникает в результате хаотического движения молекул, в результате которого молекулы сталкиваются друг с другом и со стенками сосуда. Давление – это физическая величина, численно равная силе, действующей на единицу площади поверхности, нормальную к ней. В системе СИ давление измеряется в 1Па=1Н/м2.
Температура (Т) – это мера нагретости тела.
Основным уравнением, описывающим поведение идеального газа, является уравнение Менделеева-Клапейрона (уравнение состояния идеального газа):
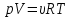

p-давление, V-объем и T-абсолютная температура газа (в градусах Кельвина), R —универсальная газовая постоянная=8,31 Дж/моль*К, общая для всех газов, а υ— число, пропорциональное числу молекул или атомов газа (так называемое число молей газа — см. Закон Авогадро).
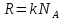 , где k=1,38*10-23Дж/К, p=nkT, n=N/V , где k=1,38*10-23Дж/К, p=nkT, n=N/V
NA=6*1023 – число Авогадро
k = 1,38*10-23Дж/K- постоянная Больцмана
Изопроцессы - процессы изменения состояния газов так, что один из трех макроскопических параметров ( ) остается постоянным, а два других параметра при этом изменяются. ) остается постоянным, а два других параметра при этом изменяются.
m=const 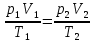
Изотермический процесс Т=const, m=const, описываются законом Бойля-Мариотта:
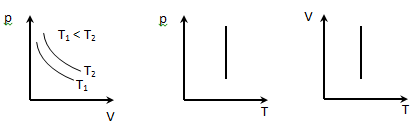
pV=const
Изобарический процесс p = const описывается законом Гей-Люссака
V=V0 (1+ α t); V=V0 α T
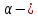 температурный коэффициент объемного расширения температурный коэффициент объемного расширения 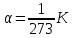
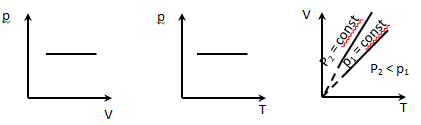
Изохорический процесс V = const описывается законом Шарля

Закон Шарля: для газа данной массы при постоянном объеме
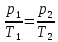
где p1, р2, T1, Т2 — давление и температура газа в начальном и конечном состояниях.
Основное уравнение молекулярно-кинетической теории (м.к.т.) газов.
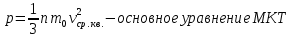
Из уравнения Менделеева - Клапейрона:

Кинетическая энергия движения частиц зависит только от температуры, при которой находится газ.
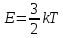
Методика изучения раздела «Основы МКТ» 10 класс
Изучение этой темы основывается на знании учащихся, полученных при изучении курса в 7-8 классах и курса химии в 8-9 классах.
| |
 Скачать 64.97 Kb.
Скачать 64.97 Kb.