анемии. Анемии вследствие кровопотери постгеморрагические
 Скачать 113.13 Kb. Скачать 113.13 Kb.
|
|
При нормальном эритропоэзе эритроцит проходит стадию ретикулоцита в костном мозге. Частично ретикулоциты выходят в периферическую кровь. В норме содержание в крови ретикулоцитов и полихроматофилов – 0,5–1,0% от общего количества эритроцитов. Чем больше этих клеток, тем выше степень регенерации эритроцитов в костном мозге, и соответственно отсутствие их говорит о подавлении регенерации. Анемии вследствие кровопотери – постгеморрагические: Анемия может развиться в результате острого или хронического кровотечения. Острая постгеморрагическая анемия Острая постгеморрагическая анемия - нормохромная нормоцитарная гиперрегенераторная анемия, возникающая вследствие острой кровопотери в течение короткого периода времени. Причина: массированное кровотечение из повреждённых крупных сосудов или полостей сердца (травмы и хирургические вмешательства, внематочная беременность, нарушения гемостаза, различные заболевания внутренних органов, сопровождающиеся острым кровотечением). Различают 3 фазы (или стадии). 1.Рефлекторная сосудистая фаза. Характеризуется тем, что сразу после кровопотери изменений первоначального состава крови не наблюдается – можно говорить только об уменьшении объема циркулирующей крови. Артериальное давление на этой стадии удерживается за счет рефлекторного спазма сосудов. 2.Гидремическая фаза. Наступает через 2–3 дня, когда количество эритроцитов уменьшается за счет поступления тканевой жидкости в сосуды (относительная эритропения) и усиленного разрушения эритроцитов в клетках системы мононуклеарных фагоцитов (абсолютная эритропения). Объем циркулирующей крови нормализуется за счет поступления тканевой жидкости. 3. Костномозговая фаза. Развивается спустя 4–5 дней после кровопотери, когда усиливается эритропоэз за счет возросшей при гипоксии выработки эритропоэтина. Увеличивается количество по лихроматофильных эритроцитов, или ретикулоцитов (ретикулоцитарный криз) до 5–8 %. Выраженность регенерации соответствует уровню регенераторной анемии. Цветовой показатель несколько снижается из-за большого количества недозревших эритроцитов (гипохромия).
Проявления • Общие признаки анемии (тахикардия, одышка, снижение артериального и венозного давления, бледность кожных покровов и слизистых оболочек). Важный признак острого кровотечения - нарастающее чувство сухости во рту. • Периферическая кровь. Изменения носят стадийный характер и зависят от времени, прошедшего после кровотечения. ♦ Первые часы и сутки: нормоцитемическая гиповолемия, уменьшение общего количества циркулирующих эритроцитов. При этом Ht, число эритроцитов, уровень Hb в единице объёма крови остаются в рамках нормальных диапазонов. ♦ 2-3-е сутки после кровопотери: снижение уровня Hb ниже нормы, уменьшение числа эритроцитов в единице объёма крови и падение Ht; сохранение в пределах нормы цветового показателя (в связи с тем, что в крови циркулируют зрелые эритроциты, находившиеся в сосудистом русле до кровопотери), тромбоцитопения (в результате потребления кровяных пластинок в процессе тромбообразования, гемодилюции, а также утраты их при кровопотере), лейкопения (вследствие потери лейкоцитов во время кровотечения и последующей гемодилюции). ♦ 4-5-е сутки после кровопотери: пониженное содержание Hb, эритропения, сниженный Ht; гипохромия эритроцитов - обусловлена отставанием скорости синтеза Hb от темпа пролиферации эритроидных клеток; увеличение числа молодых клеток эритроидного ряда: ретикулоцитов, иногда эритробластов (как результат высокой регенераторной способности костного мозга); тромбоцитопения и лейкопения. Лечение заключается в устранении кровотечения, переливании компонентов крови и коллоидных растворов. Хронические постгеморрагические анемии • Причины: длительные, повторяющиеся кровотечения в результате нарушения целостности стенок сосудов (например, при инфильтрации в них опухолевых клеток, экстрамедуллярном кроветворении, выраженной венозной гиперемии, язвенных процессах в ЖКТ, коже, слизистых оболочках), эндокринопатий и расстройств гемостаза (например, при нарушении сосудистого, тромбоцитарного или коагуляционного механизмов у пациентов с геморрагическими диатезами). • Патогенез и проявления связаны, в основном, с нарастающим дефицитом железа в организме. Они являются частным вариантом железодефицитных анемий. Длительное время потеря крови компенсируется усиленным кроветворением (до 3–5 % ретикулоцитов), но затем при истощении костного мозга число ретикулоцитов становится ниже нормы. Основ ным гематологическим признаком хронической постгеморрагической анемии является выраженная гипохромия эритроцитов и уменьшение их размеров (микроцитоз), что свидетельствует о резком снижении синтеза Hb из-за дефицита железа, белков, витаминов и микроэлемен тов. Хронические потери крови приводят к истощению депо железа – эти анемии всегда железодефицитные. При угнетении кроветворения эта анемия может быть гипо- и арегенераторной. Гемолитические анемии 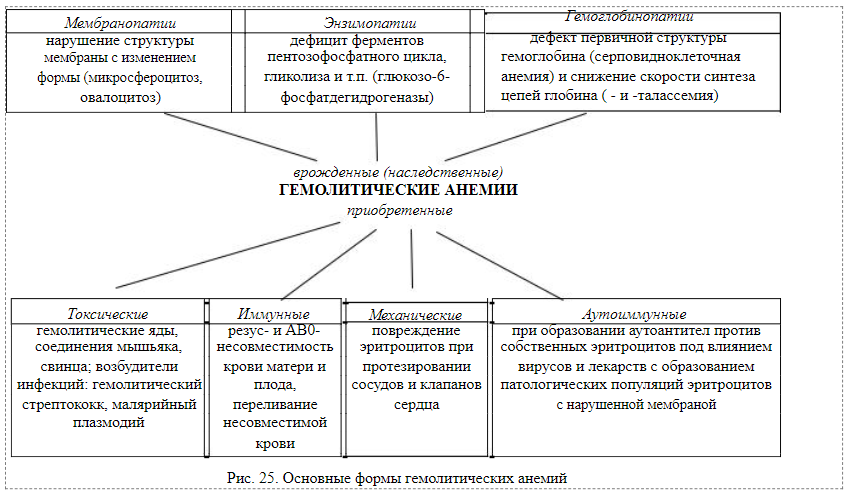 Гемолитические анемии - группа заболеваний, характеризующихся снижением средней продолжительности жизни эритроцитов (в норме 120 дней) и преобладанием интенсивности деструкции эритроцитов в сравнении с их образованием. Гемолиз (разрушение эритроцитов) может быть внесосудистым (в селезёнке, печени или костном мозге) и внутрисосудистым. Этиология Гемолитические анемии возникают при дефектах эритроцитов (внутриклеточные факторы) либо под воздействием внешних по отношению к эритроцитам причин (внеклеточные факторы). • Внеклеточные факторы. Микроокружение эритроцитов представлено плазмой и эндотелием сосудов. Присутствие в плазме аутоили изоантител, токсичных веществ или инфекционных агентов вызывает изменения стенки эритроцита, что приводит к его разрушению. • Внутриклеточные факторы. Внутриклеточные дефекты эритроцитов наследуемы (исключая пароксизмальную ночную гемоглобинурию).
Патогенез Общий механизм лизиса эритроцитов заключается в дезорганизации фосфолипидно-белковой структуры их мембраны вследствие: ♦ Повышения проницаемости мембран клеток эритроидного ряда (от проэритробласта до зрелого эритроцита) для ионов и органических веществ. ♦ Утраты клетками эритроидного ряда микро- и макромолекулярных веществ (K+, фосфатов, ферментов и др.). ♦ Избыточного поступления в цитозоль эритроцитов Na+, Ca2+, органических соединений и воды из их органоидов, а также из плазмы крови. ♦ Увеличения осмоляльности внутриклеточной жидкости (за счёт ионов, метаболитов, липидов, углеводов, белков и их соединений). ♦ Гипергидратации эритроидных клеток, их набухания, утраты дискоидной формы, округления (сфероцитоза). ♦ Разрушения эритроидных клеток. Наиболее гидратированные клетки гемолизируются в просвете сосудов (внутрисосудистый гемолиз). Менее гидратированные, но с пониженной способностью к деформации клетки разрушаются в капиллярах тканей, синусах селезёнки, печени, поглощаются и лизируются макрофагами (внутриклеточный гемолиз). Проявления гемолитических анемий разнообразны и в значительной степени определяются конкретным заболеванием. Общие признаки: ♦ костный мозг: увеличение числа клеток эритроидного ростка; ♦ периферическая кровь: эритропения (исключение - талассемия), ретикулоцитоз, повышенный уровень непрямого билирубина, полихроматофилия эритроцитов, пойкилоцитоз. Лечение гемолитических анемий организуется с позиций этиотропного, патогенетического и симптоматического принципов. • Этиотропный принцип. Необходимо устранить (прекратить действие) гемолитических факторов или обеспечить организм факторами, дефицит которых вызвал гемолиз эритроцитов (например, рибофлавином, глутатионом, флавинатом). • Патогенетический принцип
♦ Для предотвращения разрушения эритроцитов в селезёнке проводят спленэктомию. ♦ С целью предупреждения (уменьшения степени) повреждения органов и тканей в результате отложения в них избытка железа (гемосидерина) применяют железосвязывающие вещества. ♦ Для уменьшения степени расстройств жизнедеятельности организма, вызванных повреждающим действием гипоксии, переливают компоненты крови (эритроцитарную массу), применяют антиоксиданты (например, витамины E и C). • Симптоматический принцип. С целью нормализации функций органов и их систем, нарушения которых были вызваны гемолизом эритроцитов и гемосидерозом, корригируют деятельность ССС, почек, печени и других органов и тканей. Наследственные гемолитические анемии делят на три большие группы: мембранопатии, энзимопатии гемоглобинопатии. Мембранопатии характеризуются наследственным дефектом белково-липидной структуры мембран эритроцитов, что приводит к изменению формы и эластичности клеток, их способности деформиро ваться в узких участках кровотока, в результате чего они разрушаются (например, в синусах селезенки). Энзимопатии обусловлены наследственным дефицитом ряда ферментов эритроцитов. В настоящее время известно более 20 различ ных реакций в обмене эритроцитов, блокада которых вызывает преж девременный их гемолиз. К ним относятся прежде всего реакции пен тозофосфатного цикла, гликолиза, метаболических путей, связанных с восстановлением и окислением глутатиона, и др. Все метаболические процессы в эритроците находятся во взаимосвязи и взаимозависимо сти, и нередко блокада какого-либо одного звена приводит к наруше нию жизненно важных функций клетки в связи с энергетическим де фицитом, ионным дисбалансом, нарушением окислительно восстановительных процессов. Биохимические сдвиги, вызванные не достаточной активностью того или иного фермента, приводят к общему результату – понижают жизнеспособность эритроцитов, увеличи вают их уязвимость к воздействию различных неблагоприятных фак торов, что проявляется в виде хронического или эпизодического гемо лиза. К генетическим дефектам ферментов гликолиза относятся дефи цит гексокиназы, фосфофруктокиназы, пируваткиназы, 2,3 дифосфатглицеромутазы, 3-фосфоглицераткиназы. Реакции гликолиза являются основным путем синтеза АТФ из АДФ в эритроцитах. Не достаток АТФ приводит к нарушению трансмембранного переноса ионов, в связи с чем развивается их дибаланс, сопровождающийся ги пергидратацией и набуханием эритроцитов, увеличением их размера. Помимо этого нарушаются пластические процессы с участием АТФ. Дефекты ферментов системы глутатиона (глутатионредуктазы, глута тионпероксидазы, глюконатсинтетазы) приводят к активации перекис ного окисления мембранных липидов, нарушению целостности мем бран и процессов мембранного транспорта. Эти формы патологии встречаются сравнительно редко. Наиболее частая энзимопатия эрит роцитов – дефицит глюкозо-6-фосфатдегидрогеназы (Г-6-ФД).\ Гемоглобинопатии характеризуются мутацией генов, коди рующих цепи гемоглобина (качественные гемоглобинопатии), либо снижением скорости синтеза одной из нормальных цепей гемоглобина (количественные гемоглобинопатии). Наиболее изучена гемоглобинопатия S или серповидно клеточная анемия. Приобретенные гемолитические анемии обусловленны пре имущественно внутрисосудистым гемолизом эритроцитов вследствие повреждения их мембраны разными агентами. Костный мозг в данном случае продуцирует вполне нормальные клетки. Приобретенная изоиммунная гемолитическая анемия развива ется при несовместимости крови матери и плода по резус-фактору, системе AB0. Выделяют три клинические формы, которые по степени тяже сти распределяют в следующем порядке: а) врожденная анемия новорожденных – анемическая форма, б) желтуха новорожденных – желтушная форма, в) врожденная водянка – отечная форма. Резус-конфликт наблюдается у 2–3 из 1000 новорожденных, а конфликт по системе AB0 у 5–6 из 1000. Патогенез. В случае когда плод содержит эритроциты с резус фактором, наследуемым от отца, а мать резус-отрицательна, в ее орга низме против резус-антигена начинают вырабатываться антитела, ко торые, попав в организм плода, вызывают гемолиз эритроцитов. При первой беременности иммунизация матери возможна, но эта беремен ность может протекать безопасно. Последующие беременности проте кают под угрозой развития вторичного иммунного ответа, когда появ ляются антитела класса IgG, которые могут попадать в организм плода через плацентарный барьер (антитела других классов через этот барьер не проходят). Проникая в кровь плода, они разрушают его резус положительные эритроциты. При этом картина крови нестабильна. Очень большое количество биллирубина в крови плода приводит к его отложению в ядрах нервных клеток головного мозга с последующим их повреждением. Анемическая форма проявляется выраженной общей бледно стью покровов новорожденного. При патоморфологическом исследо вании выявляются малокровие внутренних органов, умеренный эрит робластоз в печени и селезенке; изменения головного мозга менее вы ражены, чем при других формах. Желтушная форма проявляется желтухой кожных и слизистых покровов плода. Количество непрямого биллирубина в сыворотке кро ви достигает 342–684 мкмоль/л. При патоморфологическом исследо вании отмечается желтушность подкожно-жирового слоя и интимы крупных сосудов. Ядра нервных клеток головного мозга прокрашены в охряно-желтый цвет. Тяжесть поражения усугубляется гипоксией из за повреждений мелких сосудов. Отечная форма характеризуется общими выраженными оте ками; кожа плода бледная, полупрозрачная. При патоморфологиче ском исследовании выявляются транссудат в полостях тела; значи тельное увеличение сердца, печени, селезенки; полнокровие почек. Мягкая мозговая оболочка и ткань мозга отечны и полнокровны. ДИЗЭРИТРОПОЭТИЧЕСКИЕ АНЕМИИ возникают вследствие нарушения кровообразования. Дизэритропоэтические анемии дифференцируют в зависимости от происхождения. • Вызванные преимущественным повреждением стволовых клеток: гипопластические и апластические. • Вызванные преимущественным повреждением клеток-предшественниц миелопоэза или эритропоэтинчувствительных клеток в результате: ♦ нарушения синтеза нуклеиновых кислот эритрокариоцитов (мегалобластные); ♦ расстройства синтеза гема; ♦ нарушения синтеза глобинов; ♦ расстройств регуляции деления и созревания эритрокариоцитов. Гипопластическая и апластическая анемии Гипо- и апластические анемии, развивающиеся в результате преимущественного повреждения стволовых клеток, являются результатом подавления функции костного мозга. По происхождению эти анемии подразделяют на первичные и вторичные. • Первичной дизэритропоэтической анемией является анемия Фанкони. • Вторичные (приобретённые) гипо- и апластические анемии являются результатом действия одной или нескольких групп факторов: физической (например, ионизирующего облучения), химической (чаще всего ЛС, например, иммунодепрессантов, цитостатиков) или биологической природы (главным образом - вирусов, а также антиэритроцитарных АТ и T-цитотоксических лимфоцитов).
Патогенез ♦ Высокие дозы ионизирующей радиации обусловливают необратимое повреждение и гибель стволовых клеток, вплоть до их полного исчезновения. ♦ Химические и биологические факторы (например, вирусы и ЛС) тормозят синтез нуклеиновых кислот и белка в стволовых клетках, нарушают клеточное и физико-химическое их микроокружение, а также провоцируют образование аутоиммунных лимфоцитов или АТ, что ведёт к гибели стволовых клеток. Проявления. Для гипо- и апластических анемий характерны следующие изменения: • Костный мозг: уменьшение числа клеток миелоидного ряда, повышение содержания железа в эритрокариоцитах и вне их, увеличение числа лимфоидных клеток (как правило). • Периферическая кровь: эритропения, снижение общей концентрации Hb в крови (цветовой показатель обычно в пределах нормы), часто тромбоцитопения, лейкопения (за счёт гранулоцитов), увеличение содержания железа в плазме крови, анизоцитоз (макроцитоз). Анемии вследствие нарушения синтеза ДНК Анемии вследствие нарушения синтеза глобиновых ДНК - как правило, гиперхромные макроцитарные анемии с мегалобластным типом кроветворения. Мегалобластный эритропоэз возникает вследствие нарушения синтеза ДНК в условиях дефицита витамина B12 или фолиевой кислоты, а также при недостаточности метионин синтетазы и дигидрофолатредуктазы. При макроцитарной мегалобластной анемии эритроидный росток костного мозга представляют аномальные эритроидные клетки - мегалобласты. В эту группу анемий входят В12-дефицитные анемии, а также фолиеводефицитная анемия. Указанные анемии протекают тяжело и трудно поддаются лечению. Поэтому мегалобластные анемии ранее называли пернициозными - злокачественными (в том числе анемию АддисонаБирмера). Проявления мегалобластных анемий
♦ Костный мозг: наличие мегалобластов, признаки нарушения созревания миелоидных клеток и дегенерации ядер мегалобластов, большое число мегалоцитов. ♦ Периферическая кровь: выраженная эритропения, часто - панцитопения, наличие мегалобластов и мегалоцитов, анизоцитоз (макро- и мегалоциты), пойкилоцитоз, гиперхромия и полихроматофилия эритроцитов, базофильная пунктация эритроцитов, наличие в эритроцитах остатков ядра, билирубинемия. Анемии, обусловленные нарушениями обмена железа К анемиям, развивающимся при нарушениях обмена железа, относят железодефицитные (сидеропенические) и железорефрактерные (сидероахрестические) анемии. Дефицит железа в организме развивается, когда потери его превышают 2 мг/сут. Причины: ♦ Увеличение потерь железа при хронических, повторных кровопотерях (желудочных, кишечных, маточных и др.), а также массированных кровоизлияниях. ♦ Возрастание расходования железа при беременности и последующем вскармливании ребёнка. ♦ Снижение поступления железа в организм вследствие общего голодания, значительного уменьшения в рационе продуктов питания, содержащих железо, нарушения всасывания железа в ЖКТ (всасывается главным образом двухвалентное железо, входящее в состав гема; нарушение этого процесса развивается при хронических гастритах, энтеритах, резекциях желудка и тонкой кишки). Железодефицитные анемии • Патогенез железодефицитных анемий ♦ Дефицит железа в плазме крови и клетках организма обусловливает снижение его содержания в митохондриях эритроидных клеток костного мозга. ♦ Это тормозит синтез гема, соединение его с глобином и, следовательно, образование Hb. ♦ Одновременно с этим нарушается синтез и других железосодержащих соединений (как в эритроидных клетках - каталазы, глутатионпероксидазы, так и в клетках паренхиматозных органов - цитохромов, миоглобина, пероксидазы, каталазы и др.).
♦ Недостаток указанных ферментов в эритроцитах приводит к снижению резистентности к повреждающему действию перекисных соединений, повышенному их гемолизу и укорочению времени циркуляции в крови. • Проявления железодефицитных анемий: ♦ Костный мозг: увеличение числа базо- и полихроматофильных эритробластов, уменьшение количества сидеробластов. ♦ Периферическая кровь: эритропения, сидеропения, гипохромия эритроцитов, пойкилоцитоз, анизоцитоз (микроцитоз) эритроцитов, часто лейкопения. Железорефрактерные анемии Железорефрактерные (порфиринодефицитные, сидеробластные, сидероахрестические) анемии развиваются в результате нарушения включения в гем железа. Железорефрактерные анемии подразделяют на первичные (наследственные и идиопатические) и вторичные (приобретённые). • Первичные железорефрактерные анемии. Проявления: ♦ Костный мозг: повышение числа сидеробластов, уменьшение числа гемоглобинизированных эритробластов, увеличение количества базофильных эритробластов. ♦ Периферическая кровь: умеренная эритропения, анизоцитоз эритроцитов, наличие мишеневидных эритроцитов, гипохромия эритроцитов, пойкилоцитоз эритроцитов, повышение уровня железа в крови. • Вторичные (приобретенные) железорефрактерные анемии. ♦ Причины: дефицит витамина В6; хронические интоксикации (соединениями свинца, алкоголем, антимикобактериальным средством изониазидом). ♦ Патогенез. При дефиците витамина B6 нарушаются включение железа в молекулу гема и синтез Hb. В связи с этим увеличивается содержание железа в плазме крови и клетках различных органов. При отравлении свинцом происходит блокада сульфгидрильных групп ферментов синтеза протопорфиринов. Нарушение синтеза гема нередко (особенно при отравлении соединениями свинца) сочетается со снижением скорости образования глобина.
♦ Проявления зависят от конкретной формы железорефрактерной анемии. Так, для витамин В6-дефицитной анемии характерны незначительное снижение в периферической крови числа эритроцитов, выраженная их гипохромия, анизоцитоз (макроцитоз), пойкилоцитоз, наличие единичных мишеневидных эритроцитов, увеличение содержания железа в плазме крови. Анемии, развивающиеся вследствие нарушения синтеза глобинов К анемиям, причиной которых является нарушение синтеза глобинов (гемоглобинопатии), относятся множество заболеваний, в том числе различные виды талассемии, болезнь нестабильного Hb и серповидно-клеточная анемия. Талассемии • Патогенез талассемий. В связи с тем, что одна из цепей глобина синтезируется в меньшем количестве либо совсем отсутствует, нарушается количественная сбалансированность двух его цепей. «Несбалансированная» (т.е. не имеющая пары) цепь агрегирует и выпадает в осадок в цитозоле эритроидных клеток, в том числе в ретикулоцитах и эритроцитах периферической крови (тельца Хайнца). Клетки, содержащие несбалансированные агрегированные цепи, разрушаются. • Проявления талассемий: наблюдается увеличение числа эритроидных клеток и сидеробластов в костном мозге; эритропения, анизоцитоз (микроцитоз), гипохромия эритроцитов и пойкилоцитоз в периферической крови. Лечение дизэритропоэтических анемий направлено на устранение или прекращение действия причинных факторов, вызывающих нарушение пролиферации и дифференцировки эритроидных клеток (этиотропная терапия); разрыв патогенетических звеньев анемических состояний: гипоксии, гемосидероза, нарушений КЩР (патогенетическое лечение); устранение последствий и неприятных симптомов анемий (симптоматическая терапия). |
