Фарм химия. Учебное задание по ДЕ 28. Беликов В. Г. Фармацевтическая химия в 2х ч. В. Г. Беликов 4е изд., перераб и доп. М. Медпрессинформ, 2007. C
 Скачать 124.25 Kb. Скачать 124.25 Kb.
|
|
Учебное задание по фармацевтической химии к занятию по ДЕ 28 «Анализ лекарственных веществ, производных фенолов: фенол, резорцин, тимол». 1.Изучить материал по теме: Беликов В.Г. Фармацевтическая химия: В 2-х ч. /В.Г.Беликов - 4-е изд., перераб и доп. - М.: МЕДпресс-информ, 2007. C. Чупак-Белоусов В.В. Фармацевтическая химия. Курс лекций. Книга первая. – 3 курс. – М.: Издательство БИНОМ, 2012. Фармацевтическая химия под ред. А.П. Арзамасцева. 2.Повторить химические реакции фенолов (см. курс «Органическая химия») 3.Выполнить учебное задание Физические свойства лекарственных веществ, производных фенолов (описание, растворимость)
Написать получение лекарственных средств, производных фенолов:
Подлинность: Физико-химические методы: УФ-спектр. Химические методы 1.Цветная реакция с хлоридом железа (III). Основана на образовании комплексной соли с ионами железа (III). Написать уравнения реакций для фенола, резорцина и тимола (указать аналитический эффект) А) Взаимодействие фенола с хлоридом железа (III):
Б) Взаимодействие резорцина с хлоридом железа (III):
2.Реакция бромирования. При взаимодействии с бромной водой происходит электрофильное замещение водорода в орто- и пара-положениях на бром. В результате реакции происходит обесцвечивание бромной воды и выпадение белого осадка. Написать уравнения реакций для фенола, резорцина и тимола (указать аналитический эффект) А) Взаимодействие фенола с бромной водой:
Б) Взаимодействие резорцина с бромной водой:
В) Взаимодействие тимола с бромной водой:
3.Реакция азосочетания фенолов с диазореактивом (диазотированная сульфаниловая кислота) с образованием азокрасителя (оксиазосоединения) окрашенного в оранжево-красного цвета (для фенола) или краситель резорциновый желтый (для резорцина). Написать уравнения реакций для фенола, резорцина (указать аналитический эффект). А) Взаимодействие фенола с диазореактивом:
Б) Взаимодействие резорцина с диазореактивом:
4.Реакция окисления Написать уравнения реакций для фенола (указать аналитический эффект).
5.Реакция образования индофенолового красителя. Основана на окислении фенолов до хинонов, которые при конденсации с аммиаком (или аминопроизводным) и избытком фенола образуют индофеноловый краситель. Написать уравнения реакций для фенола (указать аналитический эффект).
В результате выполнения реакции фенолы, как правило приобретают интенсивно-синее или сине-зеленое окрашивание. Тимол окрашивается в слабо-розовый, резорцин – в буровато-желтый. После добавления кислот окраска переходит в красную (фенол, резорцин) 6.Реакции конденсации: - c альдегидами: Реакция конденсации фенола с формальдегидом в присутствии концентрированной серной кислоты с образованием ауринового красителя, окрашенного в красный цвет:
- с ангидридами карбоновых кислот: А) реакция конденсации фенола с фталевым ангидрирдом (в результате реакции образуется фенолфталеин)
Б) реакция конденсации резорцина с фталевым ангидрирдом (в результате реакции образуется флюресцеин). Образуется плав желто-красного цвета.
- Реакция получения ауринового красителя: при нагревании фенолов с хлороформом в присутствии гидроксида натрия. Вначале фенолят натрия с хлороформом образует дихлорметилфенолят натрия, который гидролизуется в альдегид:
7.Реакциии нитрозирования и нитрования. С азотистой кислотой фенол образует нитрозосоединения, имеющие коричневато-зеленое (после подщелачивания – сине-зеленое), тимол – темно-зеленое, резорцин – сине-фиолетовое окрашивание. Реакции фенола: А) с разведенной азотной кислотой. При действии на фенол разведенной азотной кислотой образуется п-нитропроизводной фенола, которое может существовать в двух таутомерных формах: бензоидной (бесцветной) и хиноидной (желтого цвета). Интенсивность окраски зависит от рН среды. Добавление гидроксида натрия усиливает окраску до ярко-желтой ввиду образования хорошо диссоциирующей соли:
Б) с концентрированной азотной кислотой. В результате взаимодействия фенола с концентрированной азотной кислотой образуется пикриновая кислота (желтый осадок)
8.Нитрозореакция Либермана. Окрашенный продукт образуют фенолы, у которых в орто- и пара-положениях отсутствуют заместители. Для этого крупинку фенола помещают в фарфоровую чашку и смачивают 2-3 каплями раствора натрия нитрита в кислоте серной концентрированной. Наблюдается окрашивание, изменяющееся при добавлении раствора натрия гидроксида
Чистота:
Количественное определение: Фенол 1.Броматомерия (способ обратного титрования). Метод количественного определения основанный на электрофильном замещении атомов водорода ароматического кольца на бром, выделенный в реакции бромата калия с бромидом калия в кислой среде (соляная или серная кислота). Вводят избыток бромата калия, добавляют калия бромид, создают кислую среду, выдерживают нужное для бромирования время, после чего избыток брома определяют йодометрически.
2.Иодометрия (способ обратного титрования). Титрант – 0,1 М раствор иода. Избыток иода титруют 0,1 М раствором тиосульфата натрия.
3.Иодхлорметрия (способ обратного титрования). Титрант – 0,1 М раствор иодмонохлорида. Избыток иодмонохлорида взаимодействует с калия иодидом с образованием иода, который титруют 0,1 М раствором тиосульфата натрия.
Резорцин 1.Броматомерия (способ обратного титрования). Метод количественного определения основанный на электрофильном замещении атомов водорода ароматического кольца на бром, выделенный в реакции бромата калия с бромидом калия в кислой среде (соляная или серная кислота). Вводят избыток бромата калия, добавляют калия бромид, создают кислую среду, выдерживают нужное для бромирования время, после чего избыток брома определяют йодометрически.
2.Иодометрия (способ обратного титрования). Титрант – 0,1 М раствор иода. Избыток иода титруют 0,1 М раствором тиосульфата натрия.
3.Иодхлорметрия (способ обратного титрования). Титрант – 0,1 М раствор иодмонохлорида. Избыток иодмонохлорида взаимодействует с калия иодидом с образованием иода, который титруют 0,1 М раствором тиосульфата натрия.
4.Цериметрия (способ обратного титрования). Титрант – 0,1 М раствор сульфата церия (IV). Избыток сульфата церия (IV) взаимодействует с калия иодидом с образованием иода, который титруют 0,1 М раствором тиосульфата натрия.
Тимол 1.Броматомерия (способ прямого титрования). Метод количественного определения основанный на электрофильном замещении атомов водорода ароматического кольца на бром, выделенный в реакции бромата калия с бромидом калия в кислой среде (соляная или серная кислота). Тируют броматом калия в присутствии бромида калия с индикатором метиловым оранжевым или метиловым красным от розовой окраски до обесцвечивания.
Особенности хранения
Лекарственные формы и их применение в медицинской практике
4. Выполнить тестовое задание по теме (правильный ответ отметить *) 1. ФЕНОЛЬНЫЙ ГИДРОКСИЛ СОДЕРЖАТ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ: a. бензоат натрия b. салицилат натрия с. фенол d. резорцин e. тимол 2. ЛЕКАРСТВЕННОЕ СРЕДСТВО, ВЫРАЖЕННОЕ ФОРМУЛОЙ ПО ХИМИЧЕСКОЙ КЛАССИФИКАЦИИ ОТНОСИТСЯ К 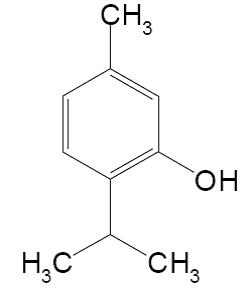 a. фенолам b. углеводам c. спиртам d. терпенам 3. ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ВЫРАЖЕННЫЕ ФОРМУЛАМИ ПРОЯВЛЯЮТ КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА 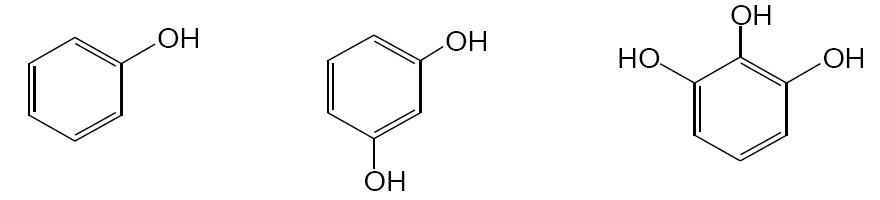 a. слабые кислотные b. сильные основные c. слабые основные d. амфотерные 4. ПРИРОДНЫЙ ИСТОЧНИК ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА ТИМОЛ 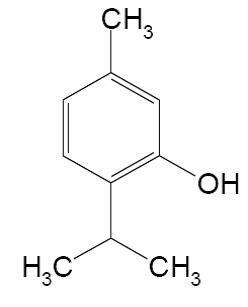 a. эфирное масло чабреца b. мятное масло c. щитовидные железы убойного скота d. надпочечники крупного рогатого скота 5. УКАЖИТЕ, КАКИЕ РЕАКЦИИ ПОДТВЕРЖДАЮТ НАЛИЧИЕ ФЕНОЛЬНЫХ ГИДРОКСИЛОВ В РЕЗОРЦИНЕ: a. взаимодействие с хлоридом железа (Ш) b. реакция Либермана c. образование ауринового красителя d. образование азокрасителя 6. КАКОЙ АНАЛИТИЧЕСКИЙ ЭФФЕКТ БУДЕТ НАБЛЮДАТЬСЯ, ЕСЛИ К ФОРМАЛЬДЕГИДУ ПРИБАВИТЬ КИСЛОТУ СЕРНУЮ КОНЦЕНТРИРОВАННУЮ И ФЕНОЛ: a. фиолетовое окрашивание b. красный осадок c. красное окрашивание d. белый осадок e. оранжевое окрашивание 7. ОБЩЕЙ РЕАКЦИЕЙ ДЛЯ ТИМОЛА И МЕНТОЛА ЯВЛЯЕТСЯ a. ацетилирование b. комплексообразование с железа (III) хлоридом c. образование азокрасителя d. образование индофенового красителя 8. УКАЖИТЕ ХИМИЧЕСКИЕ ПРОЦЕССЫ, КОТОРЫЕ ПРОИСХОДЯТ ПРИ НЕПРАВИЛЬНОМ ХРАНЕНИИ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, СОДЕРЖАЩИХ В МОЛЕКУЛЕ ФЕНОЛЬНЫЙ ГИДРОКСИЛ a. восстановление b. полимеризация c. гидролиз d. конденсация e. окисление 9. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ТИМОЛА БРОМАТОМЕТРИЧЕСКИМ МЕТОДОМ ОСНОВАНО НА ЕГО СПОСОБНОСТИ К РЕАКЦИИ a. электрофильного замещения b. комплексообразования c. полимеризации d. конденсации 10. МОЛЯРНАЯ МАССА ЭКВИВАЛЕНТА РЕЗОРЦИНА ПРИ БРОМАТОМЕТРИЧЕСКОМ ТИТРОВАНИИ РАВНА a. 1/4 М.м. резорцина b. 1/2 М.м. резорцина c. 1/8 М.м. резорцина d. 1/6 М.м. резорцина e. 1/3 М.м. резорцина 11. ФЕНОЛЬНЫЙ ГИДРОКСИЛ ОТНОСИТСЯ К ОРИЕНТАНТАМ a. 1 рода b. 2 рода 12. РЕАКЦИЯ БРОМИРОВАНИЯ АРОМАТИЧЕСКОГО КОЛЬЦА У ЛЕКАРСТВЕННЫХ СРЕДСТВ, СОДЕРЖАЩИХ ФЕНОЛЬНЫЙ ГИДРОКСИЛ ОСНОВАНА НА a. электрофильном замещении водорода в орто- и пара- положениях на бром с образованием нерастворимого бромпроизводного b. нуклеофильном замещении водорода в орто- и пара- положениях на бром с образованием нерастворимого бромпроизводного c. электрофильном замещении водорода в орто- и мета- положениях на бром с образованием нерастворимого бромпроизводного d. электрофильном замещении водорода в мета- положении на бром с образованием нерастворимого бромпроизводного 13. РЕАКЦИЯ ОБРАЗОВАНИЯ ИНДОФЕНОЛОВОГО КРАСИТЕЛЯ У ФЕНОЛОВ ОСНОВАНА НА a. окислении фенолов до хинонов, которые при конденсации с аммиаком или аминопроизводным и избытком фенола образуют краситель b. восстановлении фенолов до хинонов, которые при конденсации с аммиаком или аминопроизводным и избытком фенола образуют краситель 14. РЕАКЦИЯ БРОМИРОВАНИЯ ФЕНОЛА ПРИВОДИТ К ОБРАЗОВАНИЮ a. 2,4,6-трибромфенола b. 2,5,6-трибромфенола c. 4,6-дибромфенола d. 3-бромфенола 15. ФЕНОЛ ПОЛУЧАЮТ a. из каменноугольной смолы b. из бензола методом сульфирования c. путем алкилирования бензола пропиленом d. из тимьяна 16. ТИМОЛ ПОЛУЧАЮТ a. из каменноугольной смолы b. из пара-цимола c. из мета-крезола d. из тимьяна 17. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ТИМОЛА ПРОВОДЯТ a. методом броматометрии, способ – прямое титрование b. методом броматометрии, способ – обратное титрование 18. БРОМАТОМЕТРИЧЕСКИМ МЕТОДОМ (СПОСОБ – ОБРАТНОЕ ТИТРОВАНИЕ) КОЛИЧЕСТВЕННО ОПРЕДЕЛЯЮТ a. тимол b. фенол c. резорцин d. кислота салициловая 19. ПРИ БРОМАТОМЕТРИЧЕСКОМ МЕТОДЕ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ФЕНОЛОВ (СПОСОБ - ПРЯМОЕ ТИТРОВАНИЕ) В КАЧЕСТВЕ ИНДИКАТОРА ИСПОЛЬЗУЕТСЯ a. метиловый оранжевый b. метиловый красный c. крахмал d. калия хромат 20. ПРИ БРОМАТОМЕТРИЧЕСКОМ МЕТОДЕ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ФЕНОЛОВ (СПОСОБ - ОБРАТНОЕ ТИТРОВАНИЕ) В КАЧЕСТВЕ ИНДИКАТОРА ИСПОЛЬЗУЕТСЯ a. метиловый оранжевый b. метиловый красный c. крахмал d. калия хромат 21. НЕДОПУСТИМОЙ ПРИМЕЬЮ В РЕЦОРЦИНЕ ЯВЛЯЕТСЯ a. пирокатехин b. фенол c. м-крезол d. п- цимол 22. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ФЕНОЛОВ ПРОВОДЯТ СЛЕДУЮЩИМИ МЕТОДАМИ: a. броматометрический метод b. йодхлорметрический метод c. алкалиметрический метод нейтрализации в среде протофильного растворителя диметилформамида d. фотоколориметрический метод 23. ЛЕКАРСТВЕННЫЕ СРЕДСТВА С ФУНКЦИОНАЛЬНОЙ ГРУППОЙ ДАЮТ РЕАКЦИЮ ИДЕНТИФИКАЦИИ 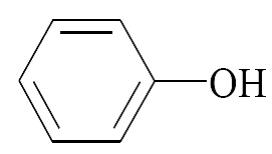 a. образование азокрасителя с диазореактивом b. нингидриновая проба c. этерификация со спиртами d. гидроксамовая проба 24. ИДЕНТИФИКАЦИЮ ЛЕКАРСТВЕННЫХ СРЕДСТВ, СОДЕРЖАЩИХ ФУНКЦИОНАЛЬНУЮ ГРУППУ МОЖНО ПРОВОДИТЬ С 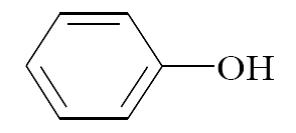 a. диазореактивом b. реактивом Драгендорфа c. реактивом Толленса d. реактивом Фелинга 25. ПРОДУКТОМ РЕАКЦИИ ВЗАИМОДЕЙСТВИЯ ЯВЛЯЕТСЯ 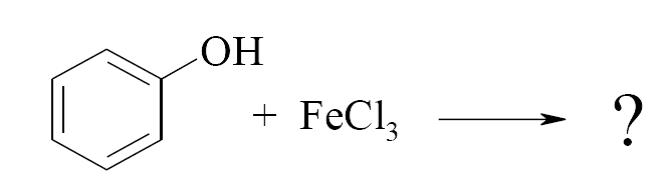 a. комплексная соль b. оксониевая соль c. гидроксамовая кислота d. соль диазония 26. ПРОДУКТОМ РЕАКЦИИ ВЗАИМОДЕЙСТВИЯ ЯВЛЯЕТСЯ 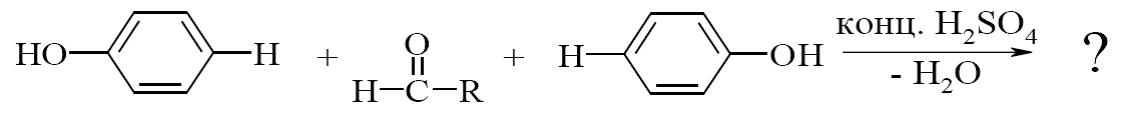 a. ауриновый краситель b. индофеноловый краситель c. сложный эфир d. азокраситель 27. ПРОДУКТОМ РЕАКЦИИ ВЗАИМОДЕЙСТВИЯ ЯВЛЯЕТСЯ 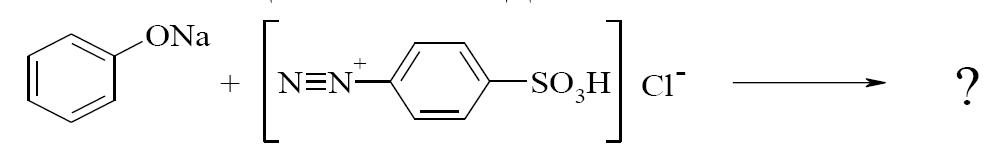 a. азокраситель b. ауриновый краситель c. сложный эфир d. индофеноловый краситель 28. ПРОДУКТОМ РЕАКЦИИ ВЗАИМОДЕЙСТВИЯ ЯВЛЯЕТСЯ 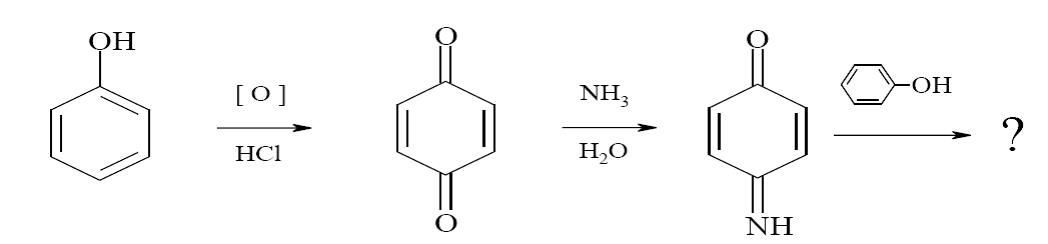 a. индофеноловый краситель b. ауриновый краситель c. сложный эфир d. азокраситель 29. Лекарственное средство, выраженное формулой по химической классификации относится к  a. углеводам b. фенолам c. спиртам d. терпенам 30. Тимол относится к следующей химической группе a. сапонины b. флавоноиды c. кумарины d. фенолы 31. Аналитическим эффектом реакции резорцина с раствором железа (III) хлорида является a. зеленое окрашивание b. сине-фиолетовое окрашивание c. бурый осадок d. выделение газа 32. При добавлении к фенолу аммиака и гипохлорита натрия наблюдается синее окрашивание за счёт протекания реакций a. комплексообразования, образование фенолята натрия b. хлорирования и окисления фенола c. замещения фенольного гидроксила на галоген d. окисления и конденсации, образования индофенолового красителя 33. Процессу окисления при хранении наиболее подвержены a. карбоновые кислоты b. гетероциклические азотсодержащие вещества c. сложные эфиры d. фенолы 34. Химический процесс, происходящий в лекарственных препаратах, содержащих в молекуле фенольный гидроксил, из-за неправильного хранения, называется a. окисление b. восстановление c. гидролиз d. конденсация 35. Изменение внешнего вида лекарственных соединений производных фенолов при хранении связано с a. гидролизом b. окислением c. дегидратацией d. восстановлением 36. Изменение внешнего вида лекарственных средств производных фенола при хранении связано с a. восстановлением b. гидролизом c. окислением d. поглощением углекислого газа 37. Общей причиной изменения внешнего вида при несоблюдении условий хранения резорцина является a. гигроскопичность b. восстановление c. окисление d. выветривание кристаллизационной воды 38. Химическим процессом, происходящим при неправильном хранении лекарственных препаратов, содержащих в молекуле фенольный гидроксил, является a. восстановление b. гидролиз c. окисление d. конденсация 39. Тимол хранят в хорошо укупоренной таре, предохраняющей от действия света, потому что под влиянием света и в присутствии кислорода воздуха, приобретая розовое окрашивание, тимол постепенно a. восстанавливается b. окисляется c. гидролизуется d. изомеризуется 40. При нарушении герметичности упаковки может окисляться кислородом воздуха a. тимол b. ментол c. валидол d. борная кислота 41. При неправильном хранении резорцин подвержен a. восстановлению b. окислению c. поглощению углекислого газа d. поглощению влаги 42. Со временем при неправильном хранении розовое окрашивание приобретает a. кислота аскорбиновая b. резорцин c. кислота ацетилсалициловая d. глицин 5. Решить задачи (решить на занятии) 1) (1).Приведите уравнения химических реакций для количественного определения резорцина (Mr 110,11) методом обратной броматометрии, молярную массу эквивалента, титр по определяемому веществу. Укажите индикатор, переход окраски в точке конца титрования. Оцените качество резорцина по показателю «Количественное содержание», если точную навеску массой 0,30395 г растворили и довели водой до метки в мерной колбе вместимостью 100 мл. К 20,0 мл полученного раствора добавили 40,0 мл 0,1 моль/л (УЧ 1/6 КВrO3) раствора калия бромата (К=1,00), на титрование избытка которого пошло 6,7 мл 0,1 моль/л раствора натрия тиосульфата (К=1,01). На титрование контрольного опыта пошло 39,5 мл 0,1 моль/л раствора натрия тиосульфата. 2). (2). Приведите уравнения химических реакций для количественного определения тимола (Mr 150,22) методом броматометрии, молярную массу эквивалента, титр по определяемому веществу. Укажите индикатор, переход окраски в точке конца титрования и процесс, происходящий с индикатором. Оцените качество тимола по показателю «Количественное содержание» (должно быть не менее 99,0%), если навеску анализируемого образца массой 0,50075 г растворили и довели водой до метки в мерной кобле вместимостью 100 мл. На титрование аликвоты объемом 10,0 мл пошло 13,1 мл 0,1 моль/л (УЧ 1/6 KBrO3) раствора калия бромата (К=1,02). Укажите значение допустимого верхнего предела количественного содержания тимола согласно ФС. 3). Приведите уравнения химических реакций для количественного определения резорцина (Mr 110,11) методом йодхлорметрии, молярную массу эквивалента, титр по определяемому веществу. Укажите индикатор, переход окраски в точке конца титрования. Рассчитайте содержание резорцина (в %), если к навеска массой 0,07224 г прибавлено 50 мл 0,1 моль/л (УЧ ½ ICl) раствора иодмонохлорида (K = 1,00). На титрование избытка иодмонохлорида в основном опыте пошло 10,8 мл 0,1 моль/л раствора натрия тиосульфата (K = 1,01), в контрольном опыте 49,5 мл того же титранта. 5. Выполнить тестовое задание по «ДЕ 28 ФХ 3КУРС 6СЕМЕСТР АНАЛИЗ ЛС, ПРОИЗВОДНЫХ ФЕНОЛОВ» (неограниченное количество раз, результат по тесту должен быть более 70%) на образовательном портале https://educa.usma.ru/ Ф Фарм.химия Тестирование 6. Разбор темы и обсуждение полученных результатов |
