химия. ХИМИЯ. Решение. VэVм4 22,445,6 лмольэкв m(Me) Mэ(Me)V(Н2) Vэ (H2) 5Mэ (Ме) 69 6 Mз(Me)12,17 гмольэкв
 Скачать 45.85 Kb. Скачать 45.85 Kb.
|
|
Контрольное задание. Работу выполнил АТППз-11 группы Сахаров Андрей Номер студенческого билета: 222049 Номер варианта: 49         10. Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.) Вычислите молярную массу эквивалента, молярную массу и относительную атомную массу этого металла.
Ответ: Vэ (О2)=5,6л/моль-экв, Мэ(Ме)=12,17 г/моль-экв, М(Ме)=24,34 г/моль, Ar (Me)= 24.34а.е.м. 76. Нарисуйте энергетическую схему образования молекулярного иона H2+ и молекулы H2 по методу молекулярных орбиталей. Где энергия связи больше? Почему? ω 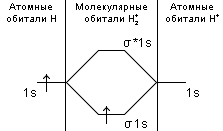 = =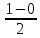 = 0,5 = 0,5 Порядок связи равен 0.5, значит молекулярный ион H2+ является энергетически устойчивой. ω= 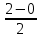 = 1 = 1 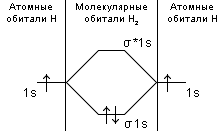 В молекуле H2 порядок связи равен 1, следовательно, данная молекула является энергетически устойчивой. Энергия связи в молекуле H2 больше, чем в молекулярном ионе H2+, так как порядок связи молекулы водорода больше H2, чем в молекулярном ионе H2+. 118. Определите, при какой температуре начнется реакция восстановления Fe3O4, протекающая по уравнению: Fe3O4(к) + CO(г) = 3FeO(к) + CO2(г); ΔH = +34,55 кДж. Fe3O4(к)+CO(г)=3FeO(к)+CO2(г);ΔH=+34.55 кДж. Δ 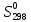 (х.р.)=Σ (х.р.)=Σ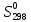 (прод.)−Σ (прод.)−Σ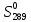 (исх) =3⋅54+213.65−(146.4+197.91)=31.34 Дж/моль⋅К=0.03134 кДж/моль (исх) =3⋅54+213.65−(146.4+197.91)=31.34 Дж/моль⋅К=0.03134 кДж/мольTравн.=ΔH/ΔS=34.55/0.03134=1102.43К Ответ: 1102.43К 139. Почему при изменении давления смещается равновесие системы N2 + 3H2 ⇄ 2NH3 и не смещается равновесие системы N2 + O2 ⇄ 2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакции в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем. N2+3H2⇄2NH3 Количество молей газов в системе изменяется, поэтому при изменении давления смещается равновесие системы. Например, при повышении давления в 3 раза, скорость прямой реакции увеличивается в 81 раз, а обратной в 9 раз:  = =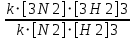 =81 =81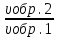 = =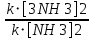 =9 =9Kр= 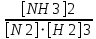 N2+O2⇄2NO Количество молей газов в системе не изменяется, поэтому при изменении давления равновесие системы не смещается. Например, при повышении давления в 3 раза, скорость прямой и обратной реакций увеличиваются в 9 раз: 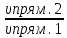 = =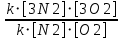 =9 =9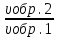 = =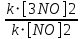 =9 =9kр= 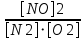 Ответ: При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество моль газов и наоборот. 156. Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор?
178. При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,372 . Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86
Ответ: M(в-ва)=92 г/моль. 198. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) FeCl3 и КОН; б) NiS0 4 и (NH4 )2S; в) MgC0 3 и HN0 3 . а) FeCl3 + 3KOH ⟶ 3KCl + Fe(OH)3↓ Fe3+ + 3Cl- + 3K+ + 3OH- ⟶ 3K+ + 3Cl- + Fe(OH)3↓ Fe3+ + 3OH- ⟶ Fe(OH)3↓ б) NiSO4 + (NH4)2S ⟶ (NH4)2SO4 + NiS↓ Ni2+ + SO42- + 2NH4+ + S2- ⟶ 2NH4+ + SO42- + NiS↓ Ni2+ + S2- ⟶ NiS↓ в) MgCO3 + 2HNO3 ⟶ Mg(NO3)2 + H2O + CO2↑ MgCO3 + 2H+ + 2NO3- ⟶ Mg2+ + 2NO3- + H2O + CO2↑ MgCO3 + 2H+ ⟶ Mg2+ + H2O + CO2↑ 231. Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается. P + HClO3 + H2O → H3PO4 + HCl H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + MnSO4 + K2SO4 + H2O 6P + 5HClO3 + 9H2O ⟶ 6H3PO4 + 5HCl
Po - 5e ⟶ P+5 Cl+5 + 6e ⟶ Cl- 5H3AsO3 + 2KMnO4 + 3H2SO4 ⟶ 5H3AsO4 + 2MnSO4 + K2SO4 + 3H2O
Mn+7 + 5e ⟶ Mn+2 249. При какой концентрации ионов Сu2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? E = 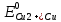 + + 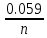 *lg [Cu2+] *lg [Cu2+] 0 = 0.34 + 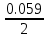 * lg [Cu2+] * lg [Cu2+]lg [Cu2+] = 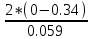 [Cu2+] = 10 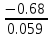 = 2.98 * = 2.98 * 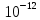 моль/л моль/л289. Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнении анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде. Химически чистое железо более стойко против коррозии, чем техническое железо, потому, что оно не содержит примесей, а соответственно в нем отсутствую гальванические пары. Коррозия технического железа во влажном воздухе: Анодный процесс: Fe - 2ē ⟶ Fe2+ Катодный процесс: 2H2O + O2 + 4ē ⟶ 4OH- Суммарный процесс: 2Fe + 2H2O + O2 ⟶ 2Fe(OH)2 Коррозия технического железа в кислой среде: Анодный процесс: Fe - 2ē ⟶ Fe2+ Катодный процесс: 2H+ + 2ē ⟶ H2 Суммарный процесс: Fe + 2H+ ⟶ Fe2+ + H2 439. Какие углеводороды называют олефинами (алкенами)? Приведите пример. Какая общая формула выражает состав этих углеводородов? Составьте схему получения полиэтилена. Алкенами называются углеводороды, молекулы которых содержат одну двойную связь. Алкены имеют общую формулу CnH2n. К алкенам, например, относится ацетилен CH2=CH2. Схема полимеризации этилена: nCH2=CH2 ⟶ (–CH2–CH2–)n |

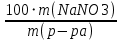
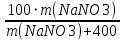
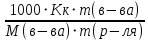
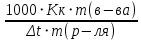 =
= 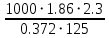 =0,92 г/моль
=0,92 г/моль