кр_вакцины. Вакцины (1). Биотехнология изготовления вакцин. Антитела
 Скачать 2.9 Mb. Скачать 2.9 Mb.
|
|
Биотехнология изготовления вакцин. Антитела – это специфические белки, которые образуются в ответ на введение в организм человека или теплокровных животных антигенов (бактерий, вирусов, белковых токсинов) и специфически с ними связываются. При электрофоретическом исследовании они мигрируют чаще вместе с глобулинами, поэтому их еще называют иммуноглобулинами (Ig). При попадании в организм антигена, В-лимфоциты трансформируются в плазматические клетки (плазмоциты), способные к синтезу антител. После выработки плазматическими клетками иммуноглобулины поступают в кровь или лимфу. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов. Важный фактор гуморального иммунитета.   Антигены (от греч. слов «против» и «создавать, производить») – любое вещество, которое организм рассматривает как чужеродное или потенциально опасное и против которого возникает иммунный ответ. Антитела выполняют две функции: • антиген-связывающую. Связываясь активными участками (центрами) с бактериями или вирусами, антитела препятствуют их размножению или нейтрализуют выделяемые ими токсические вещества. • эффекторную (вызывают иммунный ответ, например, запускают классическую схему активации комплемента). Все Ig обладают общими физическими и химическими свойствами, но отличаются биологическими признаками. Любая молекула антител имеет сходное строение (Y- образную форму – это четвертичная структура) и состоит из • двух тяжелых (Н) (длинных, от английского слова heavy) • двух легких (L) (коротких, от слова light) цепей, связанных дисульфидными мостиками.  Н-цепи и L-цепи имеют • постоянные (константные) С-области • вариабельные V-области. Благодаря вариабельным участкам (доменам) имеются антитела различной специфичности, способные взаимодействовать с большим количеством разных антигенов. Вариабельность обусловлена встраиванием или выпадением аминокислот из полипептидной цепи, замене одних аминокислот на другие, различными комбинациями Н- и L-цепей. В непосредственный контакт с антигеном вступает около 20 аминокислот обеих цепей. Каждая молекула антител имеет два одинаковых антигенсвязывающих фрагмента Fab (fragment antigen binding), определяющих антительную специфичность, и один Fc (fragment constant) фрагмент, который не связывает антиген, но обладает эффекторными биологическими функциями. Он взаимодействует со “своим” рецептором в мембране различных типов клеток (макрофаг, тучная клетка, нейтрофил).  Активный центр антител (антигенсвязывающий участок, участок комплементарности) – участок молекулы антител, образованный V-доменами тяжелых и легких цепей, в силу своей чрезвычайно высокой вариабельности способный распознавать (на основе пространственного соответствия) и связывать эпитопы антигена (часть макромолекулы антигена, которая распознаётся иммунной системой). Основой вариабельности активных центров являются гипервариабельные участки тяжелых и легких цепей (по 3 в каждой цепи). Антигенсвязывающий центр антител комплементарен эпитопу антигена по принципу “ключ – замок”. Связывание антитела с активным центром антигена напоминает связывание ферментов с субстратами, они должны быть комплементарны друг другу, т.е. дополнять один другого. ВАКЦИНЫ Вакцины – это препараты для создания активного искусственно приобретенного иммунитета. Действующее начало вакцин – специфический антиген. В ответ на введение вакцины, в организме хозяина вырабатываются антитела к патогенному м/о, которые при последующей инфекции приводят к его инактивации (нейтрализации или гибели), блокируют его пролиферацию и не позволяют развиться заболеванию. Вакцины надо отличать от иммунных сывороток. Цель вакцины – заставить организм самостоятельно вырабатывать антитела к антигену (бактерии, вирусу). А иммунные сыворотки содержат уже готовые антитела к бактерии или вирусу, т.е. ее вводят с лечебной целью (когда человек уже заболел и его надо вылечить), для создания пассивного иммунитета. Сыворотки вводят при многих инфекционных заболеваниях (столбняк, дифтерия) и отравлениях (ядами змей). Метод лечения сыворотками с антителами – серотерапия. Сыворотки вводят внутримышечно или, реже, внутривенно. А получают сыворотки чаще всего путём гипериммунизации лошадей. Живые вакцины Живые вакцины готовят из штаммов бактерий и вирусов с ослабленной (или утраченной) вирулентностью, но сохранивших иммуногенность. Вирулентность (от лат «ядовитый») – степень способности данного инфекционного агента (бактерии, вируса) заражать данный организм. Иммуногенность – это способность антигена вызывать иммунный ответ. Ослабленные микробы – это вакцинные штаммы. Вакцинные штаммы микробов сохраняют способность размножаться в месте введения и распространяться по организму. В результате этого возникает вакцинная инфекция (заболевание протекает в легкой форме). Вакцинная инфекция всегда приводит к формированию иммунитета к патогенным микробам данного вида, к которым относится вакцинный штамм. Живые вакцины применяют для профилактики туберкулеза, полиомиелита, кори, желтой лихорадки, туляремии, бруцеллеза, эпидемического паротита и других заболеваний. Преимущества живых вакцин: • создают прочный и длительный иммунитет (обычно их вводят однократно в течение жизни) • могут вводиться в организм достаточно простым методом, напр., скарификационным или пероральным методом; • большинство живых вакцин выпускается в сухом лиофилизированном виде; • имеют достаточно длительный (до года и более) срок годности; • следует хранить и транспортировать при 4–8 °С. Замораживание таких вакцин не оказывает существенного влияния на их активность; • не содержат консервантов, при работе с такими вакцинами следует строго соблюдать правила асептики. Недостатки живых вакцин: • может быть недостаточно аттенуирована и вызывать свое природное заболевание с низкой частотой; • может быть полностью аттенуирована (что значительно снижает иммуногенность); • благодаря тому, что живая вакцина может реплицироваться, существует потенциальная возможность ее превращения в патогенную форму; • живые вакцинные штаммы могут передаваться из вакцины невакцинированному человеку, что важно в случае, если рецепиент обладает иммунодефицитом или подвергается химиотерапии. • могут вызывать сенсибилизацию (повышение чувтсивтельности) организма, содержат большой набор антигенов, среди которых могут встречаться и перекрестно peaгирующие с антигенами человека, вызывают большую нагрузку на иммунную систему. Способы получения вакцинных штаммов: а) метод отбора мутантов с ослабленной вирулентностью; Вирусные мутанты могут отбираться по их способности к росту при различных температурах. Термочувствительные (не способные к росту при повышенной температуре) или адаптированные к холоду вирусы, отобранные по способности к росту при температуре ниже физиологической (до 250). Идея в том, что вирусы будут менее активными при росте in vivo, чем их родительские вирусы дикого типа, а значит и менее вирулентными. Благодаря многократным пассажам на куриных эмбрионах в условиях сниженной температуры стало возможным получение ослабленного вируса гриппа, который не реплицируется при высоких температурах, характерных для легких человека, но способен размножаться в носоглотке при Т=340, вызывая локальную инфекцию. Также для получения аттенуированного штамма используют химический мутагенез с последующей селекцией. Так был получен штамм для предотвращения брюшного тифа. б) метод направленного (искусственного) снижения вирулентности (выращивание на неблагоприятных питательных средах, длительное пассирование(последовательное заражение) через организм маловоспримчивых лабораторных животных); в) метод генной инженерии (инактивация или делеция гена, который отвечает за образование факторов вирулентности патогенных микробов). Преимущество: обратная мутация очень маловероятна. Пример: в гене вируса простого герпеса, кодирующего гликопротеин, необходимый для проявления инфекционности, была создана мутация. Этот гликопротеин вводится в вирус из клеточной линии в ходе культивирования in vitro, благодаря этому полученный вирус может инициировать инфекцию in vivo, но не способен распространяться. Контструировать аттенуированные бактерии сложнее, чем вирусы, из-за значительного большего размера бактериального генома. Стратегия состоит в выявлении гена (-ов), ответственных за бактериальную вирулентность или колонизацию и выживание и удаление гена (предпочтительный вариант), либо исключение его экспрессии in vivo. Пример: вакцины холеры. •дивергентные вакцины – препараты из живых микробов, не болезнетворных для человека, но сходных по антигенным свойствам с болезнетворными микробами. Например, для прививки против оспы человека используют вирус оспы коров. Этот эффект открыл в 1796 г. врач Дженнер. Однако в природе не всегда возможно найти малопатогенный аналог болезнетворного микроорганизма, пригодный для приготовления вакцины. Другой пример: БЦЖ, которую получают из микобактерий бычьего туберкулеза. Убитые (инактивированные, неживые) вакцины Примеры убитых вакцин: против брюшного тифа, холеры, коклюша, клещевого энцефалита. Основной способ введения таких вакцин – подкожно или внутримышечно. Их проще готовить, чем живые (не надо долго наблюдать за вакцинным штаммом бактерий или вирусов и изучать их свойства). Однако убитые вакцины, как правило, создают менее прочный и длительный иммунитет по сравнению с живыми, их необходимо вводить несколько раз и в основном с адъювантами. Адъювант – это вещество, которое стимулирует повышенный иммунный ответ на совместно введенный антиген. Обычно адъюванты способны депонировать антиген, т.е. адсорбировать его на своей поверхности и длительное время сохранять в организме, что увеличивает продолжительность его влияния на иммунную систему. В качестве адъювантов используют минеральные коллоиды (фосфат алюминия, фосфат кальция, гидрат окиси алюминия, алюмо-калиевые квасцы), полимерные вещества (липополисахариды, синтетические полимеры), растительные вещества (сапонины) и др. Убитые вакцины способны к сенсибилизации организма, создают большую нагрузку на иммунную систему, могут быть реактогенными и токсичными. Корпускулярные вакцины Это препараты из инактивированных культур патогенных (высоковирулентных) или вакцинных штаммов бактерий и вирусов. Способы инактивирования: 1) физические: температура, УФ-лучи, ионизирующее излучение; 2) химические – формалин, спирт, ацетон, b-пропиолактон. Корпускулярные вакцины из целых бактерий – цельноклеточные, а из целых (неразрушенных) вирусов – цельновирионные. Корпускулярные вакцины из разрушенных бактерий и вирусов называются субклеточными и субвирионными. Такие вакцины содержат антигенные комплексы, выделенные из бактерий и вирусов после их разрушения. В целом вакцины, в которых достигается максимальная очистка антигенов от токсичных примесей, называются субъединичными. Для создания любой субъединичной вакцины прежде нужно идентифицировать, те компоненты патогенных м/о которые индуцируют выработку антител. Достоинства субъединичных вакцин: Препарат содержит очищенный иммуногенный вирусный белок, который безопасен и стабилен. Его химические свойства известны. В нем отсутствуют дополнительные балластные белки и нуклеиновые кислоты, которые могли бы вызвать нежелательные побочные эффекты при вакцинации в организме хозяина. Недостатки субъединичных вакцин: Очистка полученного белка стоит дорого. Конформация (пространственная форма) выделенного белка может отличаться от той, которую он имеет in situ (т.е. в составе вируса), что может приводить к изменению его антигенных свойств (на него будет хуже реагировать иммунная система). Молекулярные вакцины (анатоксины) Молекулярные вакцины – это специфические антигены в молекулярной форме. Они могут быть получены путем биосинтеза, химического синтеза и генной инженерии. Это препараты, в которых антиген представлен метаболитами патогенных микроорганизмов, чаще всего молекулярных бактериальных экзотоксинов – анатоксинов (токсоидов) (вещества, вырабатываемые бактериями и выделяемые ими в окружающую среду, оказывают токсическое действие на человека). Анатоксины выпускаю в форме моно- (дифтерийный, столбнячный, стафилококковый) и ассоциированных (дифтерийно-столбнячный, ботулинический трианатоксин) препаратов. Моновакцины – вакцины, применяемые для создания невосприимчивости к одному возбудителю (моновалентные препараты). Ассоциированные препараты – для одномоментного создания множественной невосприимчивости, в этих препаратах совмещаются антигены нескольких микроорганизмов (как правило, убитых). Наиболее часто применяются: адсорбированная коклюшно-дифтерийно-столбнячная вакцина (АКДС-вакцина), тетравакцина (вакцина против брюшного тифа, паратифов А и В, столбнячный анатоксин), АДС-вакцина (дифтерийно-столбнячный анатоксин). Анатоксины могут быть получены путем биосинтеза, химического синтеза и генной инженерии. Метод биосинтеза из микроба или из культуральной жидкости выделяют протективный антиген (совокупность эпитопов, которые вызывают наиболее сильный иммунный ответ). Например, возбудители дифтерии, ботулизма, столбняка при росте синтезируют и выделяют в культуральную жидкость молекулы экзотоксинов. После обработки формалином экзотоксины теряют свои токсические свойства, но сохраняют антигенность и иммуногенность. Обычный источник токсинов – промышленно культивируемые естественные штаммы-продуценты. В основе процесса обезвреживания токсина – необратимое изменение участка его белковой молекулы, ответственного за проявление токсичности, при полном сохранении антигенной активности. Недостатки химической инактивации токсина: • изменение защитных эпитопов, ведущее к снижению иммногенности • возможность реверсии Генетическая инактивация: Для получения стабильных анатоксинов коклюша создавалась мутация кодонов аминокислот, требуемых для биологической активности токсин. Измененный ген заменил собой нативный ген в родительском организме, на основе которого был получен иммуногенный, но стабильно инактивированный анатоксин коклюша. Усовершенствованный вариант этой стратегии – в токсин коклюша были введены две мутации для невозможности реверсии. Химический синтез Получение молекулярных вакцин методом химического(искусственного) синтеза – новое направление. Некоторые низкомолекулярные антигены получены методом химического синтеза. Кроме того, получают синтетические высокомолекулярные носители и соединяют их с естественными антигенами. Например, гриппозная вакцина состоит из антигенов вируса гриппа и полиоксидония, который обладает выраженными адъювантными свойствами.  https://www.youtube.com/channel/UCG5TBPANNSiKf1Dp-R5Dibg Большое внимание уделяется разработке липосомных вакцин, которые представляют собой комплексы, состоящие из антигенов и лиофильных носителей. Иммунолипосомы более энергично стимулируют выработку гуморального и клеточного иммунитета. СПЛИТ-вакцины (расщепленные) Расщепленные вакцины, содержащие отдельные наружные и внутренние частички вакцинного вируса гриппа. Пример: вакцина от гриппа (Ваксигрип, Бегривак, Флюарикс), которая содержит только поверхностные антигены вируса – гемагглютинин и нейраминидазу, и не содержит внутренних вирусных белков.    Рекомбинантные (генно-инженерные) вакцины Пути создания генно-инженерных вакцин: 1. Внесение генов вирулентности в авирулентные или слабовирулентные микроорганизмы (векторные вакцины). В геном вакцинного штамма встраивают ген (вектор), контролирующий образование антигенов другого возбудителя (чужеродного антигена). Пример: в штамм вируса оспенной вакцины встраивают антиген вируса гепатита В (HBs – антиген поверхностный белок, нужен для адсорбции вируса на гепатоцитах). Такая векторная вакцина создает иммунитет и против оспы и против гепатита В. 2. Внесение генов вирулентности в неродственные микроорганизмы с последующим выделением антигенов и их использованием в качестве иммуногена. Если патогенные м/о не растут в культуре, гены или их сегменты, кодирующие основные антигенные детерминанты (белки) патогенных микроорганизмов, экспрессируют в альтернативном хозяине, например Е. coli, получают нужный продукт в большом количестве и используют его как вакцину. Пример: с 1987 г стали доступны рекомбинантные вакцины, вырабатываемые дрожжами и содержащие главный поверхностный белок вируса гепатита В – S-белок (США и Бельгия). Вакцина признана безопасной на основе введения 12 млн доз, введенных детям в возрасте до 12 месяцев. Полученная вакцина вытеснила вакцину на основе плазмы. Кроме того ген этого белка экспрессировали в трансгенных листьях табака и клубнях картофеля. Обычно более мелкие белки, не требующие посттрансляционых модификаций, могут экспрессироваться в исходной форме в микробной системе экспрессии. Полипептиды, которым для иммуногенности требуется посттрансляционная модификация, экспрессируются в клеточных линиях млекопитающих. Часто возможно идентифицировать в составе полипетида В-клеточные эпитопы, против которых направлено действие антител. Многие В-клеточные эпитопы являются конформационными, образующимися вследствие наложения в трехмерном пространстве остатков аминокислот из различных частей полипептида, т.е. таким эпитопам для иммуногенности. В отличие от этого другие пептидные эпитопы линейны и обладают всеми антигенными свойствами даже в виде коротких линейных последовательностей. Пример. В случае вируса простого герпеса 1-го типа таким компонентом является гликопротеид Д оболочки. В ответ на введение этого гликопротеида мышам у них вырабатываются антитела, нейтрализующие вирус герпеса. Ген простого гликопротеида Д был изолирован, клонирован в одном из экспериментальных векторов в клетках млекопитающих и введен в яйцеклетку китайского хомяка, который секретирует (выделяет) его во внешнюю среду. Используют клетки млекопитающего (хомяка) вместо кишечной палочки, так как необходима пострансляционная модификация антигена, чтобы на него реагировала иммунная система человека. Полноразмерный ген, кодируемый белок в норме связывается с мембранной клетки млекопитающего. Такой белок труднее очистить чем растворимый поэтому такой ген модифицируют удалив ту его часть которая кодирует С концевой трансмембранный домен. Затем модифицированным геном трансформируют яйцеклетку китайского хомяка, который секретирует его во внешнюю среду. Клеточные мембраны испытуемых показали, что антитела вырабатываемые в ответ на введенный модифицированный белок аффективен в отношении вируса герпеса 1-го и 2- го типа. Некоторые патогенные м/о действуют опосредовано вызывая развитие аутоиммунной реакции на инфицированные клетки хозяина. Для таких заболеваний можно создать систему специфичного уничтожения клеток мишеней конструированием генов, кодирующий химерный белок. Одна часть, которой будет связываться с инфицирующей клеткой, а др. уничтожать ее. Эта система не является истинной вакциной, хотя и действует только на инфицированные клетки, устраняя саму причину развития аутоиммунной реакции. 3. Искусственное удаление генов вирулентности и использование модифицированных организмов в виде корпускулярных вакцин. Селективное удаление генов вирулентности открывает широкие перспективы для получения стойко аттенуированных штаммов шигелл, токсигенных кишечных палочек, возбудителей брюшного тифа, холеры и др. бактерий. Возникает возможность для создания поливалентных вакцин для профилактики кишечных инфекций. Носители, основанные на полисахаридах Некоторые бактерии образуют капсульную структуру, содержащую полисахариды. Капсульные антигены играют важную роль в вирулентности и иммуногенности бактерий. Капсульные антигены способны подавлять фагоцитоз бактерий. Капсульные полисахариды – это эффективные вакцинные антигены. Пример: вакцина против пневмококков. Коньюгированные вакцины Дети младше 2-х лет не способны эффективно распознать имуногены, независимые от Т-клеток (TI, к ним относятся капсульные полисахариды), они могут проявлять иммунологические реакции на зависимые от Т-клеток имуногены (TD, например, белки). Химическая коньюгация полисахарида с белком-носителем превращает его в TD-иммуноген. Поэтому вакцины в виде таких коньюгатов могут стимулировать защитный иммунитет у младенцев и маленьких детей. ДНК-вакцины (генные, полинуклеотидные вакциы, вакцины из нуклеиновых кислот) 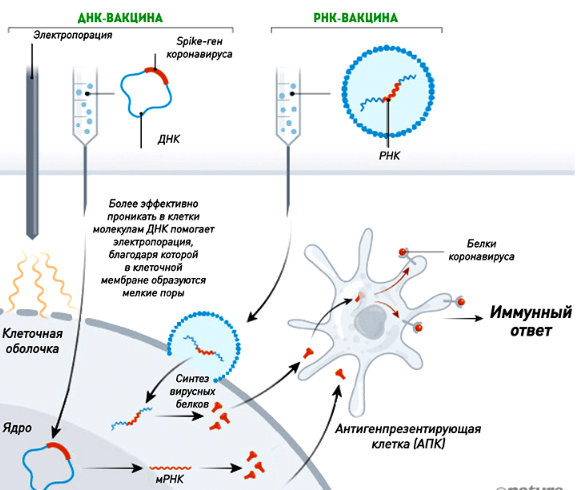 https://youtu.be/Quh0JrwXG_0 Новый подход, позволяющий индуцировать у организма иммунный ответ без введения антигена, основанный на включении в клетки животного-мишени гена, кодирующего белок-антиген и генетических элементов, которые необходимы для экспрессии этого гена в клетках эукариотов. ДНК → мРНК → белок (в данном случае антиген) Т.е. раньше в составе вакцины мы вводили готовый антиген. В ДНК-вакцине мы вводим ген (участок ДНК), кодирующий белок-антиген. Антиген синтезируется уже в организме человека или животного, которого мы вакцинировали. В качестве продуцентов таких генов используют бактериальные клетки, содержащие рекомбинантные плазмиды с соответствующими генами. После получения достаточной биомассы (количества копий) плазмидную ДНК выделяют из бактерий, очищают от других молекул ДНК и примесей. Полученную ДНК-вакцину вводят парентерально, при этом большая ее часть поступает в межклеточное пространство, после чего включается в клетки. Доставка вакцины в ядра клеток может осуществляться либо «выстреливанием» безыгольным инъектором микробной ДНК в кожу, либо с помощью жировых шариков-липосом, содержащих вакцину, которые будут активно поглощаться клетками. На рисунке – одноразовый генный пистолет, с помощью которого вводят ДНК-вакцины.  Преимущества ДНК-вакцин: стабильны и не инфекционны; могут быть получены в большом количестве; дают возможность в перспективе получать многокомпонентные вакцины, содержащие две или несколько плазмид, кодирующих разные антигены, цитокины или другие биологически активные молекулы. Проблемы ДНК-вакцин: неизвестны сроки, в течение которых клетки организма будут вырабатывать чужеродный белок (обычно мы вводим белок-антиген, его уничтожают антитела человека. А в случае ДНК-вакцин мы вводим ген, на котором будут постоянно синтезироваться все новые антигены). Чаще всего ДНК-вакцины сохраняются в организме в течение 3 – 4 недели, но сроки для каждой вакцины могут меняться; если образование антигена в организме будет продолжаться длительное время (до нескольких месяцев), это может привести к развитию иммуносупрессии; образующийся чужеродный белок может обладать побочным биологическим действием: чужеродная ДНК может вызвать образование анти-ДНК-антител, которые способны индуцировать аутоагрессию и иммунопатологию; не исключена онкогенная опасность: вводимая ДНК, встраиваясь в геном клетки человека, может индуцировать развитие злокачественных опухолей. В последнее время в качестве векторов используют также вирусы. Например,векторы на основе альфа-вирусов – вирус венесуальского энцефаломиелита лошадей (избирательно патогенен для лошадей). Из множества разработанных ДНК-вакцин на сегодняшний день лицензировано всего несколько, при чем только для животным. мРНК вакцины Они похожи на ДНК-вакцины, однако мы сразу перескакиваем к этапу мРНК. мРНК → белок (антиген) Важно что разработка и испытания мРНК-вакицины занимает существенно меньше времени, чем разработка других видов вакцин (которые мы разбирали раньше). На протяжении многих лет большой проблемой с мРНК-вакцинами была стабильность мРНК: ей нужно не деградировать (разрушаться) после введения, а эффективно проникать в клетки, чтобы на ней синтезировался белок. На данный момент многие из этих вопросов практически решены путем внесения изменений в саму последовательность РНК и в рецептуру раствора, в виде которого она находится перед введением. Правда, ДНК-вакцины все равно существуют дольше мРНК-вакцин. Кассетная (экспозиционная) вакцина Носителем антигенности служит белковая структура, на поверхности которой располагаются (экспонируются) введенные в нее генно-инженерным или химическим путем соответствующие детерминанты либо одной специфичности, либо разных. Белковые вакцины В настоящее время биотехнологии позволяют выявлять новые вакцинные антигены. Как только получена полная последовательность геномной ДНК или РНК, выявляются открытые рамки считывания. Полученную аминокислотную последовательность можно проверить на гомологию с белками других родственных патогенных организмов, являющихся кандидатами для создания вакцин, или гидрофобные N-концевые последовательности, предполагающие поверхностную локализацию. Гены экспрессируются в рекомбинантных клетках хозяина (обычно E. Coli), а рекомбинантный полипептил очищается и используется для иммунизации животных с целью получения поликлональных антител, чтобы выявить, вырабатывается ли патогенным организмам искомый белок. Антисыворотку можно использовать для биологических анализов, чтобы проверить, стоит ли данный белок использовать для создания вакцины. Новый белок также можно использовать для иммунизации животной модели. С помощью данной технологии выявили вероятные вакцинные антигены вирусов гепатита С, гепатита Е. Вакцины, содержащие продукты генов главного комплекса гистосовместимости (ГКГС) На цитоплазматических мембранах практически всех клеток макроорганизма обнаруживаются антигены гистосовместимости. Они играют ключевую роль в осуществлении специфического распознавания «свой-чужой» и индукции приобретенного иммунного ответа Протективные пептиды вакцинных антигенов презентируются Т-лимфоцитам в комплексе с антигенами ГКГС. При этом каждый протективный эпитоп может презентироваться с высоким уровнем иммунного ответа только определенным продуктом ГКГС. Для эффективной презентации антигена в состав вакцин предполагается вводить готовые антигены ГКГС или их комплексы с протективными эпитопами. Антиидиотипические вакцины Антиидиотипические антитела — «зеркальное отражение» антигена, способны вызывать образование антител, реагирующих с детерминантной группой антигена. В настоящее время этот подход утратил популярность. Перспективные способы введения вакцин: Съедобные (растительные) вакцины разработаны экспериментально на основе трансгенных растений, в геном которых встроен фрагмент генома патогенного микроорганизма. Первая съедобная вакцина была получена в 1992 г.: трансгенное растение табака стало продуцировать «австралийский» антиген. Частично очищенный, этот антиген вызывал мощный иммунный ответ против вируса гепатита В у мышей. Затем были получены «табачная» вакцина против кори; «картофельные» вакцины против холеры, энтеропатогенной кишечной палочки, ВГВ; «томатные» антирабические вакцины. Преимущества съедобных вакцин: оральный способ иммунизации является самым безопасным и доступным; ассортимент пищевых источников растительных вакцин не ограничен; возможность использования «вакцинных продуктов» в сыром виде; низкая себестоимость. Проблемы «съедобных вакцин»: сложность определения времени «созревания» вакцин; плохо переносят хранение; сложность дозировки, так как условия культивирования влияют на синтез белка; трудности сохранения антигена в кислой среде желудка; возможность иммунного ответа на пищевые продукты. Гибридома Гибридома – это клеточный гибрид, образующийся в результате слияния опухолевой миеломной клетки и лимфоцита, продуцирующего определенные антитела. Гибридомы унаследовали от опухолевых клеток способность неограниченного размножения, а от клеток селезенки – синтезировать антитела предопределенной специфичности. Гибридомы были отмечены в 1984 году Нобелевской премией. Наибольшие успехи достигнуты при создании гибридом, синтезирующих моноклональные антитела, т.е. антитела, способные реагировать лишь с одним антигеном. Получение гибридом на основе миеломных клеток и иммунизированных лимфоцитов состоит из следующих этапов: Получение миеломных клеток Получение лимфоцитов – продуцентов антител к заданным антигенам. Животное иммунизируют введением определенного антигена. Затем выделяют клетки селезенки и от них отделяют лимфоциты. Проводят слияние опухолевых (миеломных) клеток с лимфоцитами. Слияющим агентом служат ПЭГ, вирус Сендай и лизолецитин, а так же электрический импульс. Отбор гибридных клеток. Для этого используют селективные среды (иммунизированные лимфоциты не способны расти в культуре и сразу погибают). Проверка способности гибридомных клеток продуцировать моноклональные антитела к заданному антигену. Клонирование гибридомных клеток, прошедших проверку на образование моноклональных антител, с контролем на стабильность их иммунных свойств. Получение массовых культур гибридомных клеток. Полученные на 6 этапе клоны можно клонировать еще раз, а можно заморозить. Гибридомные клетки из культуры можно выращивать и в организме животного – мыши или крысы. Гибридомные клетки вводят животному, опухоли из введенных клеток вырастают через 10-14 суток. Начиная с этого времени у животных берут сыворотку, содержащие высокие концентрации моноклональных антител. Области применения моноклональных антител • количественное определение различных веществ; • диагностика (идентификация определенного гормона, вирусных, бактериальных антигенов, антигенов группы крови и тканевых антигенов); • терапия • Их можно также использовать в целях пометы и точной идентификации специализированных клеток, таких, как нейроны, чтобы глубже изучить способы их взаимодействия и функционирование. Очень ценны моиоклональные антитела и для изучения клеточных мембран. Они могут выступать и в качестве стандартного реагента для обнаружения определенных молекул на клеточной мембране, а также для разделения популяций клеток, несущих на поверхности разные антигены. • для облегчения доставки лекарственного вещества. Присоединяют молекулы ЛВ к моноклональным антителам или их Fv-фрагментам, специфичным по отношению к белкам, находящимся на поверхности строго определенных клеток, например опухолевых.Либо используют ЛВ в неактивной форме, переводя их в активное состояние при помощи ферментов. Чтобы такое превращение происходило только вблизи клетки-мишени, фермент присоединяют к моноклональному антителу, специфичному к поверхностному антигену этой клетки. Разработка вакцины против коронавируса COVID-19 Виды разрабатываемых вакцин против SARS-CoV-2. Несмотря на обилие кандидатов и разнообразие подходов, до финиша, скорее всего, дойдут считанные вакцины: многие отсеются на стадии доклинических и клинических исследований. Наряду с обычными инъекционными препаратами разрабатывается несколько интраназальных вакцин (в том числе в питерском Институте экспериментальной медицины). Такие вакцины вводятся в виде назального спрея и в первую очередь защищают слизистые — «входные ворота» инфекции, — так как помимо иммуноглобулинов IgG, стимулируют еще и выработку IgA, которые играют заметную роль в противодействии возбудителям респираторных и кишечных заболеваний.  Сейчас по всему миру разрабатывают около 115 программ вакцинации. Некоторые из них уже вошли в клинические исследования, и число их будет быстро расти. Это вакцина mRNA1273 от компании Moderna, которая, как следует из названия, является мРНК-вакциной, и INO4800 от компании Inovio, представляющая собой ДНК-плазмиду. Также есть две клеточные вакцины из Шэньчжэньского геноиммунного медицинского института: LV-SMENP-DC, вакцина из дендритных клеток, модифицированных лентивирусными векторами для экспрессии вирусных белков, и вакцина из искусственных синтезирующих антигены клеток. И, наконец, есть более традиционная рекомбинантная белковая вакцина Ad5-nCoV от компании CanSino. Компания Sanofi сотрудничает с GSK (это две наиболее опытные и крупные организации в этой области). Sanofi готова предоставить спайк-белок (белок «шипа» коронавируса), а GSK – адъювант. Они говорят о готовности провести испытания вакцины на людях уже в конце 2020 года, а во второй половине 2021 года подготовить все необходимые регуляторные документы для одобрения препарата. Компания Pfizer объявила, что они ускоряют совместные с BioNTech разработки и, возможно, начнут испытания вакцины на людях уже в августе. Johnson&Johnson объявили, что у них есть кандидатный продукт, они запланировали первые испытания на людях в сентябре. По их запланированному графику данные получат к декабрю, а в январе 2021 года первые партии вакцины будут готовы для подачи на получение разрешения на экстренное использование.  Почему так долго? Наоборот, это очень быстрые сроки, таких еще не было. Рекорд по быстроте разработке вакцины установлен вакциной против вируса Эбола (около пяти лет). Стандартные же сроки разработки продукта такого рода – десять лет и более. Одна из причин такого быстрого старта вакцины Moderna заключается не только в том, что они разрабатывают мРНК-вакцины (как вы помните, наиболее быстрая разработка этого вида вакцин), но и в том, что шаг тестирования ее на животных был полностью пропущен. Отчасти это сделали из-за того, что до сих пор неясно, какая модель животного была бы наиболее информативной. Проблема в том, что вирусы SARS и nCoV-19 показывают различия в лабораторных тестах, и мы можем ожидать, что эти различия распространятся и на животные модели. Один из подходов в тестировании на животных заключается в том, чтобы разводить линию лабораторных животных (например, мышей или хомяков) с человеческой формой белка ACE2, который, по-видимому, имеет решающее значение для проникновения вируса. Это может быть полезно, но такую животную модель создавать достаточно долго, есть ли у нас на это время? Даже если пропустить тестирование на животных, необходимо провести тестирование эффективности вакцины для человека. Для этого надо ответить на следующие вопросы: Развивается ли у вакцинированного пациента антительный иммунный ответ? Насколько много антител образуется? Правильного ли они типа, чтобы нейтрализовать вирус? Как долго продолжается этот иммунный ответ? В идеале, хотелось бы изучить вопросы эффективности в исследованиях второй фазы у разных групп (возраст, пол, сопутствующее состояние здоровья и набор принимаемых лекарств) с различными графиками дозирования, и тщательно подобрать эти параметры для запуска третьей фазы испытаний. Запустив множество одновременных испытаний вместо последовательных, мы сможем охватить какую-то часть этих проблем, но отнюдь не все. Сейчас разрабатывают, по меньшей мере, 78 таких препаратов; с каждым шагом их будет все меньше (до поздних стадий доберутся единицы), но организовать подобные исследования будет все еще очень непросто. Некоторые же вещи не могут быть ускорены никакими способами, известными человечеству. Вопрос о длительности иммунитета является очень важным. К сожалению, нет другого способа ответить на этот вопрос, кроме времени, которого в эти дни так не хватает. Существует множество примеров вакцин, защита после которых не держалась так долго, как ожидалось. Помимо эффективности важно проверить безопасность вакцины. Слишком сильная иммунная реакция может стоить пациенту жизни. Так, описан синдром Гийена—Барре: организм реагирует на антиген, появляющийся при вирусной инфекции или вакцинации, принимая миелиновые (электроизолирующие) оболочки вокруг нервов также за враждебные белки и начиная их разрушать. При этом большинство людей выздоравливают, однако некоторые умирают. По приблизительным оценкам, даже вакцина против сезонного гриппа может убить примерно 1 на 10 миллионов человек, хотя понятно, что в случае отсутствия вакцинации умрет гораздо больше людей. Еще одна большая проблема – производство и распространение вакцины. Кроме того, многие вакцины нуждаются в перевозке и хранении в холодных условиях, что также бывает трудно обеспечить. Российская двухвекторная вакцина от коронавируса, созданная учеными из НИЦЭМ им. Н.Ф. Гамалеи   |
