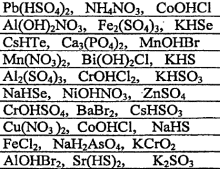
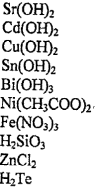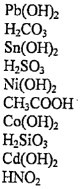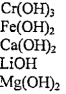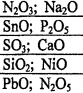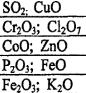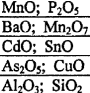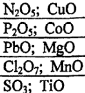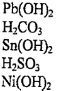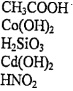электролиты. 4.Д. з. Электролитическая диссоциация. Сильные и слабые электрол. Домашнее задание 4 Электролитическая диссоциация. Сильные и слабые электролиты Цель Закрепить знания по теме Электролитическая диссоциация. Электролиты
 Скачать 261.63 Kb. Скачать 261.63 Kb.
|
|
Домашнее задание № 4 Электролитическая диссоциация. Сильные и слабые электролиты Цель: Закрепить знания по теме «Электролитическая диссоциация. Электролиты». Изучив тему, следует уметь: писать уравнения диссоциации кислот, оснований и солей, определять реакции ионного обмена, идущие до конца, составлять уравнения реакций в молекулярном и ионном виде. Теоретическая часть Электролитическая диссоциация - это процесс распада электролита на ионы в растворе или расплаве. Электролиты – вещества водные растворы или расплавы которых проводят электрический ток, примеры: соли, кислоты, основания. Электролитами могут быть только вещества с ионной или ковалентной полярной связью. Сильные электролиты (α → 1 или 100%) соли, сильные кислоты (H2SO4, HCl, HNO3, HClO4, HClO3, HBr, HI и др.), щелочи (NaOH, KOH, LiOH, Ba(OH)2, Ca(OH)2 и др.) Слабые электролиты (α → 0): вода, cлабые кислоты (H2S, H2CO3, H2SiO3, HNO2, H3PO4, H2SO3, HCN, HF, и др.), нерастворимые в воде основания (Cu(OH)2, Fe(OH)3 и др.), гидроксид аммония NH4OH. Кислоты – электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода Н+ Уравнение электролитической диссоциации сильных кислот: HCl ↔ H+ + Cl- H2SO4 ↔ 2H+ + SO42- Слабые многоосновные кислоты диссоциируют ступенчато. H2CO3 ↔ H+ + HCO3- К1 > K2 HCO3- ↔ H+ + CO32- Основания - электролиты, которые при диссоциации образуют только один вид анионов - гидроксид-ионы ОН- Уравнение диссоциации сильных оснований (щелочей) NaOH ↔ Na+ + OH- Ba(OH)2 ↔ Ba2+ + 2OH- Слабые многокислотные основания диссоциируют ступенчато. Fe(OH)2 ↔ FeOH+ + OH- К1 > K2 FeOH+ ↔ Fe2+ + OH- Амфотерные гидроксиды – это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н+ и гидроксид-анионы ОН- , т.е. диссоциируют по типу кислоты и по типу основания Уравнение электролитической диссоциации Zn(OH)2 (без учета ступенчатого характера) 2H+ + ZnO22- ↔ H2ZnO2 = Zn(OH)2 ↔ Zn2+ + 2OH- по типу кислоты по типу основания Средние (нормальные) соли – сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка. K2CO3 ↔ 2K+ + CO32- Al2(SO4)3 ↔ 2Al3+ + 3SO42- Кислые соли – сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток. NaHCO3 ↔ Na+ + HCO3- НСО3- ↔ Н+ + СО32- Основные соли – электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы, состоящие из атомов металла и гидроксогрупп ОН-. Fe(OH)Cl ↔ Fe(OH)+ + Cl- Fe(OH)+ ↔ Fe2+ + OH- Задания по вариантам Чтобы выполнить домашнее задание, нужно знать ваш номер в журнале вашей группы. Номер варианта вашего домашнего задания соответствует номеру в журнале. Домашнее задание оформляется на листочке бумаги, в котором указывается ФИО, № группы студента. Задание 1 Напишите уравнения диссоциации данных веществ
Задание 2 Напишите в молекулярной и ионной формах возможных реакций взаимодействия оксидов с H2O, K2O, NaOH, HCl
Задание 3 Напишите в молекулярной и ионной формах возможных реакций взаимодействия соединений с NaOH, HNO3
Задание 4 Напишите уравнения диссоциации солей и назовите их
|