Краткий экскурс по теме Механизмы реакций. Электрофильное присоединение ae
 Скачать 108 Kb. Скачать 108 Kb.
|
|
Электрофильное присоединение (AE) – механизм реакции присоединения к алкенам галагеноводородов и родственных соединений. 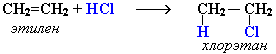 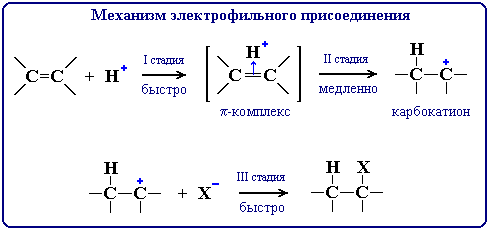 Электрофильное замещение (SE) – механизм реакции взаимодействия ароматических углеводородов с молекулами, содержащими электрофильные частицы. Примеры электрофильных частиц: Cl+, NO2+, CH3+. I стадия: образование -комплекса, в котором электрофильная частица Х+ притягивается к -электронному облаку бензольного кольца. II стадия (лимитирующая): образование -комплекса. Два электрона из -системы идут на образование -связи С–Х. При этом ароматичность кольца нарушается. Атом углерода, соединившись с электрофилом Х, переходит из sp2- в sp3-гибридизованное состояние и выходит из системы сопряжения. В системе сопряжения остаются 4 -электрона, которые делокализованы на 5-ти углеродных атомах кольца (заряд +1). III стадия: отщепления протона Н+, и восстановление ароматичности кольца, поскольку два электрона связи С–Н переходят в -систему кольца. 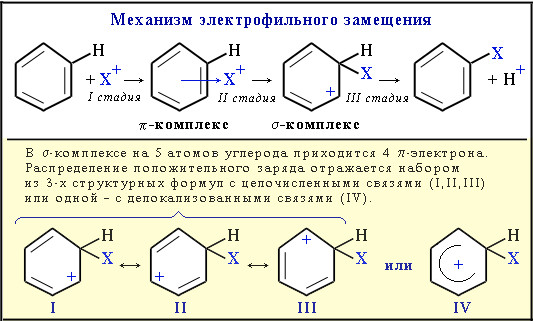 Электрофильное присоединение (AN) – механизм реакции взаимодействия альдегидов и кетонов. Присоединение большинства реагентов по двойной связи С=О происходит как ионная реакция по механизму нуклеофильного присоединения AN (от англ. nucleophile addition).
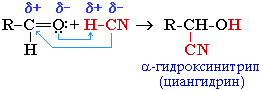 Эта реакция используется для удлинения углеродной цепи, а также для получения -гидроксикислот R-CH(COOH)OH по реакции: R-CH(CN)OH + H2O R-CH(COOH)OH + NH3
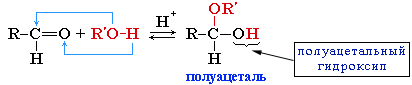 Полуацетали - соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR' и образованию ацеталя: 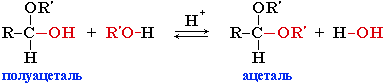 Ацетали - соединения, в которых атом углерода связан с двумя алкоксильными (-OR) группами. Образование ацеталей из полуацеталей подобно реакции получения простых эфиров при межмолекулярной дегидратации спиртов Нуклеофильное замещение (SN1) - механизм реакции в третичный алкилгалогенидах и спиртах. I стадия. Катион алкилгидроксония, отщепляя воду, превращается в карбокатион: 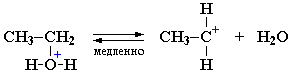 Роль кислоты, таким образом, заключается в превращении ОН-группы в Н2О, которая отщепляется легче, чем анион НО–. II стадия. Карбокатион вызывает гетеролитический разрыв связи в галогеноводороде и присоединяет галогенид-анион с образованием конечного продукта: или Освободившийся H+ идет на протонирование новых молекул спирта. Нуклеофильное замещение (SN2) - механизм реакции образования спирта при обработке первичного алкилгалогенида водным раствором гидроксида натрия (алкилирование). Другой возможный механизм нуклеофильного замещения заключается в практически одновременном отщеплении воды и присоединении галогена (без образования карбокатиона) и идет в одну стадию. 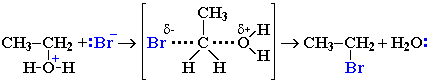 Элиминирование (Е1 и Е2) 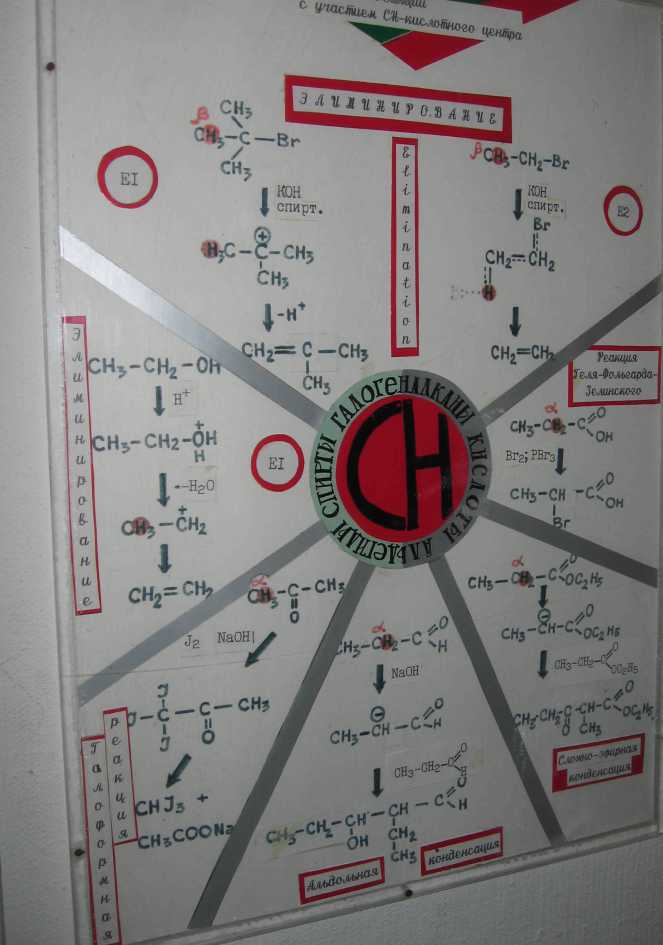 |
