Ароматические углеводороды в нефтехимическом синтезе. Содержание Введение 4 1 Теоретическая часть 4 1 Химические свойства ароматических углеводородов 5 2 Использование ароматических углеводородов в нефтехимических
 Скачать 1.05 Mb. Скачать 1.05 Mb.
|
|
Содержание Введение 4 1 Теоретическая часть 4 1.1 Химические свойства ароматических углеводородов 5 1.2 Использование ароматических углеводородов в нефтехимических синтезах 17 2 Методическая часть 2.1 Метод анализа ароматических углеводородов в бензине 30 Заключение 38 Литература 39 Введение На направления переработки, качество и количество получаемых углеводородных систем оказывает влияние природа нефтяного сырья. Нефти различных месторождений заметно отличаются по фракционному составу - содержанию легких, средних и тяжелых дистиллятов. Большинство нефтей содержит 15-25% бензиновых фракций, выкипающих до 180°С; 35-45% - керосиновых и дизельных фракций, перегоняющихся до 300-350°С. Существуют легкие нефти, в которых больше низкокипящих фракций - так, в леляковской (Украина) и новодмитриевской (Северный Кавказ) нефтях свыше 63% фракций, выкипающих до 350°С, а в некоторых нефтях месторождений Индонезии их содержание достигает 77%. Добываются также очень тяжелые нефти, в основном состоящие из фракций, выкипающих выше 200°С. Например, в нефти Ярегского месторождения (Коми), добываемой шахтным способом, отсутствуют фракции, выкипающие до 180°С, а выход фракции 180-350°С составляет всего 18,8%. Принято также характеризовать нефти по содержанию в них светлых нефтепродуктов. Нефти являются природными углеводородными системами, обычно на 80-90% состоящими из различных углеводородов. В товарных и пластовых нефтях преобладают парафиновые углеводороды (обычно 30-35, иногда до 40-50% по объему) и нафтеновые (25-75%), ароматические (10-20, иногда до 35%), остальные углеводороды смешанного, или гибридного, строения. Таким образом, основным компонентом нефти являются углеводородные смеси - алканов (парафинов), циклоалканов, аренов. Имеются сведения о наличии непредельных углеводородов в незначительном количестве. Соотношение между группами углеводородов придает нефтям различные свойства и оказывает большое влияние на выбор метода переработки нефти и свойств получаемых продуктов. Арены (ароматические углеводороды) содержатся в нефтях, как правило, в меньшем количестве, чем алканы и циклоалканы. Суммарное содержание аренов в нефтях равно 5-25%, в ряде ароматизированных нефтей это количество может составлять 25-35%. В бензиновой фракции арены представлены гомологическим рядом бензола; керосиновые фракции содержат, наряду с гомологами бензола, производные нафталина. В тяжелых фракциях арены находятся в виде гомологов нафталина и антрацена [1]. 1. Теоретическая часть 1.1. Химические свойства ароматических углеводородов Арены, или ароматические углеводороды, - соединения, содержащие в молекуле особую циклическую группировку из шести атомов углерода, которая называется бензольной группировкой (бензольное ядро): 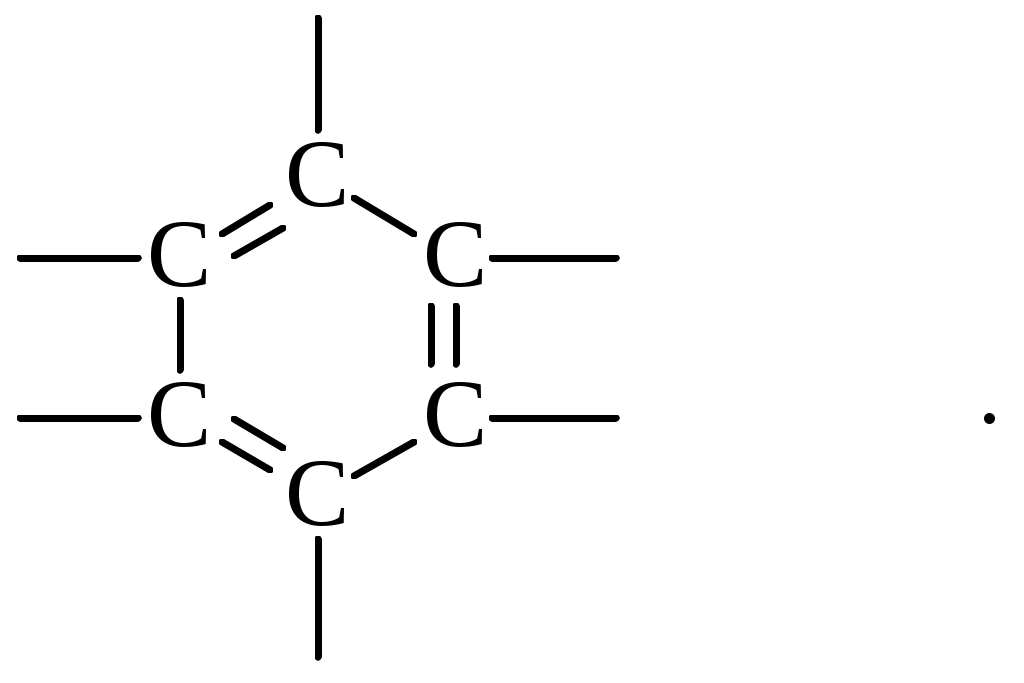 бензольное ядро Название углеводородов этой группы «ароматические соединения» - случайное и сегодня потеряло свой первоначальный смысл. Действительно, первые открытые соединения или обладали специфическим, иногда приятным запахом, или были выделены из природных сильно пахнущих продуктов. Но количество «ароматных» веществ среди многочисленных известных соединений этой группы невелико. В то же время наблюдается ряд особенностей в строении, физических свойствах и химическом поведении этих веществ, связанных с наличием в молекуле бензольных группировок. Различают одноядерные (одна бензольная группировка в молекуле) и многоядерные ароматические углеводороды, содержащие две или более бензольные группировки. В молекулах аренов в качестве боковых цепей могут находиться углеводородные радикалы с неразветвлённой или разветвлённой углеродной цепочкой, а также содержащие двойные или тройные связи и циклические группировки: 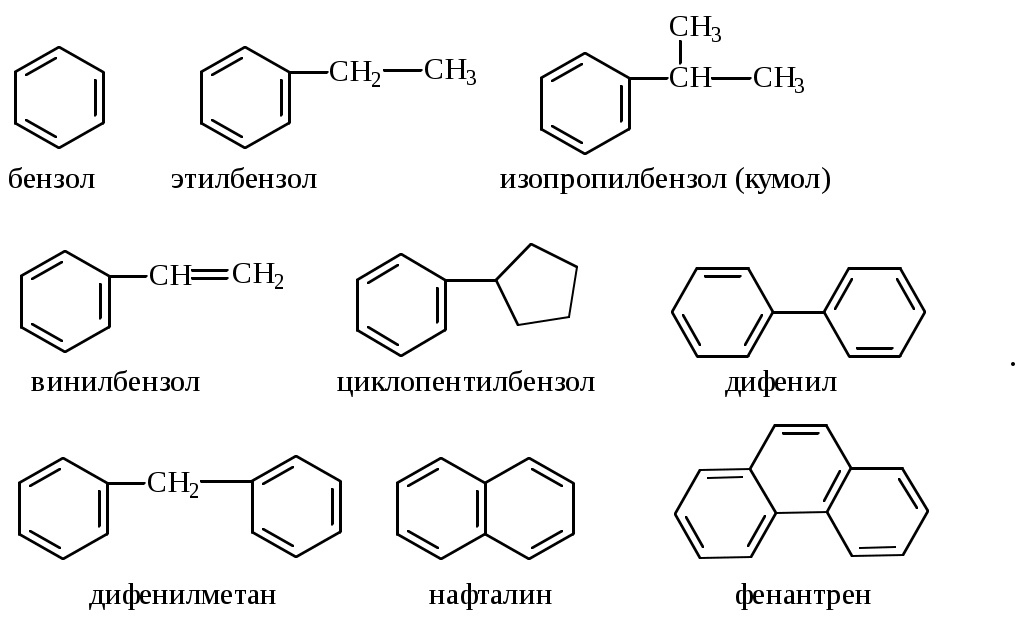 Следовательно, арены могут содержать в молекуле наряду с ароматическими ядрами разнообразные по строению алифатические цепи, а также включать в состав молекулы другие (не содержащие ядер бензола) циклические группировки. Первый и один из наиболее важных представителей гомологического ряда одноядерных ароматических углеводородов – бензол С6Н6. Отсюда и общее название гомологического ряда – ряд бензола [1]. Общая формула моноциклических аренов CnH2n-6 показывает, что они являются ненасыщенными соединениями. В 1865 г. немецкий химик А.Ф. Кекуле предложил циклическую формулу бензола с сопряжёнными связями (чередуются простые и двойные связи) – циклогексатриен-1,3,5: 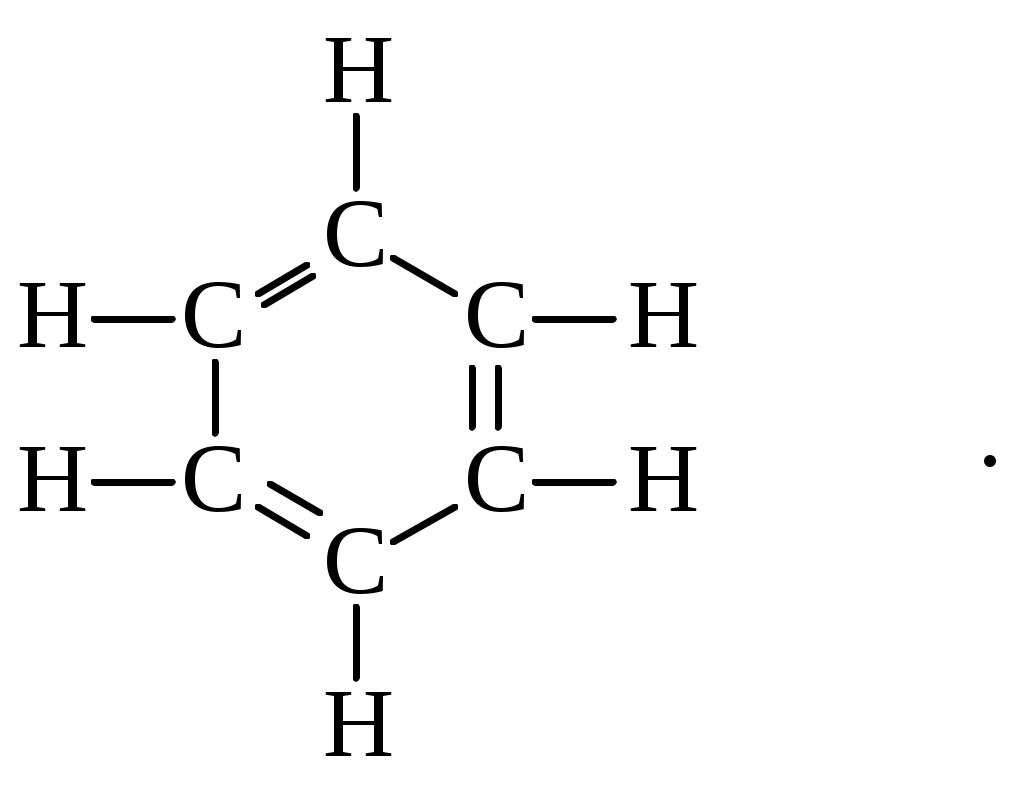 Такая структура молекулы бензола не объясняла многие свойства бензола: Для бензола характерны реакции замещения, а не присоединения, свойственные ненасыщенным соединениям. Реакции присоединения возможны, но протекают труднее, чем для алкенов. Бензол не вступает в реакции, являющиеся качественными реакциями на непредельные УВ (с бромной водой и раствором KMnO4). Чтобы выйти из этого затруднения, Кекуле был вынужден допустить возможность постоянного изменения положения двойных связей в молекуле бензола, т.е. выдвинул теорию "осцилляции«, согласно которой двойные связи не фиксированы на одном месте: 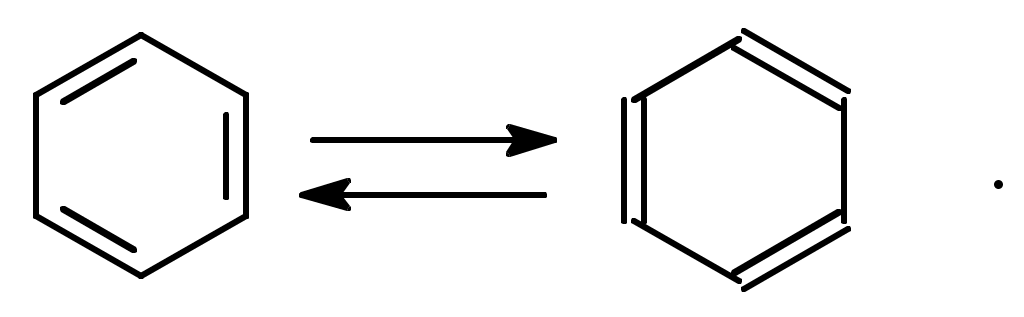 Проведённые позже электронографические исследования показали, что все связи между атомами углерода в молекуле бензола имеют одинаковую длину 0,140 нм (среднее значение между длиной простой связи С-С 0,154 нм и двойной связи С=С 0,134 нм). Угол между связями у каждого атома углерода равен 1200. Молекула представляет собой правильный плоский шестиугольник. Современная теория для объяснения строения молекулы С6Н6 использует представление о гибридизации орбиталей атома углерода. Атомы углерода в бензоле находятся в состоянии sp2-гибридизации. Каждый атом «С» образует три σ-связи (две с атомами углерода и одну с атомом водорода). Все σ-связи находятся в одной плоскости: 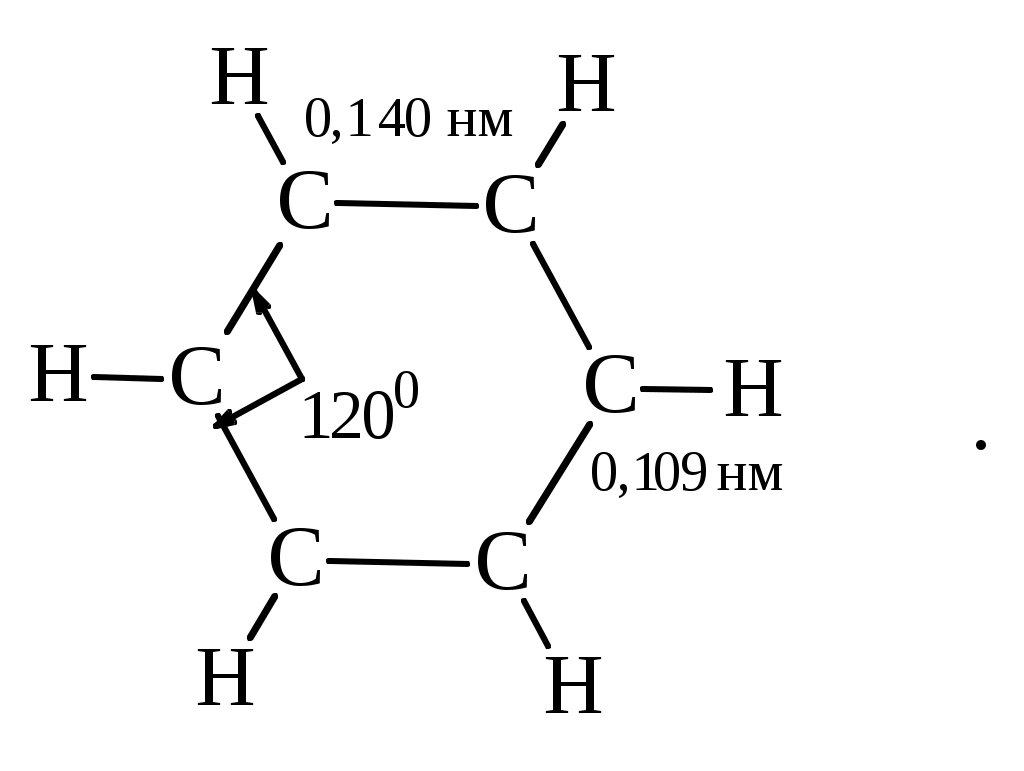 Каждый атом углерода имеет один р-электрон, который не участвует в гибридизации. Негибридизированные р-орбитали атомов углерода находятся в плоскости, перпендикулярной плоскости σ-связей. Каждое р-облако перекрывается с двумя соседними р-облаками, и в результате образуется единая сопряжённая π-система (рис. 2). 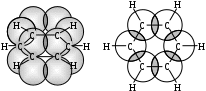 а) б) Рис.2. Взаимное перекрывание 2р-орбиталей в молекуле бензола: а – вид сбоку; б – вид сверху В результате такого равномерного перекрывания 2р-орбиталей всех шести углеродных атомов происходит «выравнивание» простых и двойных связей, т.е. в молекуле бензола отсутствуют классические двойные и одинарные связи. Равномерное распределение π-электронной плотности между всеми углеродными атомами, обусловленное π-электронным сопряжением, и является причиной высокой устойчивости молекулы бензола. В настоящее время нет единого способа графического изображения молекулы бензола с учётом его реальных свойств. Практически это и невозможно сделать. Но чтобы подчеркнуть выравненность π-электронной плотности в молекуле бензола, прибегают к помощи следующих формул:  Таким образом, по современным данным все связи между атомами углерода в кольце бензола одинаковы и по длине занимают промежуточное положение между одинарными и двойными. Однако в конденсированных аренах не все межатомные связи в кольце сохраняют равнозначность, вследствие чего для них применяется более общее изображение с тремя двойными связями [2]. 1.1.1 Монозамещённые бензолы Простые производные бензола называют замещёнными бензола. В этом случае заместитель обозначается приставкой перед словом “бензол”. Так, бензол, в котором один из атомов водорода заменен на этильную группу, называется этилбензолом. Многие бензолы имеют тривиальные названия, которые широко распространены: 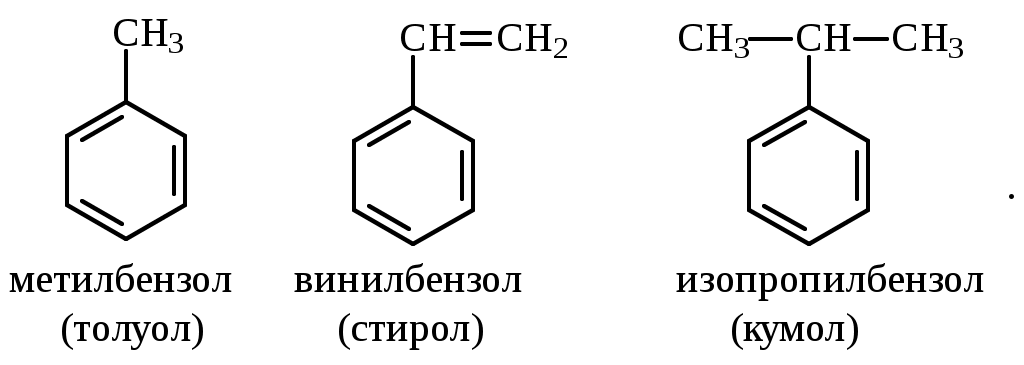 1.1.2 Дизамещённые бензолы Три возможных изомера дизамещённых бензолов обозначаются приставками “орто-, мета-, пара-”: 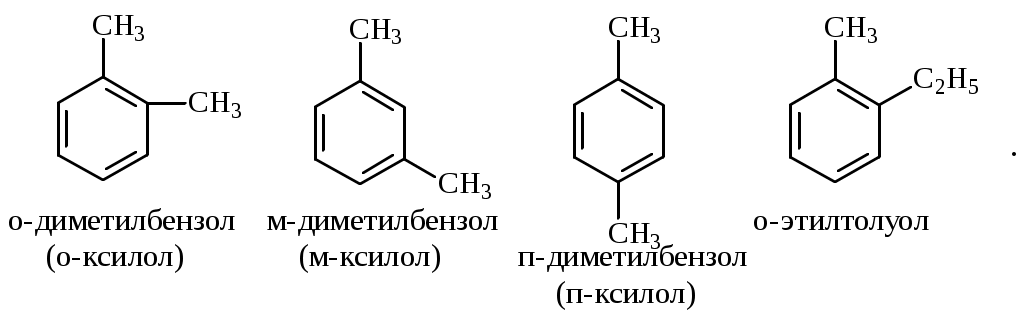 Если заместители неодинаковы, то их перечисляют перед словом бензол в алфавитном порядке, например, о-пропилэтилбензол. Если один из заместителей отвечает монозамещенному бензолу с тривиальным названием (например, толуол), то дизамещенный бензол в этом случае называют как производное этого соединения. В отличие от диметилциклоалканов диметилбензолы являются плоскими и не имеют “цис-, транс-изомеров”. Если в одном кольце присутствуют два или более заместителей, их положение можно указать цифрами, учитывая, что номера атомов углерода, у которых расположены заместители, должны быть наименьшими: 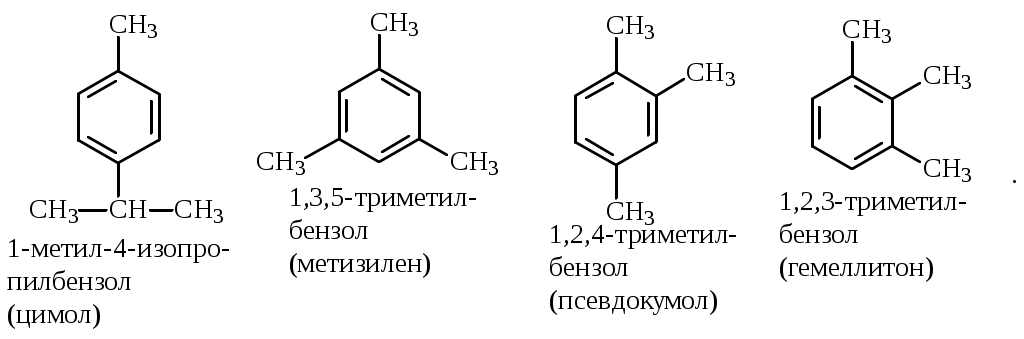 При удаление атома водорода от одного из углеродных атомов бензола образуется фенильная группа С6H5–, а при удалении одного метильного водорода из молекулы толуола – бензильная группа C6H5–CH2–. Общие названия групп, производных от ароматических соединений, - арилы [2]. 1.1.3 Полициклические арены Углеводороды, в которых два или более бензольных кольца связаны простой связью, в соответствии с числом колец называют би-, тер - и т.д. фенилами, например: 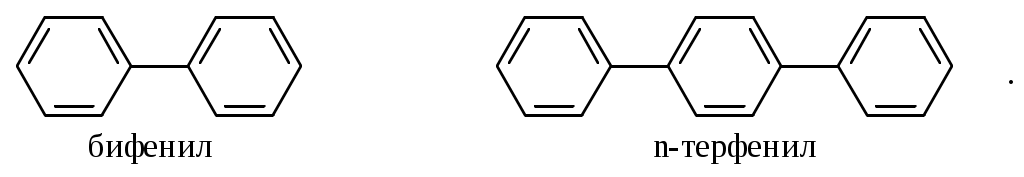 Ди- и полиарилалканы называются как арилзамещенные алканы: 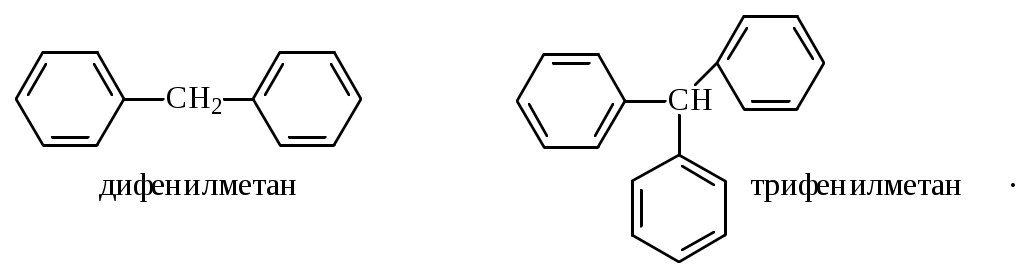 Для многих конденсированных аренов употребляются тривиальные названия: 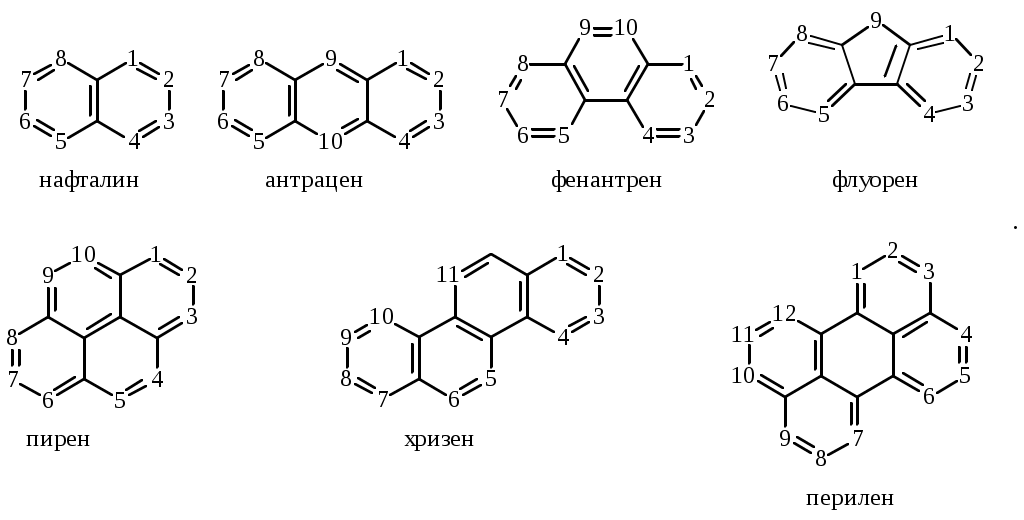 Номера, которыми обозначены атомы, используют при необходимости для указания положения заместителей. 1.1.4 Физические свойства аренов Основные физические свойства аренов, присутствующих в нефтях, показаны в табл. 1. Физические свойства аренов связаны с числом атомов углерода, наличием заместителей и расположением их в молекуле. Арены имеют более высокие температуры кипения, чем соответствующие циклоалканы. Это объясняется плотной упаковкой их молекул, (плоское кольцо), а также более сильным физико- химическим взаимодействием между молекулами вследствие наличия π-электронов. Гомологи с рядом расположенными алкильными заместителями кипят при более высоких температурах, чем n-изомеры. Температуры плавления аренов тем выше, чем симметричнее расположены алкильные заместители. Это объясняется тем, что асимметрия затрудняет упорядочение вещества в твёрдом состоянии. Увеличение числа циклов сопровождается повышением температуры плавления. Появление боковых цепей снижает температуру плавления, а удлинение цепи приводит к её повышению. Все гомологи, более богатые водородом, обладают меньшей плотностью. Наименьшей плотностью обладают арены с симметричным расположением заместителей, вследствие их менее плотной упаковки в веществе. Для аренов характерны максимальные среди других углеводородов плотность и показатель преломления, что используется в аналитических целях. Отличительным свойством аренов от других классов углеводородов, встречающихся в нефти, является их способность поглощать лучистую энергию в ультрафиолетовой области спектра. На этом основан аналитический метод их определения. Таблица 1 Физические свойства аренов
Кроме того, арены отличаются от других углеводородов ярко выраженной способностью избирательно растворяться в некоторых растворителях. К таким избирательным (селективным) растворителям относятся полярные жидкости: сернистый ангидрид, диметилсульфат, сульфолан, ацетон, фенол, фурфурол, диэтиленгликоль, анилин, нитробензол и др. Селективные растворители используют в промышленности для выделения аренов из нефтяных фракций и нефтепродуктов, а также для их разделения на индивидуальные соединения. Кроме того, арены способны целиком, количественно адсорбироваться на силикагеле, алюмогеле и некоторых других адсорбентах. Для высших аренов десорбция растворителями идёт с различной скоростью, что позволяет хроматографически разделять и выделять отдельные представители или узкие фракции ароматических углеводородов из нефтяных фракций. |
