Ароматические углеводороды в нефтехимическом синтезе. Содержание Введение 4 1 Теоретическая часть 4 1 Химические свойства ароматических углеводородов 5 2 Использование ароматических углеводородов в нефтехимических
 Скачать 1.05 Mb. Скачать 1.05 Mb.
|
1.1.5 Химические свойства ареновРеакции присоединения. Арены вступают в реакции присоединения с большим трудом. Для этого требуются высокие температуры, ультрафиолетовое облучение и катализаторы. К ним относятся: Галогенирование: 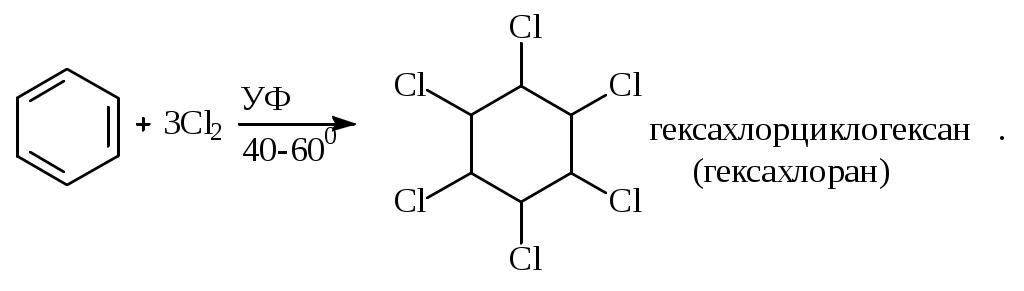 Гексахлоран используется в качестве инсектицида. Гидрирование:  Реакции замещения наиболее характерны для аренов. Они протекают в сравнительно мягких условиях. Особенно легко вступают в реакции замещения гомологи бензола. Галоидирование. В зависимости от условий галоидирования можно получить продукты различной степени замещения: 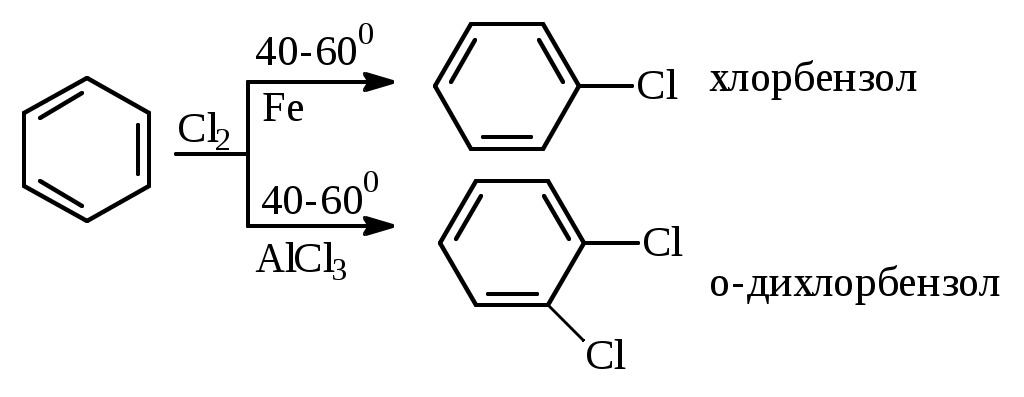 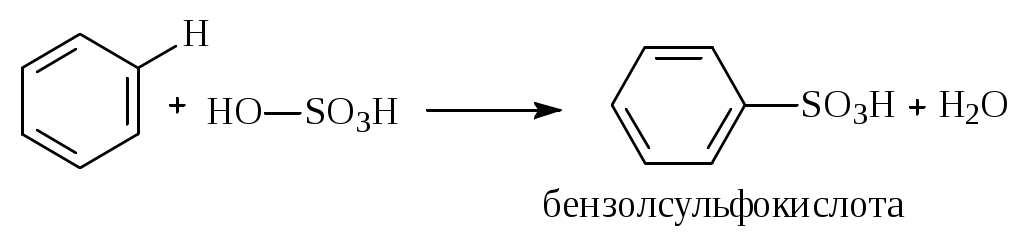 Сульфирование. Концентрированная серная кислота легко замещает водород на остаток серной кислоты с образованием сульфокислоты. Эта реакция протекает количественно и может служить одним из способов определения содержания аренов в нефтяных фракциях. 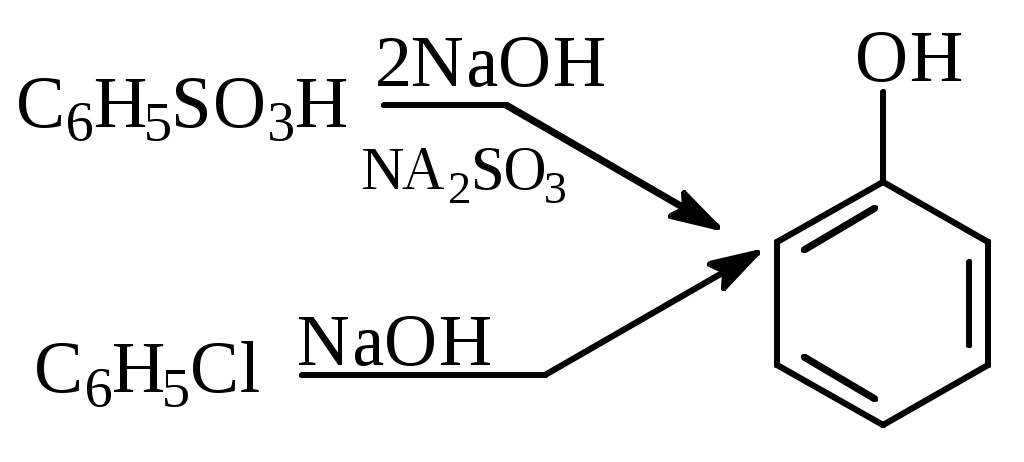 Из бензолсульфокислоты и хлорбензола сплавлением их со щёлочью получают фенол. Основная область применения фенола - производство фенолформальдегидных смол. Нитрование. При действии на бензол смесью концентрированных азотной и серной кислот получается нитробензол: 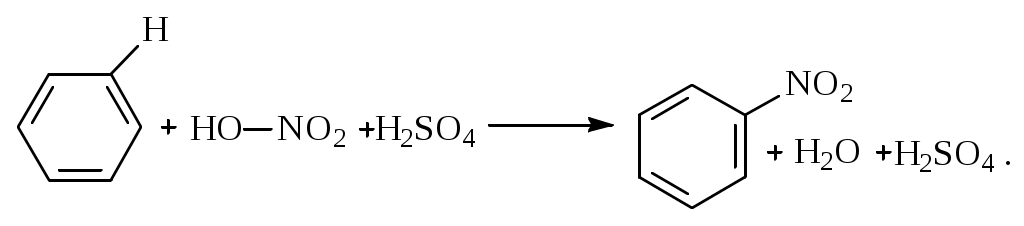 Восстановлением нитробензола получают анилин: 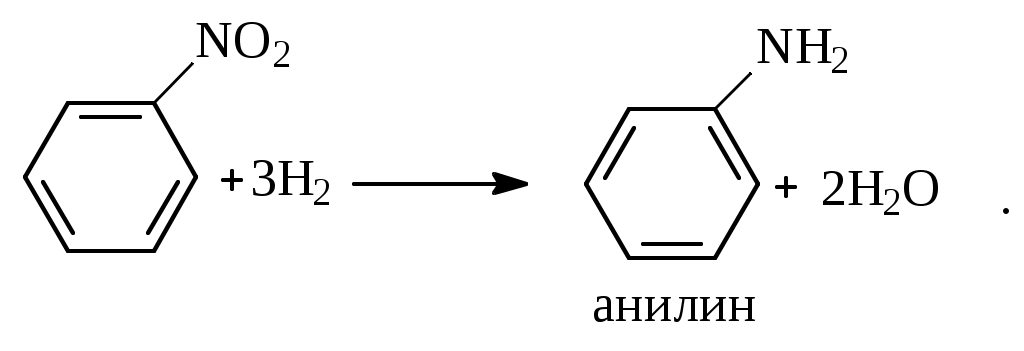 Большая часть анилина используется для производства полиуретановых пенопластов. При полном нитровании толуола получают взрывчатое вещество тротил (2,4,6-тринитротолуол):  Алкилирование. В присутствии таких катализаторов как АlCl3, HF, H2SO4, HCl, BF3 арены вступают в реакцию алкилирования с алкенами, спиртами, галоидзамещёнными алканами. Таким способом в промышленности получают этилбензол и изопропилбензол: 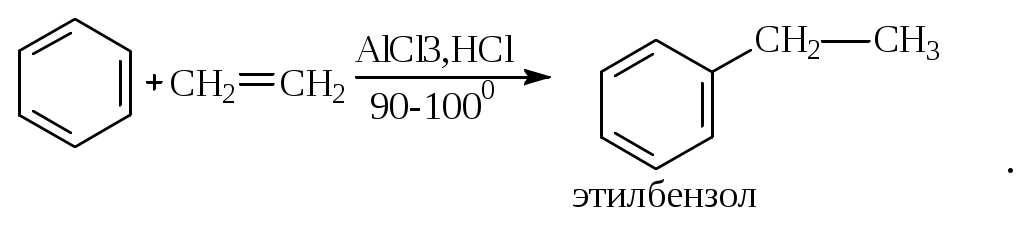 Каталитическим дегидрированием из этилбензола получают стирол, а из изопропилбензола - -метилстирол - ценные мономеры, используемые в производстве каучуков и пластмасс: 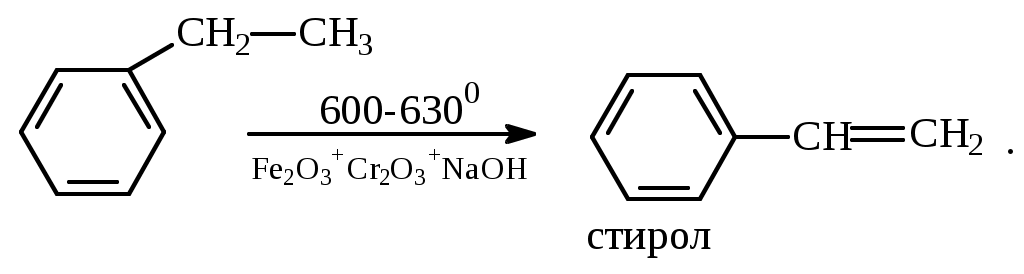 Алкилированием бензола хлоралканами и дальнейшим сульфированием и нейтрализацией образующихся продуктов получают алкиларилсульфонаты - синтетические поверхностно-активные вещества. Эти вещества с некоторыми добавками называют сульфонолами: 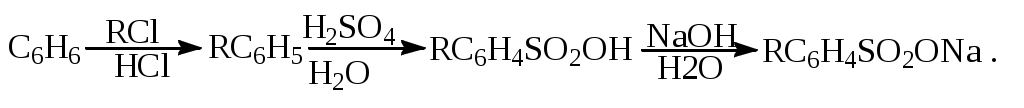 Деалкилирование и гидродеалкилирование. В связи с тем, что наибольшее значение имеет бензол, его в настоящее время получают деалкилированием или гидродеалкилированием толуола: 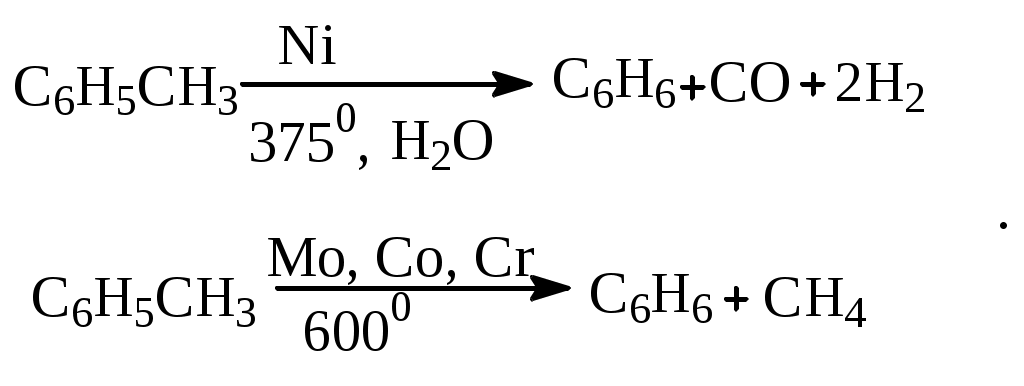 Конденсация с формальдегидом. В присутствии концентрированной серной кислоты арены конденсируются с формальдегидом с образованием нерастворимого осадка бурого цвета: 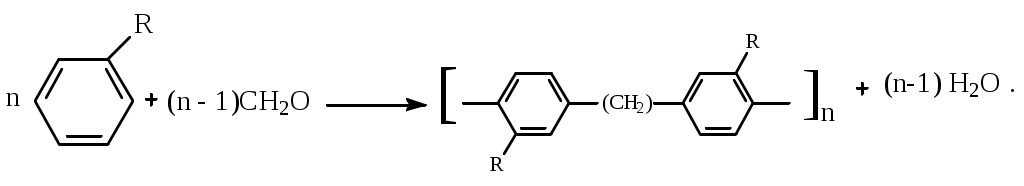 Эту реакцию применяют для аналитического определения аренов в нефтяных фракциях. Окисление. Арены (кроме бензола, нафталина и других голоядерных гомологов) легко вступают в реакции окисления. В ряду алкилпроизводных аренов устойчивость к окислению падает с увеличением длины и степени разветвления боковой цепи. При этом образуются кислые соединения. Эти свойства аренов широко используются в промышленности для получения кислородсодержащих производных: 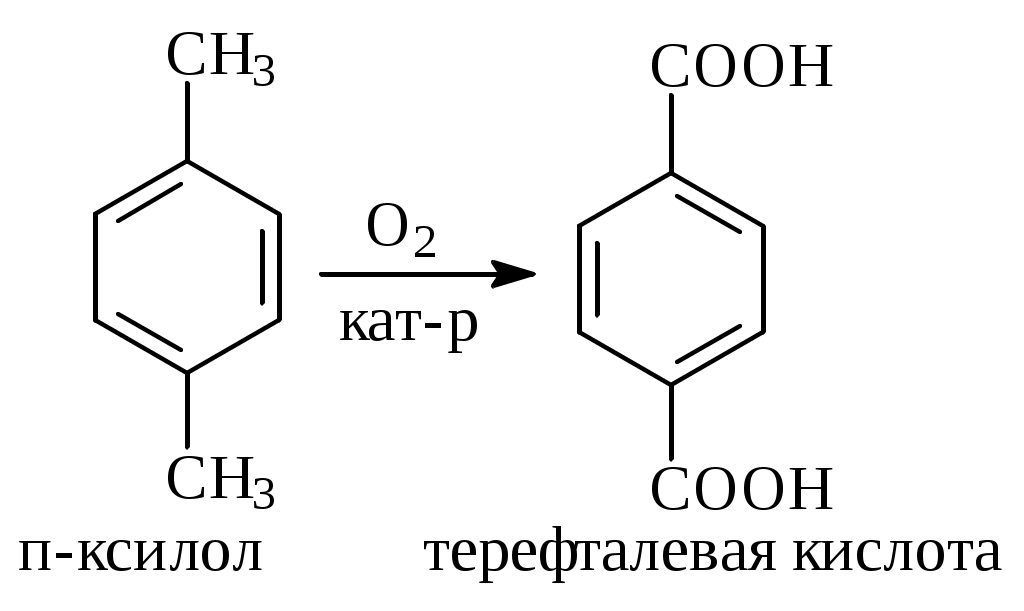 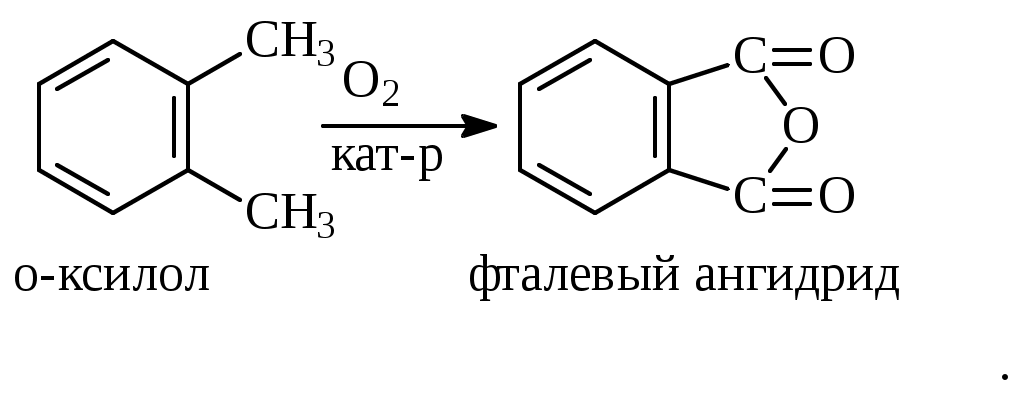 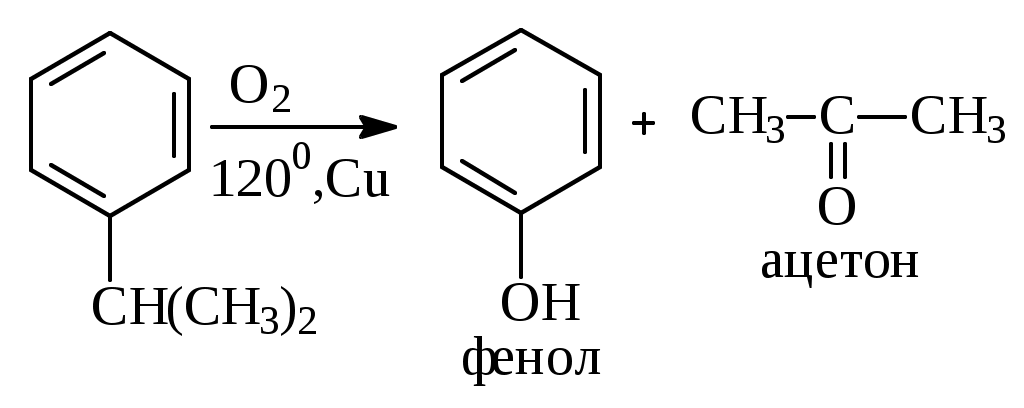 С целью получения терефталевой кислоты разработаны также различные процессы окисления толуола. Наиболее устойчивыми к окислению кислородом воздуха являются бензол и нафталин. Однако и они в очень жёстких условиях (высокая температура, катализатор) окисляются с разрывом бензольного кольца: 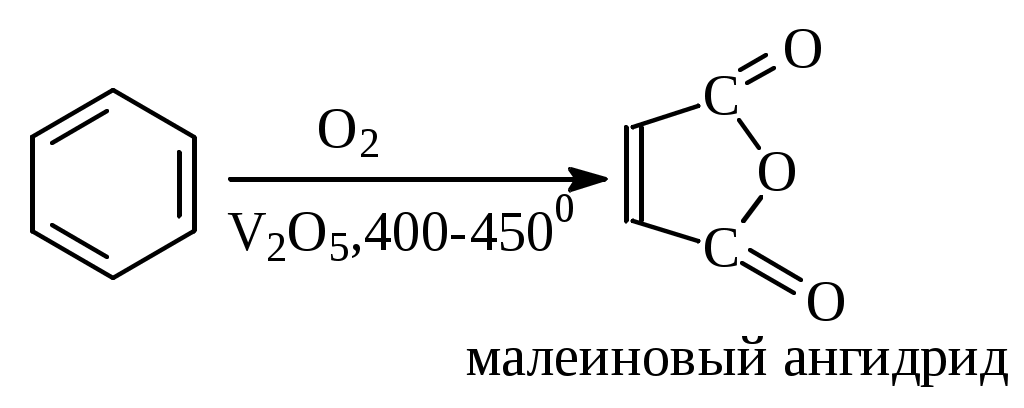 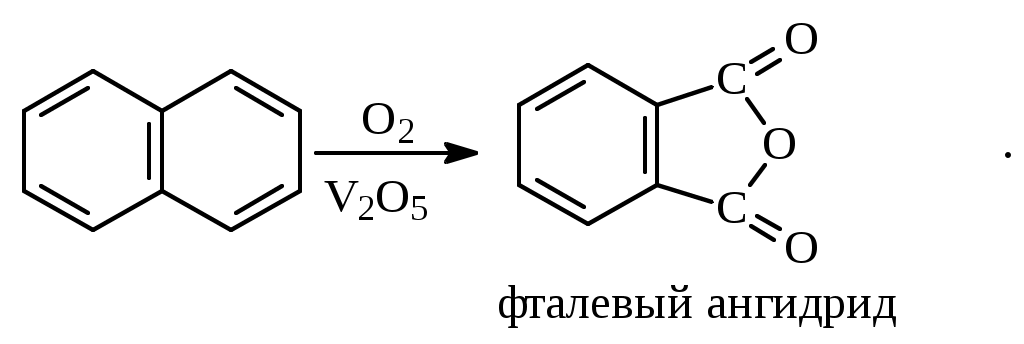 Терефталевая кислота - полупродукт для производства синтетического полиэфирного волокна - лавсана (терилена). Фталевый ангидрид применяется для производства алкидных и полиэфирных смол, пластификаторов, репеллентов. Малеиновый ангидрид используется в производстве полиэфирных смол и присадок к смазочным маслам. Образование комплексов с пикриновой кислотой. Полициклические арены (нафталин, антрацен и их гомологи) легко образуют комплексные соединения с пикриновой кислотой (2,4,6 - тринитрофенол) – пикраты. Бензол и его гомологи не образуют стабильных комплексов и могут служить растворителями при комплексообразовании. Пикраты ароматических углеводородов представляют собой твёрдые кристаллические вещества жёлтого цвета, имеющие чёткие температуры плавления. Каждому полициклическому углеводороду соответствует пикрат с определённой температурой плавления. По температуре плавления пикрата модно идентифицировать полициклический ароматический углеводород. Комплексообразование с пикриновой кислотой используется как метод выделения полициклических ароматических углеводородов. Пикраты легко разлагаются горячей водой. Пикриновая кислота растворяется в воде, а полициклические ароматические углеводороды выделяются в свободном виде. 1.2. Использование ароматических углеводородов в нефтехимических синтезах Нефтеперерабатывающая и нефтехимическая промышленность является основным поставщиком аренов. Большая часть бензола, толуола и ксилолов в мире производится в процессе каталитического риформинга бензиновых фракций нефти с последующим их выделением экстракцией селективными растворителями. С целью увеличения ресурсов бензола и ксилолов разработаны процессы переработки толуола и аренов С9—С10, также образующихся при риформинге, основанные на реакциях деалкилирования, диспропорционироваиия и трансалкилирования. Комбинированием каталитического риформинга и деалформинга при переработке 1 млн. т фракции 70—180 °C можно получить около 150 тыс. т бензола и 300—350 тыс. т ксилолов. Получающиеся суммарные ксилолы характеризуются очень низким содержанием этилбензола (0,5—2 %), что должно облегчить процесс изомеризации и выделения п- и о-ксилола. В последние годы отмечается тенденция к увеличению доли аренов, получаемых при пиролизе, что связано с утяжелением сырья пиролиза. При пиролизе остаточных нефтяных фракций и сырой нефти получаются жидкие продукты с высоким содержанием аренов. Например, фракция C5 (200 °С), полученная пиролизом мазута, содержит 90,5 % аренов, в том числе 25,2 % бензола и 27,7 % толуола. Один из наиболее крупнотоннажных продуктов основного органического синтеза — бензол. Мощность всех действующих установок составляет около 23 млн. т/год, а проектируемых — около 5 млн. т/год. Основные направления использования бензола — производство этилбензола и далее стирола (45%), фенола (20%), циклогексана (15%), анилина (5%), алкилбензолов (5%). На долю прочих остается около 10 % от потребляемого бензола. Таким образом, главные области применения бензола — производство пластмасс и волокон — получение полистирола (25%), найлона (20%), других полимеров (10%), синтетических каучуков (5%). Большую часть этилбензола в промышленности получают алкилированием бензола этиленом, и лишь незначительное количество выделяют сверхчеткой ректификацией из смеси с ксилолами. Алкилирование осуществляется как гомогенное в присутствии хлорида алюминия, так и на твердых гетерогенных катализаторах, в частности на цеолитах, фториде бора.  Стирол получают в основном каталитическим дегидрированием этилбензола. По процессу Оксирейн этилбензол окисляют до гидропероксида 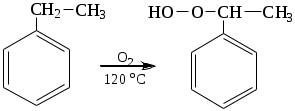 при взаимодействии которого с пропиленом в результате реакции эпоксидирования получается оксид пропилена и метилфенилкарбинол. 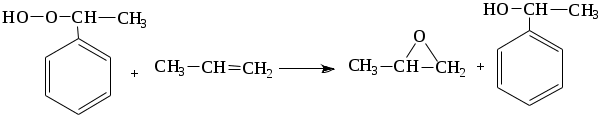 Последний дегидратацией переводят в стирол. 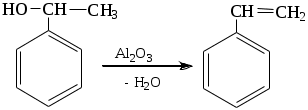 Несмотря на многостадийность, этот процесс оказался достаточно экономичным. Разработан ряд вариантов окислительного дегидрирования этилбензола в присутствии различных катализаторов. Более мягким окислителем по сравнению с кислородом воздуха является оксид серы (IV), при использовании которого селективность повышается с 86 до 98 % и выход стирола — с 53 до 86 % на этилбензол. Однако недостаток процесса с оксидом серы (IV) — более сильное зауглероживание катализатора и быстрая потеря его активности. Около 94% производимого в мире фенола получается из бензола, в том числе приблизительно 90 % промышленных мощностей приходится на кумольный метод и 4 % — на процессы щелочного плавления бензолсульфокислоты и окислительного хлорирования бензола. Остальное количество фенола получается из толуола через бензойную кислоту. Изопропилбензол (кумол) идет на производство фенола и ацетона: 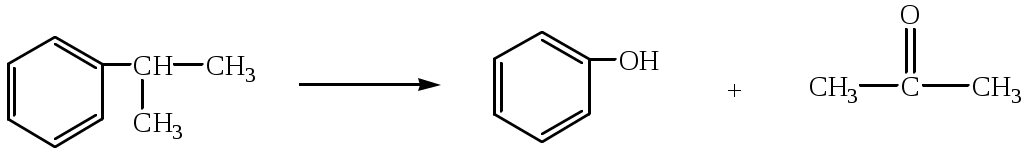 Также большое количество кумола перерабатывается в α-метилстирол, который также является мономером для получения синтетического каучука: 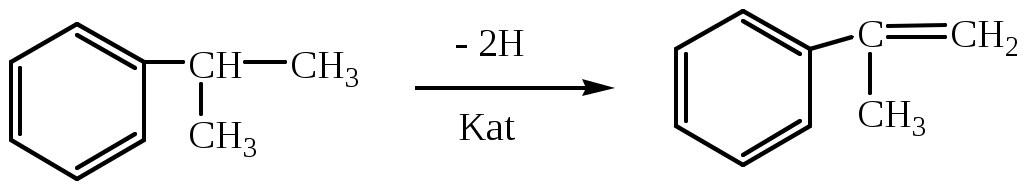 Направления использования фенола - получение фенолоформальдегидных смол, дифенилолпропана, о-крезола и 2,6-ксиленола, анилина и т. д.) рассмотрены в работах. Гидрированием бензола получают циклогексан, окислением последнего — циклогексанон и далее оксимированием и бекмановской перегруппировкой — капролактам. Гидрированием бензола получают циклогексан. 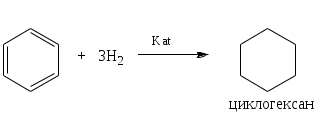 Катализаторами процесса могут служить платина или никель. В результате окисления циклогексана образуются циклогексанон, циклогексанол, гидропероксид циклогексила, адипиновая кислота и побочные вещества (вода, кислоты, эфиры): 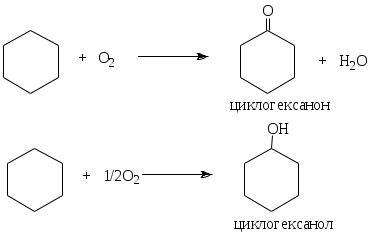 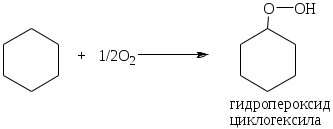  адипиновая кислота В газовой фазе некаталитическое окисление циклогексана кислородом воздуха происходит при нагревании смеси до 340 оС. Жидкофазное окисление происходит при 130 – 160 оС, давлении 1 – 10 МПа при взаимодействии с кислородсодержащими соединениями или молекулярным кислородом по схемам: 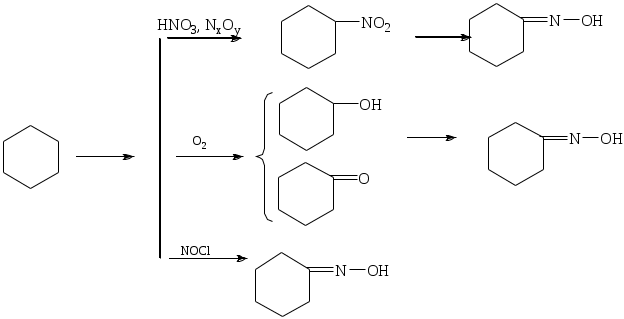 Циклогексан окисляют в циклогексаноксим и последний изомеризуют в капролактам – сырье для производства капрона: 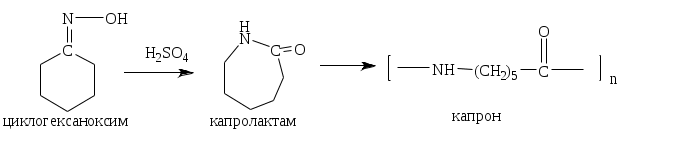 Анилин в промышленности получают восстановлением нитробензола чугунными стружками: Анилин в промышленности получают восстановлением нитробензола чугунными стружками: нитробензол аминобензол, анилин Железные стружки с перегретым паром выделяют активный водород. Однако более экологически чистым производством является каталитическое гидрирование нитросоединений водородом над никелевым катализатором. Процесс идет как в жидкой, так и в паровой фазе: 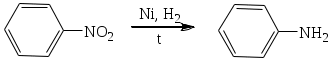 Расширение производства анилина обусловлено главным образом увеличением спроса на полиуретановые пенопласты, которые могут получаться из анилина через дифенил-метандиизоцианат. Свыше 55 % анилина потреблялось для производства изоцианатов, около 27 % — для получения химикатов, использующихся при переработке каучуков, всего 3,6 % — для производства красителей и небольшие количества анилина — для получения гидрохинона, лекарственных препаратов и гербицидов. Малеиновый ангидрид получают как из бензола, так и из бутана.  Производство из бензола продолжает конкурировать с бутановым вариантом, так как в последнем случае, несмотря на относительно низкую стоимость бутана, оказывается более сложной очистка продукта от примесей и требуются реакторы большей вместимости, что приводит к высоким капиталовложениям. В связи с этим основное количество малеинового ангидрида (82%) получают окислением бензола. Важнейшими направлениями неуглеродного синтеза на основе толуола являются производство 2, 4, 6 – тринитротолуола – взрывчатого вещества, производство бензойной кислоты и далее – через циклогексакарбоновую кислоту взаимодействием с нитрозилсерной кислотой – получение капролактама. Также из толуола получают п-толуиловый альдегид, терефталевую кислоту, бензилхлорид, бензонитрил, 2,4-динитротолуол, из которого получают толуилендиизоцианат – мономер для производства полиуретанов. Почти весь орто-ксилол потребляется производством фталевого ангидрида. Большая часть п-ксилола используется для получения из терефталевой кислоты и этиленгликоля полиэтилентерефталата, из которого вырабатывают лавсан. Из п-ксилола вырабатывают также п-ксилилен и поли-п-ксилилен – полимер, термостойкий до 2200С. Схема получения лавсана приведена ниже: 1. Окисление пара-ксилола в п-толуиловую кислоту: 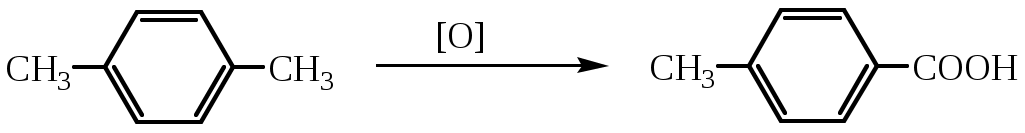 пара-ксилол пара-толуиловая кислота 1,4-диметилбензол 4-метилбензойная кислота Окисление проводят в присутствии азотной кислоты при температуре 130 оС и давлении 1,96 МПа. 2. Этерификация п-толуиловой кислоты метиловым спиртом с получением метилового эфира п-толуиловой кислоты: 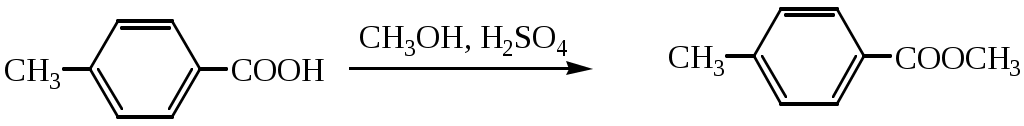 Процесс проводится в присутствии серной кислоты, при температуре 200 - 250 оС и давлении 2,46 МПа. 3. Окисление метилового эфира п-толуиловой кислоты:  Окисление в данном случае проводят в присутствии кобальтовых или марганцевых катализаторов, при температуре 160 - 180 оС и давлении 1,47 МПа. 4. Этерификация моноэфира терефталевой кислоты: 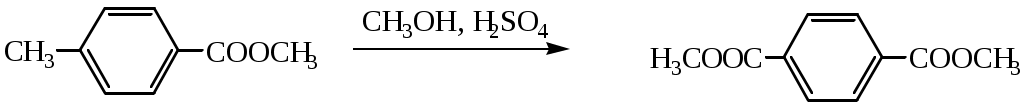 Процесс проводится в присутствии серной кислоты, при температуре 200 - 250 оС и давлении 2,46 МПа. Получение волокна лавсан проходит по схеме: 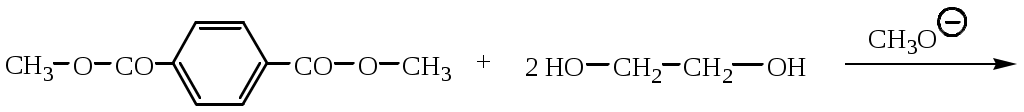 диметилтерефталат 1,2-этандиол  метанол 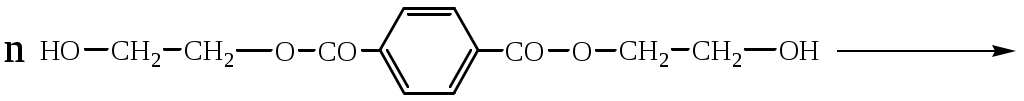 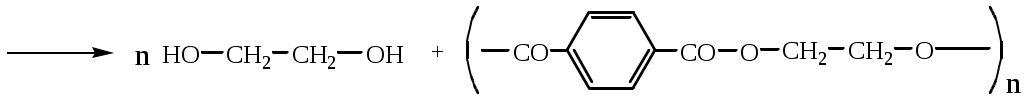 полиэтилентерефталат Бензол из толуола получают каталитическим гидродеалкилированием в присутствий никелевого катализатора при 680—720 °C с выходом свыше 96%. 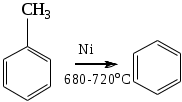 Деалкилирование может проводиться также с использованием водяного пара: 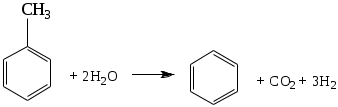 Реакция протекает либо при 600—800 °C в присутствии катализаторов иттрия, лантана, церия, празеодима, неодима, самария или тория, либо при 320—630 °C в случае использования катализаторов никеля — оксида хрома (III) или никеля — оксида алюминия. Выход бензола составляет около 90%. В присутствии платины или палладия на активном оксиде алюминия селективность повышается до 96—98 %. Каталитическим диспропорционированием толуола в присутствии водорода получают смесь бензола и изомеров ксилола. Реакция протекает при 450—530 °C, в качестве катализатора служит оксид кобальта — оксид молибдена (VI) на алюмосиликате или оксиде алюминия, выход составляет 97 % при степени превращения 40 % Как отмечалось выше, около 6 % фенола производится из толуола через бензойную кислоту. Используется технология производства бензойной кислоты окислением толуола кислородом воздуха с использованием жидкофазного катализатора 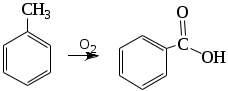 Мольный выход бензойной кислоты составляет 90—95 %. Далее получение фенола проводится по процессу компании «Дау кемикл» в расплавленной бензойной кислоте, содержащей соли меди и различные промоторы, при подаче воздуха и водяного пара. Окислителем является медь (II), восстанавливающаяся до меди (I). Из бензоата меди образуется бензоилсалициловая кислота, дальнейшее превращение которой в фенол протекает через фенилбензоат или через салициловую кислоту. 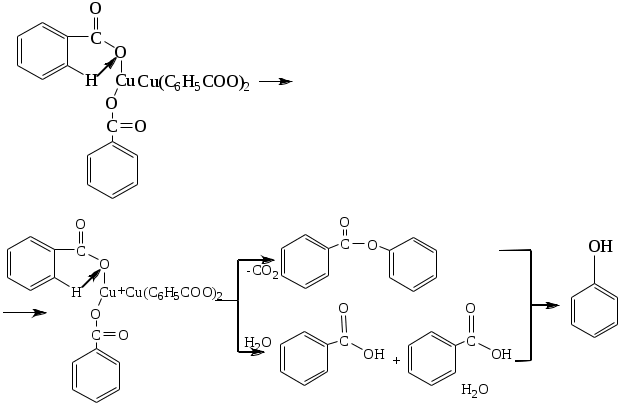 Основной недостаток метода — образование до 0,1 кг остаточных продуктов на 1 кг фенола, которые нельзя сжигать из-за содержащихся в них солей меди. Фирмой «Луммус» разработан процесс окисления бензойной кислоты в паровой фазе над новым катализатором, содержащим медь. Процесс проводится с высокой объемной скоростью, и благодаря быстрому удалению фенола из зоны реакции не образуются нелетучие побочные продукты. Процесс более экономичен по сравнению с жидкофазным вариантом и не уступает кумольному методу. Из бензойной кислоты можно получить циклогексанкарбоновую кислоту и далее реакцией с нитрозилсерной кислотой — капролактам Выход капролактама составляет 85 % от теоретического при расчете на толуол. Важное преимущество этого метода состоит в отсутствии побочного продукта — сульфата аммония. Диспропорционированием бензоата калия в присутствии оксида углерода (IV) может быть получена терефталевая кислота через ее дикалиевую соль: 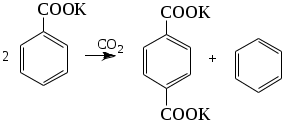 Реакция проводится в жидкой фазе при 400 °C в присутствии цинковых или кадмиевых катализаторов. Японской фирмой «Мицубиси гэс кемикл» разработан процесс производства п-толуилового альдегида из толуола и оксида углерода (II). Карбонилирование толуола протекает селективно при использовании системы HF - ВF3. Получается g-толуиловый альдегид чистотой 99,3% с выходом 95%, который далее может быть превращен в терефталевую или в надтолуиловую кислоту, из последней можно получать n-крезол, а также различные эпоксиды — оксид пропилена, глицидол, эпихлоргидрин. Нитрованием толуола получают о- и n-нитротолуол, продукты восстановления которых — толуидины — применяются в производстве красителей. n-Нитротолуол используется также для получения п-аминобензойной кислоты, 4-карбоксифенилгидразина аминостильбена. Нитрованием толуола производится 2,4-динитротолуол, из которого получают толуилендиизоцианат по одной из следующих схем: 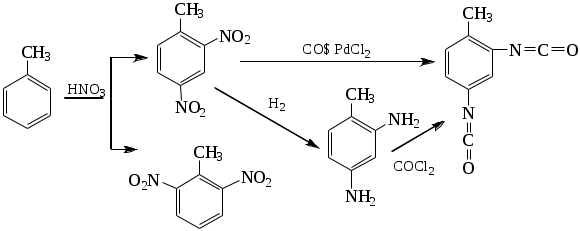 Толуилендиизоцианат — важный мономер для производства полиуретанов. Прямым окислением толуола или гидролизом бензальхлорида может быть получен бензальдегид. Хлорированием толуола получают также бензилхлорид и бензотрихлорид. Из толуола можно получать стильбен, при взаимодействии которого с этиленом образуется стирол: 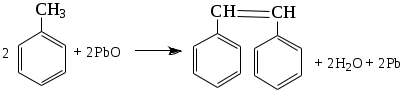 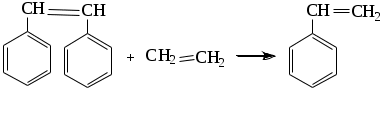 Предложен способ получения стильбена из толуола и водяного пара в присутствии' катализаторов: оксидов таллия(III), сурьмы (III) и др. при 570 0C. Описано получение из толуола диарил- метан- и диарилкетондикарбоновых кислот, которые могут использоваться для производства поликонденсационных смол. Окислительным аммонолизом толуола получают беyзонитрил. Щелочным плавлением сульфокислот толуола получают смесь крезолов, содержащую 80—85 % и-крезола, а из цимолов по аналогии с кумольным методом — дикрезольную фракцию, представляющую в основном смесь м- и и-крезола. Мощности действующих и проектирующихся установок по производству о- и л-ксилола во всех странах и регионах мира на 1981 г. приведены в работе [86]. Общие мировые мощности действующих установок составляли 2522 тыс. т/год о-ксилола и 5987 тыс. т/год n-ксилола, а проектирующихся — соответственно 587 и 1190 тыс. т/год. Около 16 % выделенных ксилолов смешивается с бензином, 17 % используется в качестве растворителя и 67 % разделяется на индивидуальные изомеры. о-Ксилол выделяют из ксилольной фракции ректификацией как наиболее высококипящий изомер, а n-ксилол — кристаллизацией [43] или адсорбцией [88]. Выход n-ксилола повышается при использовании процесса изомеризации остающейся фракции. Парофазным окислением о-ксилола в присутствии оксида ванадия (V) при 375—435 °C получают фталевый ангидрид. Селективность процесса возрастает при замене оксида кремния(IV) на оксид титана (IV). Окислительным аммонолизом о-ксилола получают фталонитрил, использующийся в производстве пигментов. м-Ксилол до настоящего времени в основном изомеризуется в о- и n-изомеры. Окислением м-ксилола сульфитом аммония может быть получена изофталевая кислота. Окисление может проводиться также кислородом воздуха в среде уксусной кислоты в присутствии кобальт-бромидного катализатора. Изофталевая кислота применяется для производства ненасыщенных полиэфиров, алкидных смол и пластификаторов. Окислительным аммонолизом м-ксилола получают изофталонитрил, а гидрированием последнего — ксилилендиамин Сополимеризацией адипиновой кислоты с м-ксилилеидиамином производят найлон-6,8. м-Ксилилендиамин используется также в качестве исходного продукта для производства м-ксилилендиизоцианата и полиуретанов на его основе. Алкилирование м-ксилола пропиленом приводит к 2,4-диметилизопропилбензолу, из которого по аналогии с кумольным методом получают 2,4-ксиленол, применяющийся в производстве пластмасс, ядохимикатов, фармацевтических препаратов. n-Ксилол практически полностью потребляется для производства терефталевой кислоты и диметилтерефталата, из которых получают полиэфирные волокна. Из фракции C9 катализата риформинга ректификацией выделяют псевдокумол. Разработан и метод выделения мезитилена, включающий следующие стадии: гидрирование мезитиленовой фракции, ректификация гидрогенизата с выделением 1,3,5-три- метилциклогексанов, дегидрированием которых получают мезитилен. Окислением псевдокумола получают тримеллитовую кислоту и тримеллитовый ангидрид, которые применяются для производства пластификаторов, полиэфироимидных и полиамидимидных лакокрасочных покрытий, в качестве отвердителя эпоксидных смол. Нитрованием псевдокумола с последующим восстановлением получают 2,4,5-триметиланилин (псевдокумидин) — полупродукт для синтеза красителей и витамина E. Алкилированием псевдокумола пропиленом можно получать триметилизопропилбензол, а при алкилировании метилхлоридом в присутствии хлорида алюминия — тетраметилбензолы, содержащие 48 % (по массе) дурола. При алкилировании мезитилена метанолом в присутствии алюмосиликатов, получается фракция тетраметилбензолов, содержащая 85—95 % изодурола Мезитилен применяется для производства тримезиновой кислоты, мезидина (2,4,6-триметиланилина) — полупродукта для промышленности красителей. Перспективно получение из мезитилена антиокислителей, некрасящих стабилизаторов для пластмасс. Хлорированием мезитилена можно получать смесь продуктов, обогащенную 1,3,5-трис(трихлорметил) бензолом, которая может использоваться в качестве противоизносной присадки к смазочным маслам. Среди тетраметилбензолов наиболее важный изомер — дурол, окислением которого производится пиромеллитовый диангидрид. Из пиромеллитового диангидрида и ароматических диаминов получают полипиромеллитимиды, сохраняющие рабочие свойства в интервале от —270 до 500 °С. Нафталин и поликонденсированные арены в настоящее время получают при переработке коксохимической смолы. Перспективно выделение нафталина из жидких продуктов пиролиза на мощных этиленовых установках при использовании газойля в качестве сырья. Так, на установке ЭП-300 при пиролизе бензина может быть выделено всего 6—6,5 тыс. т/год нафталина, а при пиролизе дизельного топлива 18—24 тыс. т/год нафталина [103]. Получающийся нафталин, в отличие от коксохимического, почти не содержит бензотиофена, а примеси алкенов легко могут быть удалены с помощью гидрогенизационного метода. Разработаны также процессы производства нафталина гидродеалкилированием алкилнафталинов, содержащихся в тяжелых фракциях катализатов риформинга и в каталитических крекинг-газойлях. Нафталин является основной составной частью каменноугольной смолы, которая и служит единственным исходным материалом для получения нафталина и его производных. Нафталин используют для производства фталевого ангидрида, инсектицидов, 1- и 2-нафтолов. Последние получают щелочным плавлением 1- и 2-нафталинсульфокислот. Нагреванием 2-нафтола с водным раствором сульфита и дисульфита аммония получают 2-нафтиламин: 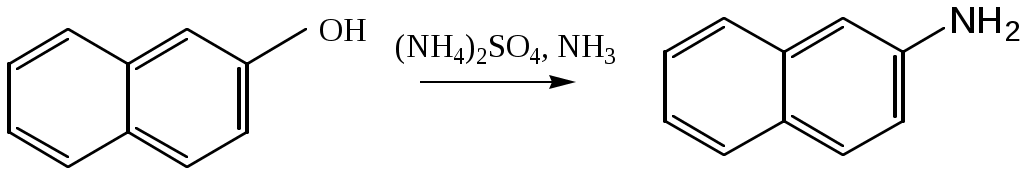 Нафтол- и аминосульфокислоты применяют для производства азокрасителей. Алкилированием нафталина хлоралканами получают «парафлоу» - депрессоры, добавляемые к смазочным маслам для понижения температуры застывания: С10Н8 + 2С25Н51Сl Окислением 2,6-диалкилпроизводных нафталина синтезируют нафталин-2,6-дикарбоновую кислоту, идущую для производства полимерных волокон. Взаимодействием нафталина с этилбензолом или с этиленом в присутствии м-ксилола и хлорида алюминия можно получать 2-этилнафталин и далее 2-винилнафталин. Полимеры 2-винилнафталина и сополимеры со стиролом имеют достаточно высокую механическую прочность и теплостойкость, 2-винилнафталин применяется также в производстве ионообменных смол. Окислением 2,6-диметилнафталина получают 2,6-нафталиндикарбоновую кислоту — сырье для полиэфирных волокон более термо- и водостойких, чем полиэтилентерефталат. Алкилированием нафталина хлоралканами производятся «парафлоу» — депрессоры, понижающие температуру застывания смазочных масел. Нафталин может использоваться также в качестве сырья для синтеза антрахинона. Индивидуальные арены и их смеси применяются не только в нефтехимическом синтезе. Они используются как растворители, как высокооктановые компоненты бензинов. Тяжелые остатки катализатов риформинга нашли применение в качестве растворителей для инсектицидов, медленно высыхающих лаков. Экстракты селективной очистки масел, содержащие 70—80 % аренов, используют в качестве наполнителей бутадиен-стирольных каучуков [108]. Таким образом, арены являются важнейшим видом сырья для промышленности основного органического синтеза, по масштабам производства и потребления уступающим лишь этилену, а по ассортименту вырабатываемой продукции превосходящим другие класса углеводородов. Дальнейшее расширение использования аренов связано с выделением из нефтепродуктов полиметилпро- изводных бензола, комплексной переработкой жидких продуктов пиролиза нефтяных фракций, разработкой новых технологических процессов на базе, в частности, толуола и м-ксилола. 2 Методическая часть 2.1 Методы удаления аренов из нефтяных фракций Выделение ароматических углеводородов легких и средних фракций проводят с помощью жидкостно-адсорбционной хроматографии (проявительно-вытеснительный вариант) с применением в качестве элюента (проявителя) изопентана и в качестве вытеснителя — этилового спирта. Этим же методом можно выделить также ароматические углеводороды масляных фракций нефти и разделить эти углеводороды на моноциклические, бициклические и полициклические. Для этого в хроматографическую колонку с силикагелем добавляют исследуемую масляную фракцию в виде раствора в легком алкане, например в изопентане. После того как адсорбент пропитается, в колонку заливают вначале изопентан, затем бензол и спирто-бензольную смесь (1:1). Отбирают пробы элюата, выходящего из колонки, и определяют их показатели преломления. Вначале из колонки выходит смесь нафтенов и алканов, затем моноциклические арены (n от 1,5 до 1,53), затем бициклические (п от 1,53 до 1,55), затем полициклические арены (п от 1,55 и выше). Для выделения полициклических ароматических углеводородов используют также и химические методы. Так, многократной обработкой пикриновой кислотой можно выделить из средних и высших фракций нефти значительную долю полициклических ареной в виде пикратов. При разложении пикратов водой выделяются полициклические арены. Фенантреновые углеводороды можно выделить из нефтяных фракций в виде аддуктов с малеиновым ангидридом и после гидролиза ангидридных групп в аддуктах с последующим фотохимическим разложением образовавшихся дикарбоновых кислот получить эти углеводороды в чистом виде. Если из нефтяной фракции необходимо только удалить ароматические углеводороды (без их выделения в чистом виде), то с этой целью проводят сульфирование фракции избытком концентрированной серной кислоты или смесью Каттвинкеля (раствор пентоксида фосфора в серной кислоте). В случае бензиновых фракций все арены переходят в слой кислоты в виде сульфокислот. Среди неинструментальных методов определения группового химического состава бензиновых фракций наиболее широкое распространение получил анилиновый метод, основанный на неодинаковой растворимости углеводородов различных классов в анилине. При смешении нефтяной фракции с анилином при комнатной температуре обычно образуются два слоя, т. е. не происходит полного растворения нефтепродукта в анилине. Если эту смесь нагревать, постоянно перемешивая, то при достижении определенной температуры произойдет полное взаимное растворение анилина и нефтепродукта, слои исчезнут, и жидкость станет однородной. Температуру, соответствующую полному взаимному растворению анилина и нефтепродукта, называют анилиновой точкой или критической температурой растворения (КТР) данного нефтепродукта в анилине. Наиболее низкими анилиновыми точками среди углеводородов характеризуются арены, наиболее высокими — алканы; циклоалканы занимают промежуточное положение. Алкены и циклоалкены имеют несколько более низкое значение анилиновых точек по сравнению с циклоалканами близкой молекулярной массы. В пределах одного гомологического ряда анилиновые точки, как правило, возрастают с увеличением массы и температуры кипения углеводорода. Такая же закономерность наблюдается и для фракций, выделенных из одной и той же нефти. Существуют два метода определения анилиновых точек: метод равных объемов и метод максимальных анилиновых точек. В первом случае берут равные объемы анилина и исследуемой фракции и определяют температуру их полного смешения. Полученную температуру называют анилиновой точкой. Во втором случае находят температуру, называемую максимальной анилиновой точкой или истинной критической температурой растворения в анилине. Ее получают после нескольких определений температуры растворения продукта в возрастающих количествах анилина. При увеличении количества анилина температура полного растворения сначала повышается и при некотором соотношении фракции и анилина достигает максимума, после чего при дальнейшем увеличении количества анилина начинает падать. Максимальную температуру полного растворения принимают за максимальную анилиновую точку (истинную КТР в анилине). Обычно разница между анилиновыми точками фракций и их максимальными анилиновыми точками невелика, причем она увеличивается с ростом температур кипения фракций и увеличением содержания в них аренов. При анализе группового химического состава прямогонного бензина со сначала разгоняют из колбы с дефлегматором (шариковым или елочным) или на небольшой колонке на узкие стандартные фракции, пределы выкипания которых соответствуют пределам выкипания аренов в смеси с другими углеводородами: Фракция. °С н. к. — 60 Не содержащая аренов 60—95 Бензольная 95—122 Толуольная 122—150 Ксилольная и этилбензольная 150—200 Содержащая арены С9 — С19 Для каждой фракции определяют максимальную анилиновую точку (Т), после чего из фракций удаляют арены и для деароматизированных фракций вновь определяют анилиновые точки (Т1) методом равных объемов. Массовую долю аренов А, %, рассчитывают по формуле: А = К(Т1-Т), где (Т1 —Т)—депрессия анилиновой точки, зависящая от содержания аренов, К—коэффициент, соответствующий содержанию аренов, вызывающему понплх'ппе анилиновой точки деароматизнрованион фракции на 1 ºС. Значение К зависит от строения аренов и их содержания в продукте. Поэтому при анализе бензинов их необходимо предварительно разогнать (пользуясь колбой с дефлегматором) на узкие фракции: бензольную (60—95°С), толуольную (95 — 122 °С), ксилольную (122—155°С) и остаточную. В каждой фракции содержание аренов определяют отдельно. Значение К в этих фракциях изменяется следующим образом:
При анализе бензинов-растворителей с низким содержанием аренов (1,5; 3,0 и 5,0 %) —значение К соответственно 1,00; 1,16; 1,17. Содержание аренов в бензине А определяют по формуле: А=(А1В1 + А2В2+ ...+АnВn)/100, где А1, A2, ..., Аn — массовое содержание углеводородов в отдельных фракциях, %; В1, В2, ..., Вn — массовое содержание фракций в бензине, % . | ||||||||||||||||||||||||
