Лаба. Арены лаба 3 текст. Лабораторная работа 1 арены цель работы изучить номенклатуру и химические свойства аренов Теоретическое обоснование
 Скачать 71.5 Kb. Скачать 71.5 Kb.
|
|
Лабораторная работа № 1 АРЕНЫ Цель работы: изучить номенклатуру и химические свойства аренов Теоретическое обоснование Общая формула аренов СnН2n-6. Это углеводороды, в молекулах которых присутствует бензольное кольцо: 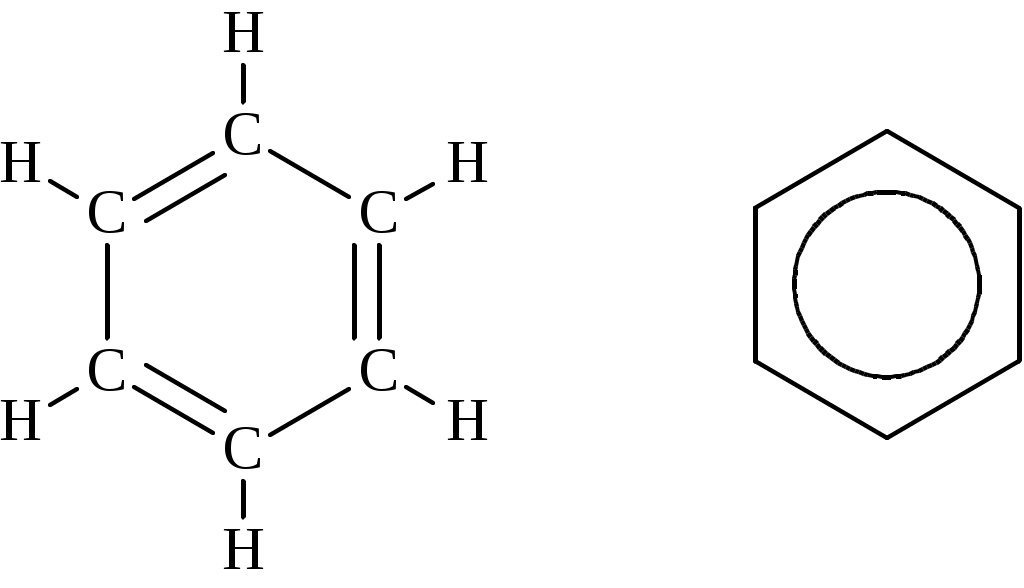 Простейшие представители этого класса углеводородов: 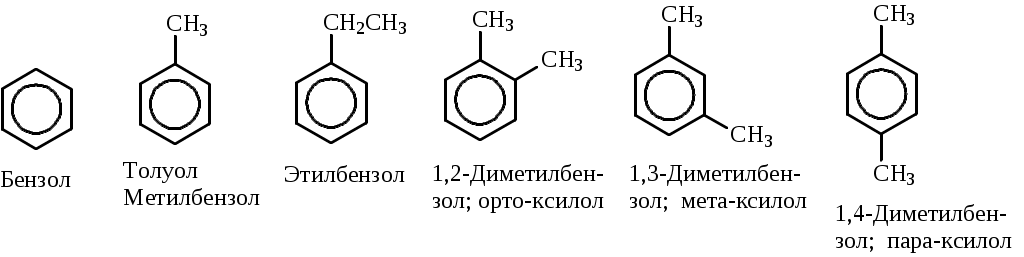 Названия гомологов бензола строятся следующим образом: - при наличии одного заместителя в ароматическом кольце называют сначала заместитель, затем добавляют бензол: 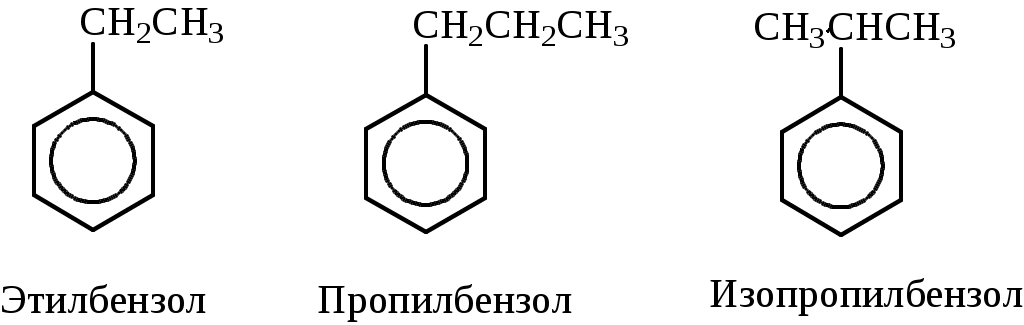 - при наличии двух заместителей положение заместителей нумеруется. При этом может быть три варианта взаимного расположения заместителей: 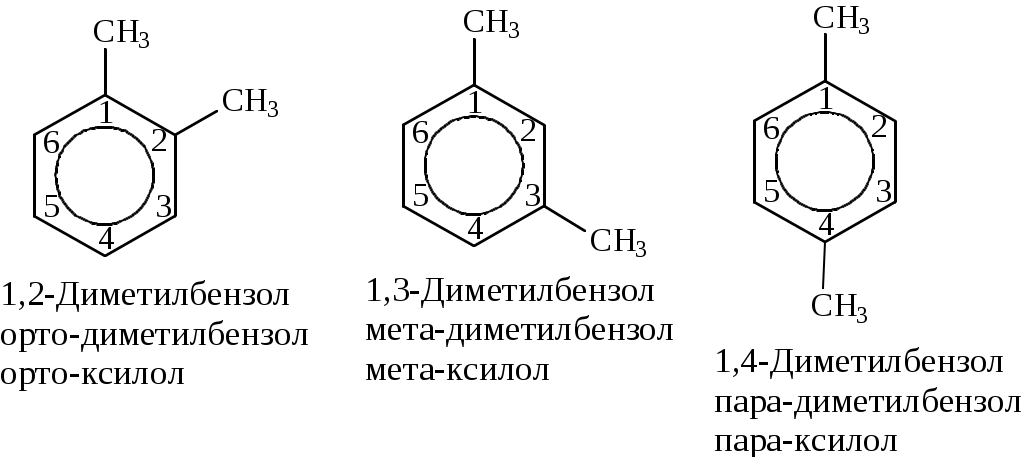 Кроме того, для обозначения положений 1,2- может применяться приставка орто-, для 1,3-- приставка мета-, для 1,4- - приставка пара- ; - при наличии трех и более заместителей также нумеруется положение заместителей. Из возможных порядков заместителей выбирается тот, при котором сумма номеров заместителей будет наименьшей. Например:  Химические свойства В бензольном кольце имеется замкнутая система из 6 p-электронов, равномерно распределенных по всей плоскости кольца. Этим объясняются специфические свойства ароматических углеводородов. По строению бензол и его гомологи являются непредельными соединениями. Однако в обычных условиях бензол не присоединяет бром (не обесцвечивает бромную воду), не окисляется перманганатом калия (КМnO4). В отдельных случаях бензол способен к реакциям присоединения, однако они идут в более жестких условиях для бензола, чем для непредельных углеводородов. Молекула бензола присоединяет 3 молекулы водорода с образованием циклогексана, однако эта реакция идет при температуре 180-200°С на катализаторах Ni, Pt, Pd. 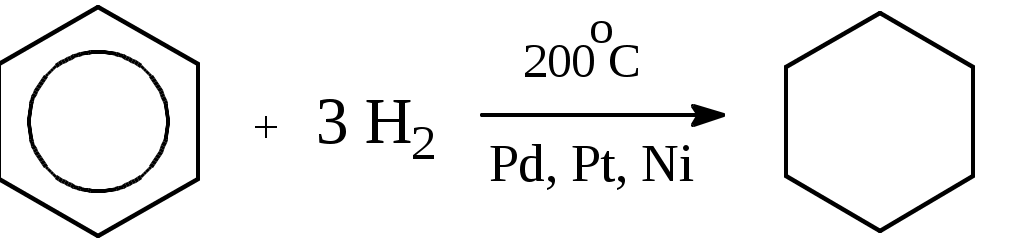 В целом для ароматических углеводородов более характерны реакции замещения. 2. В присутствии катализаторов хлор и бром замещают атомы водорода в молекуле бензола 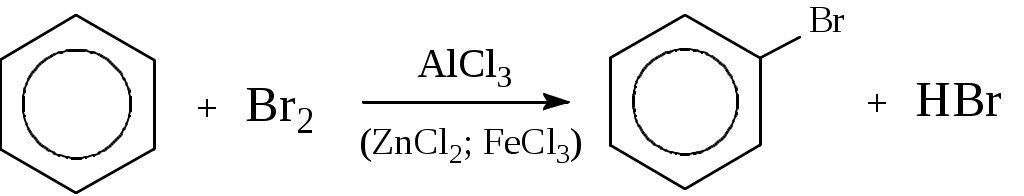 3. С НСl и НВr бензол не реагирует, а с концентрированной H2SO4 происходит замещение атома водорода на сульфогруппу (-SО3Н) и образуется бензолсульфокислота: 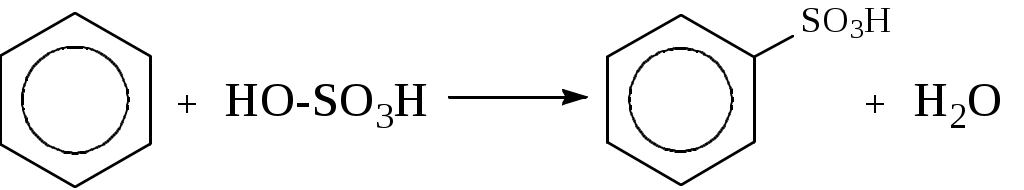 Эта реакция идет при комнатной температуре. 4. При действии на бензол смеси конц. Н2SО4 и конц. НNO3 (нитрующей смеси) происходит замещение в бензоле атома водорода на нитрогруппу -NO2: 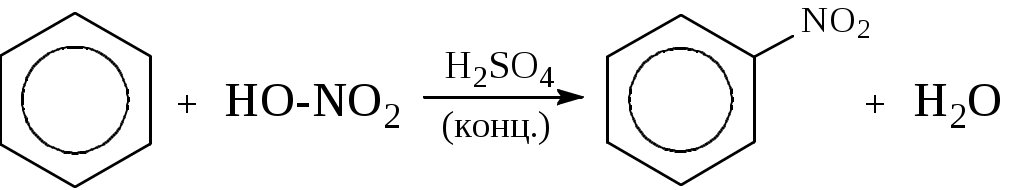 5. Бензольное кольцо устойчиво к воздействию температуры. Бензол при температурах крекинга (450-500°С) не расщепляется, а в основном конденсируется с образованием кокса. 6. Бензольное кольцо также устойчиво к действию окислителей. При действии сильных окислителей гомологи бензола окисляются по боковым цепям с образованием карбоновой кислоты (чаще всего бензойной).  Сам бензол подвергается окислению только в специфических условиях - при окислении кислородом воздуха при высокой температуре в присутствии оксида ванадия (V). 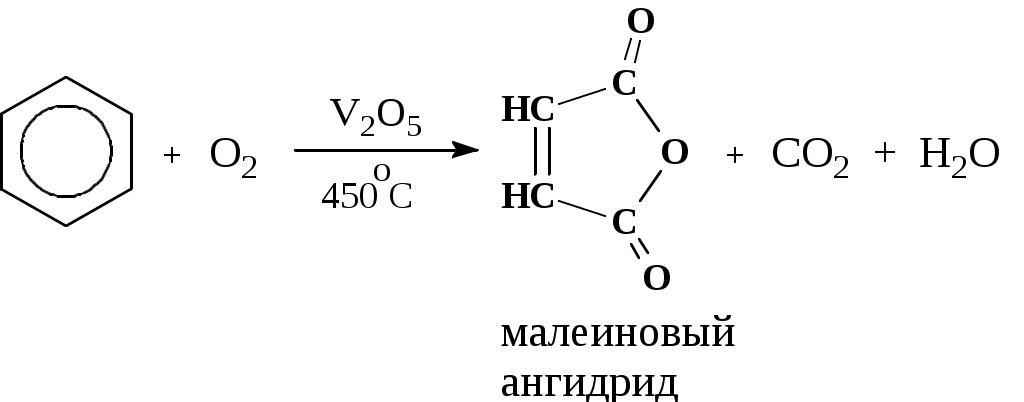 Экспериментальная часть Опыт 1. Горение толуола и ксилола В две фарфоровые чашки наливают: в одну толуола (метилбензол), в другую ксилол (диметилбензол). Поджигают. Записать наблюдения. Написать реакции горения толуола и ксилола. Опыт 2. Бромирование толуола и ксилола В одну пробирку помещают 1 мл ксилола, в другую - 1 мл толуола. В каждую из пробирок добавляют по 1 мл раствора бромной воды и встряхивают. Наблюдают образование двух слоев и экстракцию брома аренами. Бромирование аренов происходит только в присутствии катализатора (железные опилки). Если в обе пробирки добавить железных опилок, встряхнуть и нагреть на водяной бане, то произойдет исчезновение окраски, следовательно, арены бромируются. Написать реакции бромирования толуола и ксилола. Опыт 3. Окисление толуола и ксилола перманганатом калия В две пробирки наливают по 1 мл толуола и 1 мл ксилола. Приливают по 1 мл раствора перманганата калия (КМnО4). Добавляем в обе пробирки по 0,5 мл концентрированной серной кислоты. Встряхиваем обе пробирки, наблюдаем изменение цвета. Написать реакции окисления толуола и ксилола перманганатом калия (с образованием карбоновых кислот).  Опыт 4. Качественная реакция на арены (формолитовая реакция) Арены образуют с формалином в присутствии серной кислоты ярко окрашенные продукты конденсации. Это свойство используют как качественную реакцию на присутствие ароматических углеводородов в нефтепродуктах. В пробирку насыпают параформ, добавляют серной кислоты (при этом образуется формальдегид), встряхивают и добавляют 1-2 мл толуола. При отсутствии ароматических углеводородов смесь остается бесцветной. Появление яркого красно-бурого окрашивания свидетельствует о наличии аренов. Написать реакции толуола с формальдегидом. |
