отчет. дихлорэтан. Этилендихлорид ClCH
 Скачать 78.21 Kb. Скачать 78.21 Kb.
|
ДихлорэтанЭтилендихлорид (ClCH2–СН2Cl) – 1,2-дихлорэтан (ДХЭ) является одним из самых крупнотоннажных галогенпроизводных углеводородов. Применение 1,2-дихлорэтана как хорошего растворителя ограничивается его высокой токсичностью. В основном ДХЭ используют в качестве промежуточного продукта для синтеза винилхлорида, винилиденхлорида, этилендиамина, этиленгликоля, полисульфидных каучуков, фумигант [25]. Производственные мощности по выпуску ДХЭ во всём мире составляют около 20 млн. тонн в год [24]. Основными производителями являются компании США, Западной Европы и Японии. Сырьевыми источниками для получения ДХЭ являются: этиленовая фракция газов пиролиза нефтяного сырья или этиленовая фракция коксового газа и хлор. В промышленности 1,2-дихлорэтан получают двумя способами. Первый – это прямое хлорированием этилена в жидкой фазе в присутствии катализатора – хлорида железа(III) при 50–100 °С с отбором продукта в жидкой или паровой фазе: СН2=СН2 + Cl2 → СН2Cl–СН2Cl, При получении дихлорэтана взаимодействием этилена с хлором в среде жидкого дихлорэтана, который растворяет оба газа, реакция протекает фактически в жидкой фазе. Благодаря этому достигается безопасность процесса и улучшаются условия теплопередачи от реакционной массы к охлаждающему агенту. Отвод реакционного тепла значительно облегчается, и полностью устраняется возможность местных перегревов. Кроме того, в среде дихлорэтана процесс протекает аутокаталитически и скорость реакций значительно выше, чем при взаимодействии газообразных этилена и хлора. При взаимодействии С2Н4 с хлором, кроме продукта присоединения хлора по двойной связи (1,2-дихлорэтана), образуются также продукты замещения – трихлорэтан, тетрахлорэтан и высшие полихлориды: CH2 =CH2 + 3Cl2 → СНСl2–СНСl2 + 2HCl и т.д. Состав получаемых продуктов резко изменяется, если в реакционную среду вводить свободный кислород. При этом образование продуктов замещения замедляется и даже прекращается. Объясняется это тем, что цепная реакция замещения в присутствии кислорода обрывается: Cl2 → Cl· + Cl· Cl2· + О2 → Cl–O–O· Cl–O–O· → Cl· ClO· + ClO· → Cl2 + O2 и т.д. Это обстоятельство значительно упрощает технологию производства дихлорэтана. Поэтому при добавлении кислорода можно проводить взаимодействие этилена с хлором при 20–30 °С и отводить тепло реакции холодной водой без охлаждения рассолом требуемого при температурах ниже 0 °С. Благодаря этому снижается выход побочных продуктов замещения с 10 до 0,5–2 %, упрощается аппаратурное оформление процесса и понижается себестоимость дихлорэтана [15]. Технология процесса прямого хлорирования этилена представлена на рисунке 15. Сухие этилен и хлор подают через барботеры в нижнюю часть пустотелого реактора 1, заполненного 1,2-дихлорэтаном. Прямое хлорирование осуществляют при 50–60 °С в растворе жидкого дихлорэтана. Выходящий из реактора 1,2-дихлорэтан направляют на трехступенчатую отмывку от солей, которую проводят последовательно кислотой, щелочью и водой. Затем продукт процесса направляют на осушку в комплекс аппаратов 2. 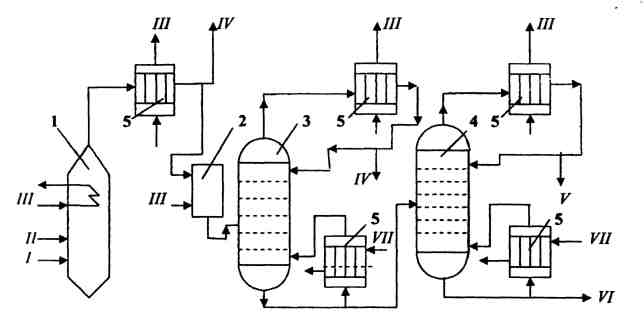 Рис. 15. Технологическая схема получения 1,2-дихлорэтана хлорированием этилена [15]: 1 – реактор, 2 – блок очистки, 3, 4 – ректификационные колонны, 5 – холодильники, I – хлор, II – этилен, III – вода, IV – легкокипящие фракции, V – 1,2-дихлорэтан, VI – полихлориды, VII – пар. Далее дихлорэтан подают в ректификационную колонну 3, где из него в качестве дистиллята удаляют более легкие компоненты, конденсируют в конденсаторе 5 и частично возвращают в колонну в качестве флегмы. Балансовое количество дистиллята выводят с установки. Кубовый продукт колонны 3 направляют в ректификационную колонну 4 для удаления из целевого продукта полихлоридов, которые выводят из куба колонны. Дихлорэтан отбирают с верха колонны, конденсируют в холодильнике-конденсаторе 5 и частично возвращают в колонну на орошение, а остаток направляют на товарный склад. Схемой предусмотрен отвод избытка тепла процесса путем циркуляции внизу колонн части кубовых продуктов через выносные холодильники 5. Технология прямого хлорирования этилена позволяет достигать почти 100 % конверсии хлора, а конверсия этилена зависит от его избытка и составляет 90–97 %. При этом выход 1,2-дихлорэтана равен 99 %. Второй способ получения 1,2-дихлорэатана – окислительное хлорированием этилена в газовой фазе при участии катализатора Декона (СuСl2 на Аl2О3): СН2=СН2 + 2НCl + 0.5О2 → СН2Cl–СН2Cl + Н2О. Данный процесс существует благодаря необходимости утилизации больших объемов отходящего газообразного HCl, являющегося побочным продуктом на ряде химических предприятий, где имеются процессы заместительного хлорирования и дегидрохлорирования. Объединение стадий хлорирования и оксихлорирования позволяет сбалансировать промышленные производства по С12 [26]. Промышленный процесс оксихлорирования проводят в газовой фазе на гетерогенном катализаторе. Катализатором служат соединения меди, щелочных и редкоземельных элементов или их смеси на пористых носителях. Основой для оксихлорирования послужил газофазный процесс окисления HCl. Процесс получения 1,2-дихлорэтана окислительным хлорированием включает две основные стадии [26]: синтез 1,2-дихлорэтана и его выделение (рис. 16). В реактор с псевдоожиженным слоем катализатора 1 подают этилен, НCl и воздух в соотношении, обеспечивающим 3–5 % избыток этилена. Температура в реакторе 210–260 °С. Реакционная масса, покидающая реактор, содержит 1,2-дихлорэтан, полихлориды, реакционную воду, НCl и инерты (из воздуха). Реакционная масса далее поступает в закалочную колонну 2, где происходит охлаждение парогазовой смеси и удаление из нее непрореагировавшего НCl и инертных газов. При этом пары конденсируют в конденсаторе 3, собирают в емкости 11, оттуда конденсат стекает в сепаратор 5. Из него часть водного слоя возвращают на орошение колонны 3, а остальную массу подают на очистку от 1,2-дихлорэтана в колонну гетероазеотропной ректификации 6. Нижний слой из сепаратора (1,2-дихлорэтан-сырец) направляют в колонны 7 и 8 для отмывки от хлораля, которую ведут раствором щелочи и водой. С низа колонны 7 и верха колонны 8 выводят солевые стоки. Несконденсированные в аппарате 3 газы с верха емкости 11 поступают в абсорбер 4, орошаемый водой, для улавливания хлорида водорода.  Рис. 1. Технологическая схема получения 1,2-дихлорэтана оксихлорированием этилена в паровой фазе [15]: 1 – реактор, 2 – закалочная колонна, 3 – холодильники, 4 – абсорбер, 5 – сепаратор жидкость-жидкость, 6 – колонна гетероазео-тропной ректификации, 7, 8 – колонны отмывки от хлораля, 9, 10 – ректификационные колонны, 11 – емкости, I – этилен, IIа – хлористый водород, IIIб –концентрированная соляная кислота, III – кислородсодержащий газ, IV – 1,2-дихлорэтан, V – полихлориды, VI – газы абсорбции, VII – вода, VIII – раствор щелочи, IX – солевые стоки, X – легколетучие примеси. Из колонны 8 дихлорэтан поступает в колонну 9 для отгонки от летучих примесей, которые выводят из колонны в виде дистиллята, охлаждают в холодильнике 3, затем собирают в емкости 11, из которой дистиллят частично возвращают в колонну на орошение, а остаток выводят с установки. Кубовый продукт колонны 9 подают в колонну 10, где проводят окончательную очистку дихлорэтана удалением полихлоридсв, которые отводят из куба колонны 10. Товарный 1,2-дихлорэтан выводят из колонны в виде дистиллята, который конденсируют в холодильнике 3, собирают в емкости 11, из которой его частично возвращают в колонну на орошение, а остаток подают на товарный склад. В этом процессе конверсия этилена составляет 95 %, НCl – 99 %; выход 1,2-дихлорэтана – 97 %. |
