Фх дз. Формальна кинетика
 Скачать 81.45 Kb. Скачать 81.45 Kb.
|
|
Домашняя работа №1 на тему: «Формальна кинетика» Студент: Группа: Вариант: 93 Дано
Построим графики концентрационно-временных зависимостей при каждой температуре. 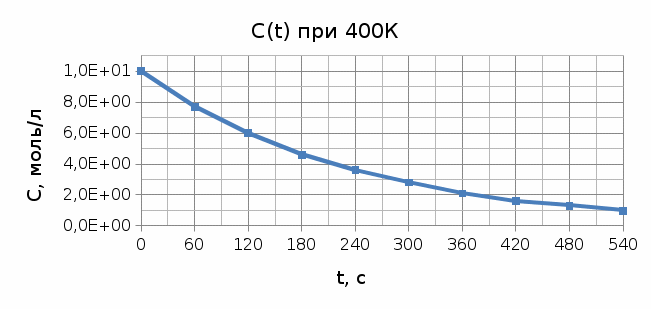  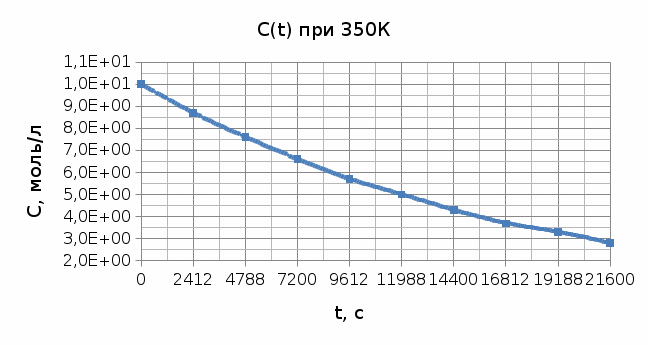 Пункт 1 1)Метод Вант-Гоффа. Для дальнейших расчетов выбираем концентрационно-временную зависимость при Т = 380 К.Построим касательные к кривой в 2 точках: при t= 36с0, t= 1080с для определения скорости реакции в эти промежутки времени. Формула для расчета скорости реакции: 𝜔 = − 𝑑𝐶/𝑑𝑡 ω1(t= 360с) = 0,033 ω2(t= 1080 c) = 0,016 Тогда порядок реакции можно найти, построив графикв координатах ln(ω) и ln(C). ln(𝜔) = 𝑛 ∗ 𝑙𝑛(𝐶) Вычислим необходимые параметры для построения графика
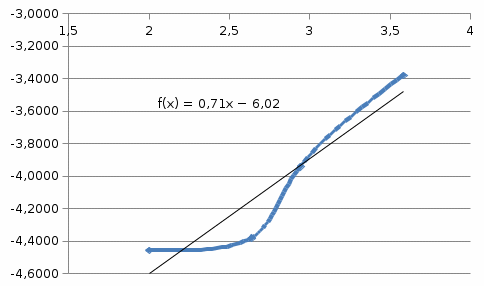 Из графика видно, что порядок реакции n=0,707≈1 2) Метод полупревращений. Для дальнейших расчетов выбираем концентрационно-временную зависимость при Т =400 К. По этому методу порядок реакции можно найти, построив график в координатах 𝑙𝑛(t1/2) и 𝑙𝑛(C). 𝑙𝑛(𝑡1/2) = (1 − 𝑛) ∗ 𝑙𝑛(𝐶) Рассчитаем необходимые параметры для построения графика зависимости логарифма времени полупревращения от логарифма концентрации:
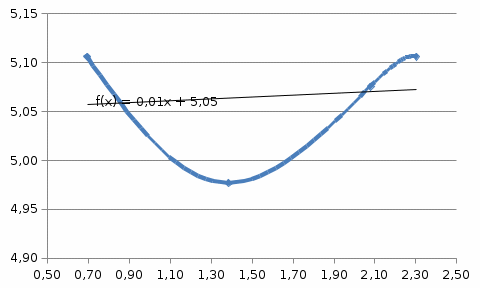 Из графика видно, что 0,009=1-n, тогда порядок реакции n = 0,991≈ 1. Итак, вычисленный порядок реакции равен 1. Задача №2. 1) Проверим полученный порядок реакции Для этого построим концентрационно-временные зависимости для порядков n1 = 0,5, n = 3 и n2 = -0,5 при каждой из данных температур. Рассчитаем необходимые параметры: C(1-n1) = C(0,5) C(1-n2) = C(-0,5) С=lnC T=400K
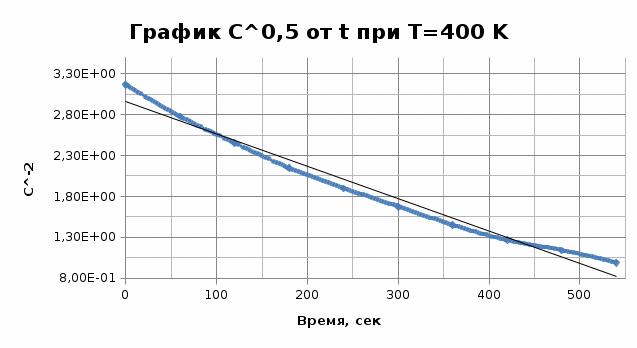 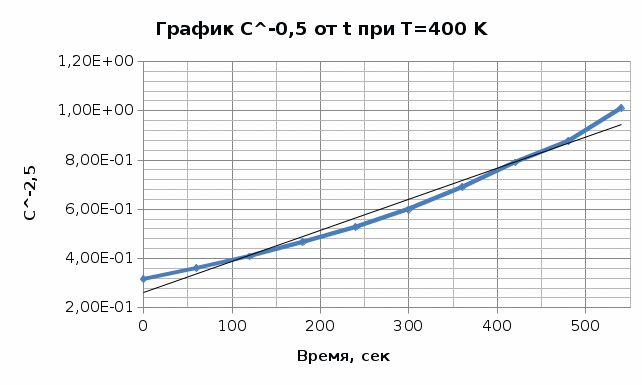  T=380K
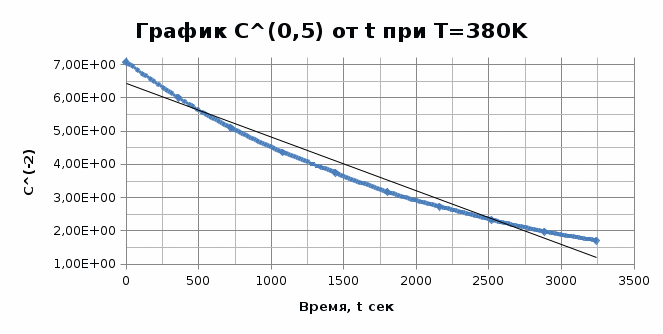 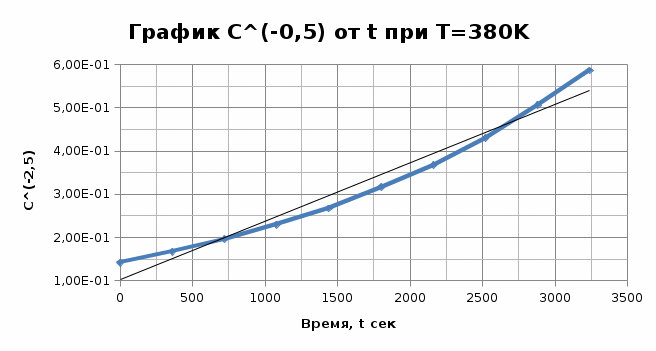 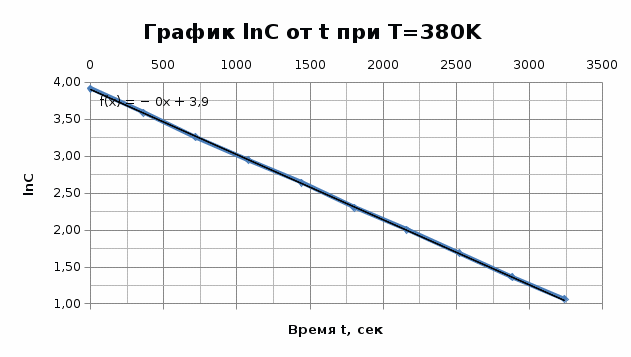 T=350K
  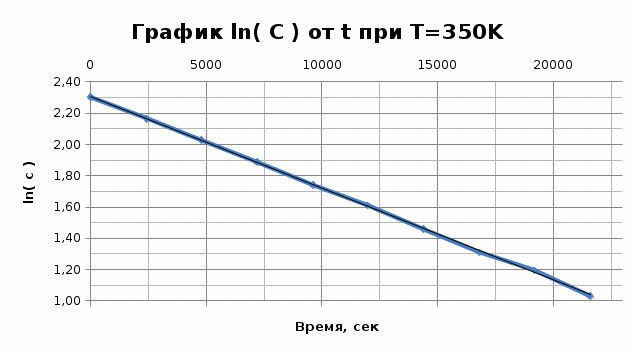 Графики представляют прямую линию в координатах ln(С) от t. Следовательно, порядок реакции равен 1. Расчет констант скоростей реакции. Для реакций первого порядка константа скорости реакции рассчитывается по формуле: 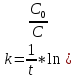 ) )Для расчета графическим методом необходимо построить график в координатах ln(С) от t. Рассчитаем необходимые параметры для построения графиков. T=400 K
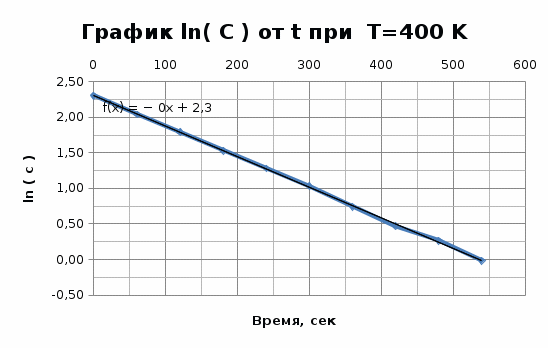 Исходя из графика, константа скорости реакции при Т = 400 К k1 = 4,30E-03с-1 . Расчет константы скорости по формуле. 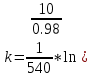 )=0.0043 )=0.0043T=380 K
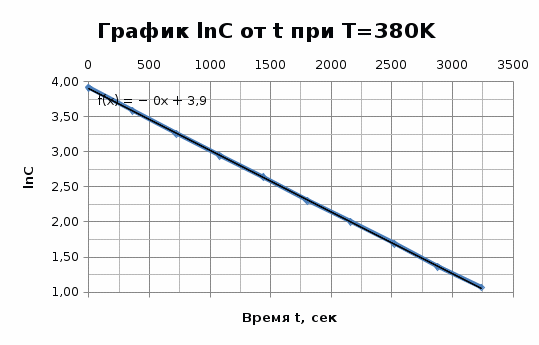 Исходя из графика, константа скорости реакции при Т = 380 К k1 = 8,79E-04с-1 . Расчет константы скорости по формуле. 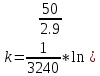 )=0.0008788 )=0.0008788T=350 K
 Исходя из графика, константа скорости реакции при Т = 350 К k1 = 6E-05с-1. Расчет константы скорости по формуле. 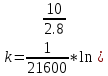 )=0.0000589 )=0.0000589Пункт 3. Расчет параметров уравнения Аррениуса. Уравнение Аррениуса k=k∞*exp(-E/RT). Необходимо найти k∞ - предэкспоненциальный множитель и Е – энергию активации. Для нахождения этих параметров построим график в координатах ln(k) и 1/T.
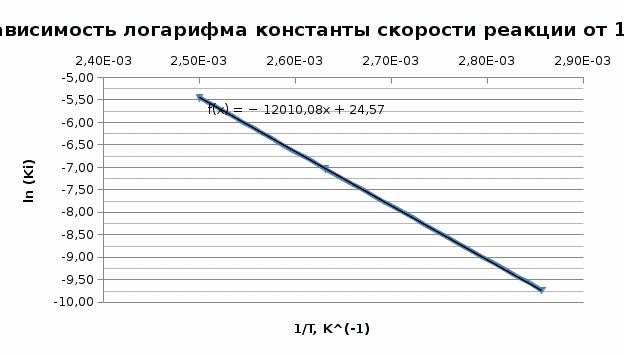 Так, из уравнения прямой: 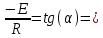 -12010 -12010 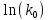 =24,57 =24,57Откуда, E = 99851,14Дж, k0 = 4,68E+10c-1 Пункт 4 T=360 K, 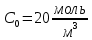 , , 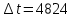 сек. сек.Т.к n=1 , то время полупревращения 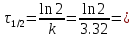 0,208779 0,208779А скорость реакции 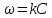 , где С найдем из , где С найдем из 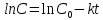 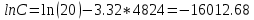 Откуда С=1, тогда 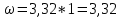 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
