впрвь. Вопросы ОХТ 11. Изменение интенсивных параметров с целью ускорения химикотехнологических процессов называется интенсификцией
 Скачать 51.34 Kb. Скачать 51.34 Kb.
|
|
11. Термодинамический анализ химико-технологических процессов Он является очень важным при проектировании технологических процессов. Он позволяет сделать вывод о направлении протекания процесса (направо или налево), предварительно выбрать условия проведения процесса, определить равновесный состав продуктов реакции, а также рассчитать тепловые эффекты. Величины, характеризующие состояние термодинамических систем, называются термодинамическими параметрами. К ним относятся: температура, давление, удельный объем, плотность, удельная внутренняя энергия и др. Термодинамические параметры делятся на экстенсивные и интенсивные. Параметры, которые пропорциональны массе системы, называются экстенсивными: это объем, внутренняя энергия, энтальпия, энтропия. Экстенсивные параметры обладают свойством аддитивности (их можно складывать). Интенсивные параметры не зависят от массы термодинамической системы: это температура, давление, а также экстенсивные величины, отнесенные к единице массы или объема системы (удельная теплоемкость, плотность и др.). Изменение интенсивных параметров с целью ускорения химико-технологических процессов называется интенсификцией. Для термодинамического анализа в химической технологии решаются следующие задачи: 1. Проверяются возможности самопроизвольного протекания проектируемого химического процесса. 2. Определение энергетических эффектов химико – технологических процессов, необходимых для составления энергетических балансов и расчета затрат энергии на проведение ХТП. 3. Расчет максимально возможных степеней превращения и выходов продуктов целевых, побочных, нецелевых при проведении обратимых процессов. 4. Определение диапазона температур и давлений, при которых наиболее рационально осуществлять ХТП. Как известно из курса физической химии условием протекания химической реакции в прямом направлении без затраты работы является уменьшение свободной энтальпии системы. (Энтальпия равна сумме внутренней энергии системы и призведения давлении на ее объем, Изменение энтальпии в изобарном процессе равно его тепловому эффекту. Энтальпия – теплосодержание). Энергетические эффекты при протекании ХТП оценивают на основе теплот образования и сгорания веществ. Для многих веществ теплоты образования и сгорания известны и сведены в таблицы. Их называют стандартными тепловыми эффектьами и обозначают Δ Н. При оценке максимально возможных степеней превращения Хмакс необходимо учесть, что для необратимых процессов Хмакс= 1. 11. производство 1-3 бутадиена(дивинила) Основные промышленные способы производства дивинила В промышленности бутадиен-1,3 производится многими методами, которые отличаются видом используемого сырья, числом технологических стадий и экономичностью. Бутадиен-1,3 может быть получен: 1) Выделением из С4-фракции продуктов пиролиза жидких нефтепродуктов, содержащей 20-30% бутадиена-1,3. 2) Каталитическим дегидрированием н-бутиленовой фракции, выделенной из продуктов пиролиза нефтепродуктов. 3) Каталитическим дегидрированием н-бутана, выделенного из попутного нефтяного газа. 4) Каталитическим расщиплением этанола (С.В. Лебедев). 5) Взаимодействием ацетилена с формальдегидом через бутандиол-1,3 (В. Реппе). 6) Из ацетальдегида через адоль и бутандиол-1,3 (Н.Н. Остромысленский). 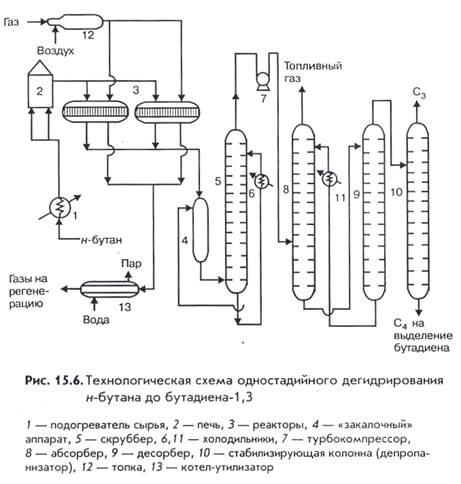 Технологическая схема и ее краткое описание Через подогреватель 1 н-бутан поступает в печь 2, где нагревается до 600-620оС и направляется в один из реакторов 3, который работает на дегидрирование. Из реактора контактный газ, пройдя для «закалки» аппарат 4, подается в скруббер 5, в котором охлаждается холодным маслом, циркулирующим через холодильник 6. Охлажденный в скруббере газ сжимается в турбокомпрессоре 7 до давления 1,3 МПа и направляется в абсорбер 8. Из верхней части абсорбера выходит водородсодержащий топливный газ, а раствор углеводородов в абсорбенте подается в десорбер 9. Из верхней части десорбера отгоняется фракция С3-С4, а абсорбент через холодильник 11 возвращается на орошение абсорбера 8. В качестве абсорбента используется высококипящая углеводородная фракция С5. Фракция С3-С4 из верхней части десорбера поступает в колонну 10 (депропанизатор), где из нее отгоняется пропан. Оставшаяся фракция С4 с содержанием бутадиена-1,3 от11 до 13% массовых направляется на выделение бутадиена, а бутан бутиленовая фракция возвращается в виде рецикла на дегидрирование, присоединяясь к свежему н-бутану. По окончании цикла дегидрирования поток углеводородного сырья переключается на другой реактор, а затем для регенерации катализатора топочными газами с небольшим содержанием кислорода из топки 12. Теплота газообразных продуктов регенерации катализатора используется для выработки технологического пара в котле-утилизаторе 13. Основные технологические параметры, влияющие на процесс Дегидрирование н-бутана до бутадиена-1,3 представляет обратимый гетерогенно-каталитический процесс, протекающий с поглощением тепла через стадию образования изомеров бутилена. Одностадийный процесс дегидрирвания н-бутана до бутадиена-1,3 может быть описан суммарным уравнением: С4Н10 -- С4Н6+2Н2 и складывается из двух реакций: С4Н10 -- С4Н8+Н2 С4Н8 -- С4Н6+Н2. Достоинства данного метода: сокращение расхода технологического пара; исключение второй стадии дегидрирования. |
