аналит. Аналит. химия. Количественный анализ Константа нестойкости гексацианоферрат калия Устойчивости
 Скачать 2.15 Mb. Скачать 2.15 Mb.
|
|
Качественный анализ: Окраска пламени:  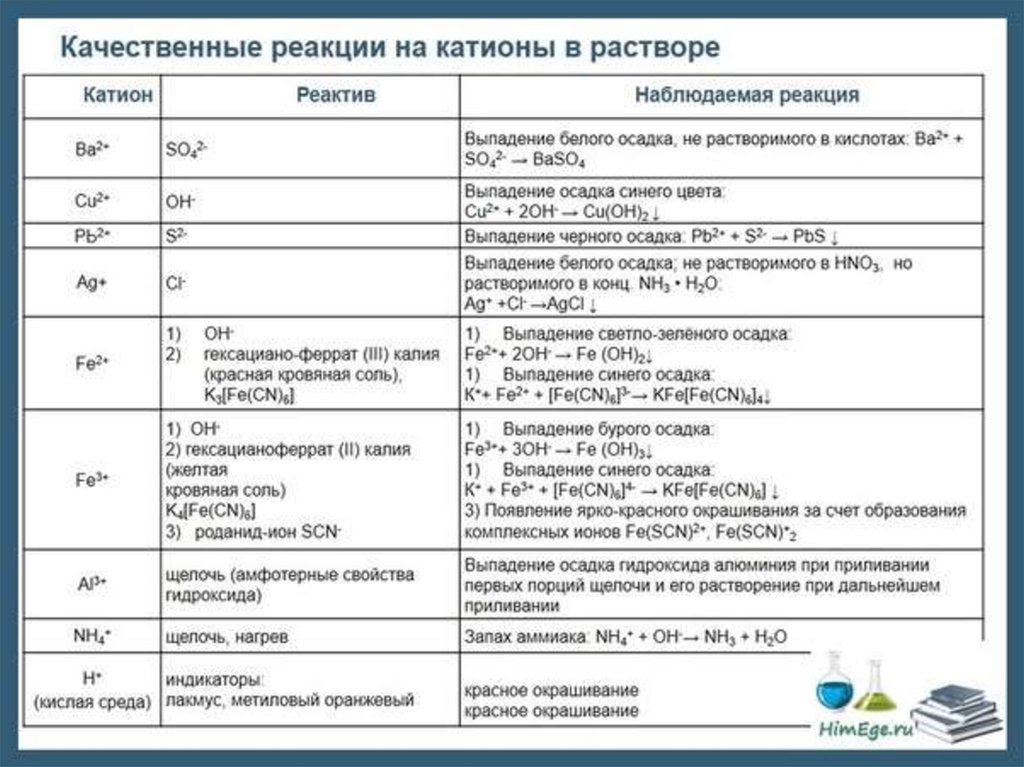 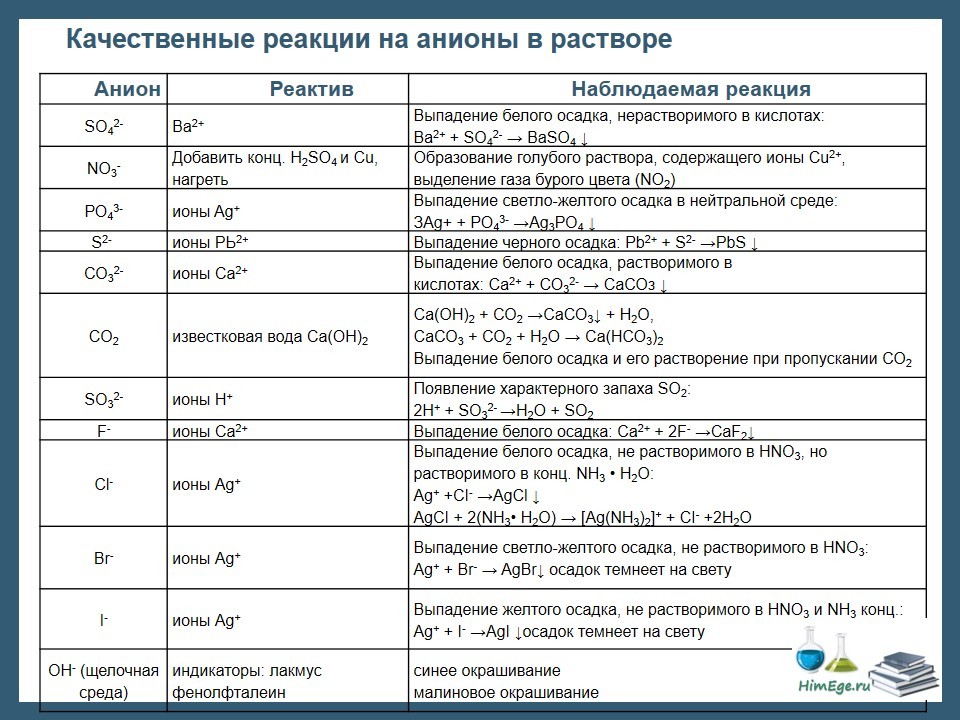 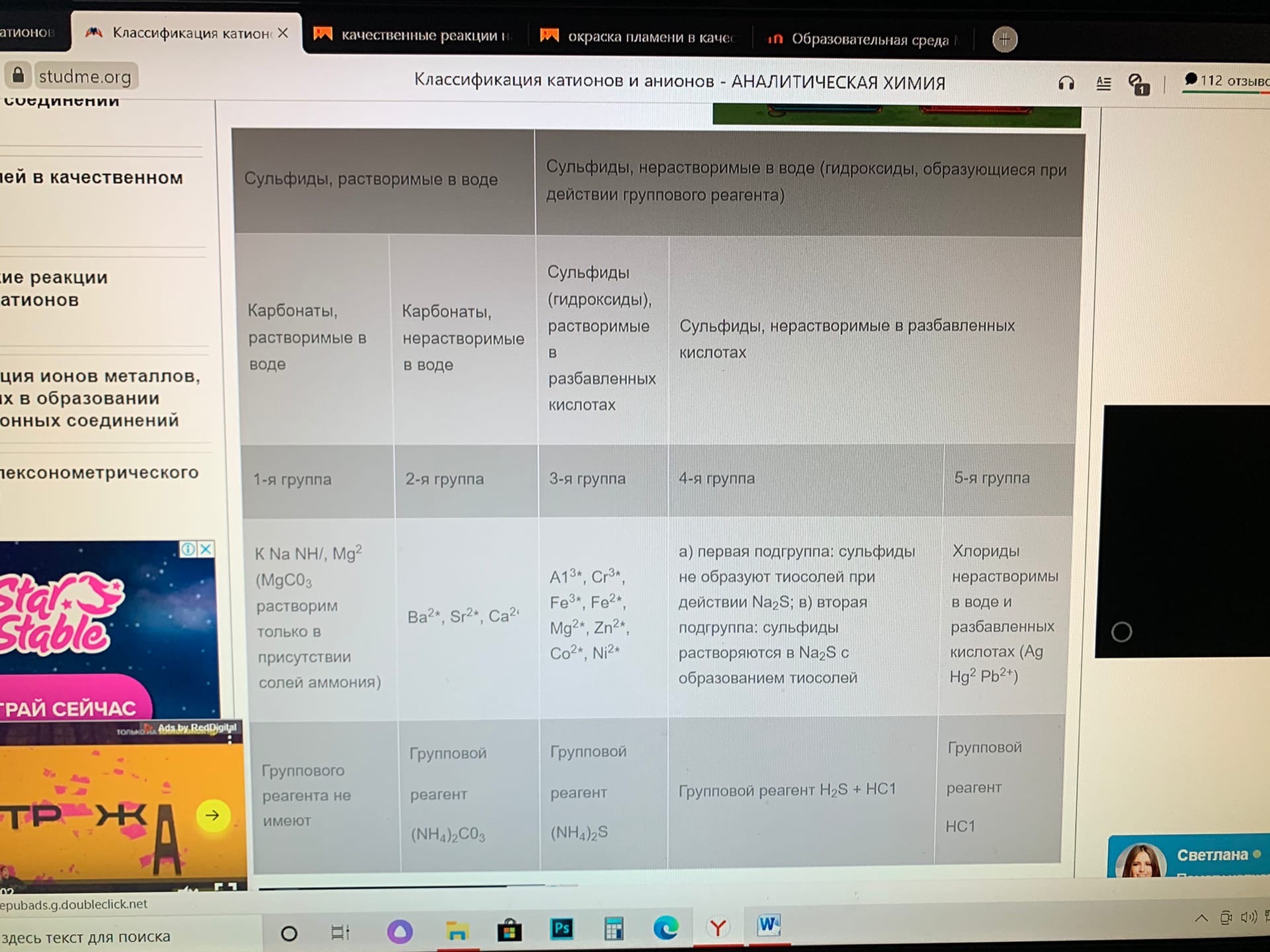 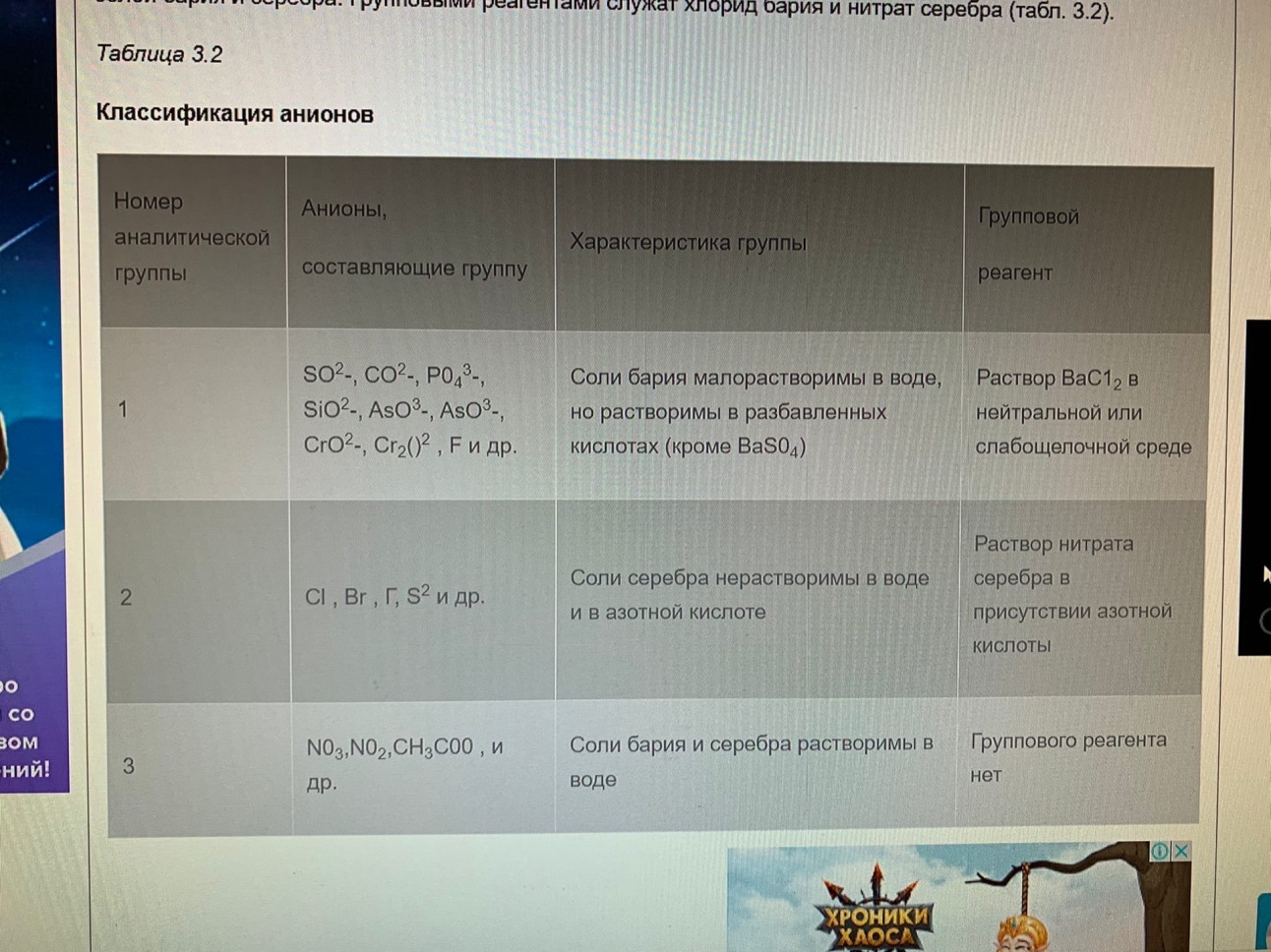 Произведение растворимости:  Количественный анализ:  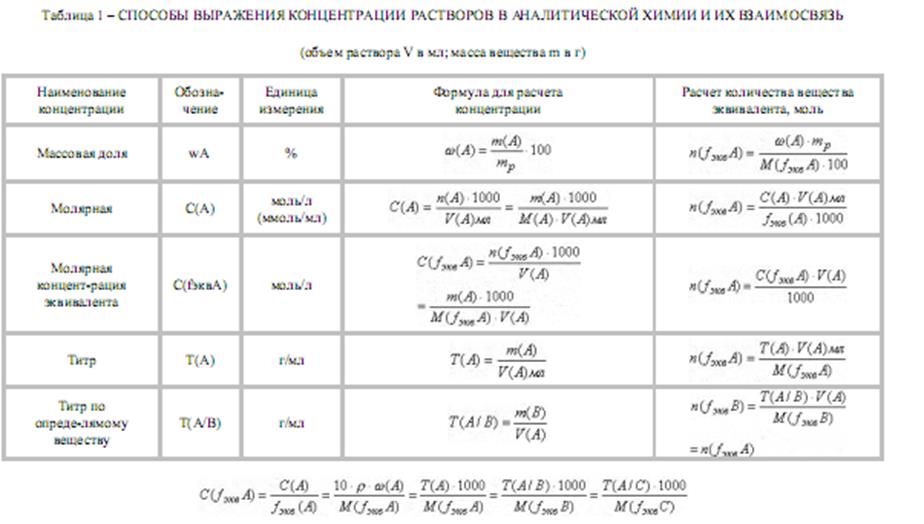 Константа нестойкости гексацианоферрат калия: 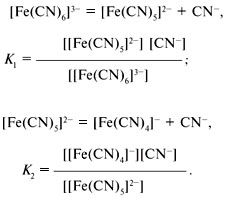 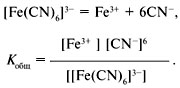 Устойчивости: 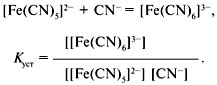 Куст = 1/Кнест. Рассчет pH:  Буферные растворы:  В точке эквивалентности:   Комплексонометрия: Комплексонометрия (трилонометрия) - титриметрический метод анализа, основанный на реакциях взаимодействия комплексонов (чаще всего трилона Б), катионами щелочноземельных и тяжелых металлов, которые приводят к образованию растворимых в воде бесцветных прочных внутрикомплексных соединений. Трилон Б (комплексон III) образует внутрикомплексные соединения с катионами металлов за счет валентных связей с карбоксильными группами, вытесняя из них атомы водорода, а также за счет координационных связей ионов-комплексообразователей с атомами азота. В растворе трилон Б диссоциирует на ионы: 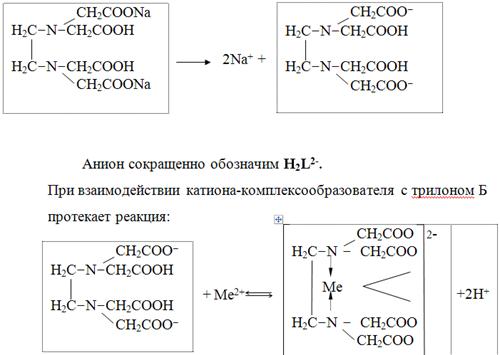 Схематически реакции комплексообразования с катионами, имеющими различные степени окисления, можно представить следующими уравнениями: H2L2- + Ме2+ ↔ [MeL]2- + 2Н+ H2L2- + Ме3+ ↔ [MeL]- + 2Н+ H2L2- + Ме4+ ↔ [MeL] + 2Н+ Способы фиксирования конечной точки титрования. При комплексонометрическом титровании используют металлохромные индикаторы (металлоиндикаторы). Металлоиндикаторы - это органические красители (мурексид, эриохром черный Т, эриохром сине-черный Б, цинкон и др.), которые образуют с определяемыми ионами растворимые в воде окрашенные комплексные соединения, менее прочные, чем комплекс катиона металла с трилоном Б. При этом комплекс катиона с индикатором и свободный индикатор имеют различную окраску: H2Ind- + Ме 2+↔ [Ме Ind]- (окраска 1) (окраска 2) При комплексонометрическом титровании к анализируемому раствору прибавляют металлоиндикатор, который образует с определяемыми катионами комплекс, имеющий определенную окраску. В процессе титрования трилоном Б комплекс катионов металла с индикатором разрушается и образуется бесцветный, очень прочный комплекс катионов с трилоном Б, а в раствор переходят ионы свободного индикатора: [Ме Ind] - + H2L2 - ↔ [MeL]2 - + H2Ind - (окраска 2) (окраска 1) Конечную точку титрования определяют по собственной окраске индикатора (окраска 1). Условия комплексонометрическоro титрования: 1. Реакции комплексообразования должны протекать быстро, количественно и стехиометрично, чтобы вблизи точки эквивалентности определяемые катионы были практически полностью связаны в комплекс. Константа нестойкости образующихся комплексов должна быть малой величиной. 2. Определяемые ионы должны образовывать с металлоиндиктором менее прочные комплексы, чем их комплексы с трилоном Б. 3. Комплексонометрическое титрование следует проводить при определенном значении рН (рН < 10), так как в щелочной среде могут образовываться осадки гидроксидов определяемых катионов или их основные соли. В процессе титрования при взаимодействии катионов с трилоном Б в раствор переходят ионы Н+, в результате чего рН раствора понижается, что приводит к смешению реакции комплексообразования влево и делает реакцию обратимой. Для поддержания определенного значения рН титрование следует проводить в присутствии буферных растворов, имеющих определенное значение рН. Большинство катионов титруют трилоном Б в присутствии аммиачного буферного раствора NH4ОH + NH4Cl при рН = 9,2. Титриметрия:   Количественный анализ: https://himya.ru/kolichestvennyj-analiz.html Задачи на кривые титрования: http://www.nizrp.narod.ru/krivtitrov.pdf Тест 1 Катионы, анионы Предельное разбавление реакции на катион Co2+ с раствором роданида аммония равно 20*10^4 мл/г. минимальный объем, необходимый для открытия ионов Co2+, равен 0,03 мл. Рассчитайте открываемый минимум катионов кобальта в нанограммах. Ответ приведите с точностью до целого числа. + 150 Предельное разбавление реакции на катион Cu2+ с водным раствором аммиака равно 25*10^4 мл/г. Минимальный объем, необходимый для открытия ионов меди(II), равен 0,05 мл. Рассчитайте открываемый минимум катионов меди в нанограммах. Ответ приведите с точностью до целого числа. + 200 Открываемый минимум ионов Cu2+ в растворе с гидроксидом аммония равен 0,2 мкг. Предельная концентрация равна 4*10^(-6) г/мл. Рассчитайте минимальный объем исследуемого раствора в микролитрах. Ответ приведите с точностью до целого числа. + 50 Предельное разбавление реакции на катион Ni2+ с раствором диметилглиоксима равно 4*10^5 мл/г. Рассчитайте концентрацию хлорида никеля (в микромоль/л) при данном предельном разбавлении. Ответ запишите с точность до первого знака после запятой. + 42,6 Предельное разбавление реакции на катион натрия с раствором дигидроантимоната калия равно 15*10^4 мл/г. Рассчитайте концентрацию сульфата натрия (в микромоль/л) при данном предельном разбавлении. Ответ округлите до целого числа. + 150 Открываемый минимум ионов Ni2+ реакцией с диметилглиоксимом равен 0,05 мкг, предельная концентрация катионов никеля равна 2,5.10^(-6) г/мл. Рассчитайте минимальный объем исследуемого раствора в микролитрах. Ответ приведите с точностью до целого числа. + 20 Какая реакция является характерной на катион хрома(3+)? + Со щелочью или с раствором аммиака, Получение надхромовой кислоты, Окисление ионов хрома(3+) до хромат-ионов в щелочной среде, Окисление ионов хрома(3+) до дихромат-ионов в кислой среде Гидроксиды каких катионов пятой аналитической группы быстро окисляются кислородом воздуха? +Mn2+, Fe2+ Что наблюдается при действии избытка щелочи на раствор, который содержит катионы свинца? + Выпадает белый осадок гидроксида свинца, который затем растворяется Какие реагенты используются для определения катиона марганца(2+)? +(NH4)2S2О8 + HNO3, H2O2+KOH, Br2 Какой лиганд содержится в комплексном соединении, которое одновременно является пищевой добавкой E536 и реагентом на катион Fe2+ в фармакопейном анализе. Напишите формулу лиганда. +CN Какие химические свойства характерны для гидроксидов катионов шестой аналитической группы? +Нерастворимые в избытке щелочей, Образуют амммиакаты, которые растворимы в воде Какой аналитический эффект характерен для реакции взаимодействия нитрата серебра с недостатком водного раствора аммиака? +Образование темного-коричневого (черного) осадка Катион какого металла шестой аналитической группы присутствует в растворе, если при добавлении тиоцианата аммония и амилового спирта образуется кольцо, окрашенное в сине-голубой цвет? Напишите символ этого металла на английском языке. +Co Какие лиганды образуют с ионом Fе3+ комплексы кроваво-красного цвета? Напишите формулу лиганда. +SCN- Какой катион образует осадок с К2Сг2О7? +Pb2+, Ag+ Что характерно для катионов первой аналитической группы? +Отсутствие группового реагента Каким аналитическим эффектом сопровождается реакция обнаружения катиона калия с гексанитритокупратом(II) натрия-свинца? +Образуются черные кубические кристаллы Какой осадок выпадает первым, если к раствору, который содержит ионы Ва2+, Sг2+, Са2+ в равных концентрациях, прибавлять раствор серной кислоты? Запишите его формулу. +BaSo4 Какой аналитический эффект наблюдается при добавлении к осадку хлорида серебра раствора аммиака, а потом раствора азотной кислоты? +Осадок сначала растворяется, а потом выпадает белый осадок Действием какого реагента можно разделить катионы Ni2+ и Нg2+? +Тиоцианат аммония, Диметилглиоксим Каким реагентом можно разделить смесь катионов Аl3+ и Fе3+? +NaOH Укажите висмут-содержащий продукты реакции: BiСl3 + NH3*H2O. Напишите его формулу на английском языке. +BiOCl Какие из катионов шестой аналитической группы в растворе бесцветны? +Cd2+, Hg2+ Какая реакция является характерной для катиона алюминия? Напишите строчную формулу действующего реагента на английском языке. +C14H8O4 Соли какого катиона окрашивают пламя в фиолетовый цвет? Напишите символ этого металла (на английском языке). +K Для разделения ионов Cl- и I- можно использовать: +AgNO3, а потом (NH4)2CO3, Бромную воду Сколько существует аналитических групп анионов? Приведите ответ в виде числа. +3 К исследуемому раствору добавили хлороформ и по каплям хлорную воду. Хлороформный слой окрасился в оранжевый цвет. Это свидетельствует о присутствии в растворе какого аниона? Напишите его формулу. +Br- Чем можно обнаружить нитрит-анионы в присутствии нитратов? а) Серной кислотой; б) Иодидом калия; в) Перманганатом калия; г) Хлоридом аммония; д) Дифениламином. +H2SO4, KI + H2SO4, KMnO4, (C6H5)2NH После добавления к подкисленному исследуемому раствору иодида калия наблюдается появление синего цвета в присутствии крахмала. Какой из приведенных ионов обуславливает появление указанного аналитического сигнала. +NO2-, SO3 2- Какие анионы относятся ко второй аналитической группе анионов? +Cl-, Br-. I-, S2- После добавления группового реагента - соляной кислоты выпал осадок PbCl2. Выберите раствор для промывания осадка, который обеспечивает наименьшую его растворимость. +0,1 M HCl Какая реакция позволяет открыть сульфит-анион? +С перманганатом калия в кислой среде Каким аналитическим эффектом сопровождается реакция обнаружения иодид-аниона нитратом серебра? +Выпадает интенсивно-желтый осадок. Какой галогенид серебра растворяется в растворе карбоната аммония? Напишите его формулу. +AgCl Задачи пересчет концентраций Титр раствора HCl равен 0,003652 г/мл. Рассчитайте эквивалентную концентрацию раствора в моль/л. Ответ приведите с точностью до десятых. +0,1 Рассчитайте титр раствора H2SO4 , эквивалентная концентрация которого 0,09943 моль/л. Ответ приведите с точностью до третьего знака после запятой. +0,005 Из 5,3 г Na2CO3 приготовили 1 л раствора. Рассчитайте молярную концентрацию полученного раствора. Ответ округлите до второго знака после запятой. +0,05 Какой объем раствора HCl с плотностью 1,1 г/мл (ω=20,39%) следует взять для приготовления 1 л 0,2 М раствора? Ответ округлите до десятых. +32,5 Для приготовления стандартного раствора карбоната натрия взяли навеску 1,3250 г Na2CO3 квалификации х.ч. Навеску растворили и разбавили раствор дистиллированной водой до объема 250,00 мл. Рассчитайте титр карбоната натрия по соляной кислоте. Ответ округлите до третьего знака после запятой. Ответ: 0,004 Задачи титрование Навеску образца 0,1535 оксида магния растворили в 40 мл раствора соляной кислоты с титром 0,003646 г/мл. На титрование избытка кислоты израсходовано 7,50 мл NaOH с титром 0,004040 г/мл. Рассчитайте процентное содержание MgO в образце. Ответ округлите до целого числа. Ответ: 42 На титрование 10,00 мл раствора HNO3 расходуется 12,30 мл раствора NaOH с эквивалентной концентрацией 0,11 моль/л. Рассчитайте массу (в граммах) HNO3 в 250 мл такого раствора. Ответ округлите до сотых. Ответ: 2,13 Навеску 0,5000 г карбоната кальция растворили в 25 мл раствора соляной кислоты с эквивалентной концентрацией 0,5100 моль/л. Избыток кислоты был оттитрован 6,50 мл раствора NaOH с эквивалентной концентрацией 0,4900 моль/л. Рассчитайте массовую долю карбоната кальция CaCO3 в образце. Ответ округлите до целого числа. Ответ: 96 Навеску 2,2418 г технического тетрабората натрия растворили в мерной колбе емкостью 100 мл. На титрование 20 мл этого раствора израсходовано 25,50 мл соляной кислоты с титром по гидроксиду натрия 0,003974 г/мл. Рассчитайте массовую долю (в %) кристаллогидрата тетрабората Na2B4O7*10H2O в образце. Ответ округлите до целого числа. Ответ: 108 Рассчитайте содержание (в граммах) CH3COOH в растворе, если на титрование пошло 20 мл раствора гидроксида натрия с титром 0,04614 г/мл. Ответ округлите до сотых. Ответ: 1,38 Задачи "Расчёт pH сильных электролитов" Рассчитайте рН в 0,0002 М растворе гидроксида кальция. Ответ округлите до десятых. Ответ: 10,3 Рассчитайте рН раствора едкого натра, полученного растворением 2 г твердого гидроксида натрия в 1 л дистиллированной воды. Ответ округлите до второго знака после запятой. Ответ:12,54 Рассчитайте рН раствора соляной кислоты, полученного разбавлением 3,0 мл концентрированной соляной кислоты с массовой долей 32% (плотностью 1,16 г/мл) в мерной колбе на 100 мл дистиллированной водой до метки. Ответ округлите до второго знака после запятой. Ответ:0,91 Рассчитайте рН в растворе гидроксида бария с эквивалентной концентрацией 0,1 моль/л. Ответ округлите до второго знака после запятой. Ответ:12,72 Рассчитайте рН в растворе серной кислоты, который приготовили из 44 % раствора серной кислоты с плотностью 1,338 г/мл разбавлением 10 мл этого раствора дистиллированной водой в мерной колбе на 250 мл до метки. Ответ округлите до второго знака после запятой. Ответ:0,93 Задачи "Расчёт pH слабых электролитов" Рассчитайте рН в 0,03 М растворе ортофосфорной кислоты, Кдис1 (H3PO4) = 0,0076. H3PO4 - это кислота средней силы, в данном случае принять как слабый электролит. Ответ округлите до второго знака после запятой. Ответ: 1,82 Рассчитайте рН в водном растворе аммиака, содержащего 10 мл концентрированного 25 % раствора аммиака (плотностью 0,907 г/мл) в 500 мл раствора. Кдис (NH3*H2O) = 1,76*10^(-5). Ответ округлите до второго знака после запятой. Ответ: 11,34 Рассчитайте рН в 0,001 М растворе синильной кислоты. Кдис (HCN) = 6,2*10^(-10). Ответ округлите до первого знака после запятой. Ответ:6,1 Рассчитайте рН в растворе, содержащем 9.3 г анилина в 500 мл воды. Кдис (C6H5NH2) = 4,2*10^(-10). Ответ округлите до второго знака после запятой. Ответ:8,96 Рассчитайте рН в растворе, содержащем 3,75 г аминоуксусной кислоты (глицина) в 200 мл воды. Кдис (NH2CH2COOH) = 1,7*10^(-10). Ответ округлите до второго знака после запятой. Ответ: 5,19 Рассчитайте рН в растворе, содержащем 3,5 г уротропина (гексаметилентетрамина) в 250 мл воды. Кдис [(CH2)6N4] = 1,4*10^(-9). Ответ округлите до второго знака после запятой. Ответ:9,07 Рассчитайте рН в 2 % водном растворе салициловой кислоты (плотность 1 г/мл). Кдис[C6H4(OH)COOH] = 0,0011. Ответ округлите до первого знака после запятой. Ответ: 1,9 Рассчитайте рН в водной суспензии Ag2O, содержащей 0,0001265 моль/л гидроксида серебра. Кдис(AgOH) = 0,005. Ответ округлите до первого знака после запятой. Ответ:10,9 Рассчитайте рН в 3% растворе пероксида водорода (плотность 1 г/мл). Уравнение диссоциации: H2O2 = H+ + [HO2]-, Кдис = 2*10^(-12). Ответ округлите до второго знака после запятой. Ответ:5,88 Рассчитайте рН в 10 % растворе гидроксида лития плотностью 1,1074 г/мл. LiOH - основание средней силы, в данном случае принять как слабый электролит. Кдис (LiOH) = 0,68. Ответ округлите до первого знака после запятой. Ответ:14,2 Тест 2 В уравнении рН = −lgСН+ для идеальных разбавленных растворов сильных электролитов концентрация выражается в … +моль/л 0,01 М раствор какого из перечисленных веществ имеет наибольшее значение рН? +NaOH Чему равна (в моль/л) концентрация раствора гидроксида натрия с рН 13 при 100% диссоциации? +0,1 Чему равно значение рН раствора, полученного разбавлением 0,05 М раствора серной кислоты в 10 раз (α = 1)? +2,0 Какова масса (в г) гидроксида калия, содержащаяся в 10 л раствора (α=1), значение рН которого равно 11? +0,56 В каком растворе растворимость данного вещества равна его концентрации? +насыщенном Как изменится значение рН при разбавлении ацетатного буферного раствора в два раза? +не изменится Какой из перечисленных ионов может проявлять и свойства кислоты, и свойства основания? +HSO3– Водородный показатель рН – это … +отрицательный десятичный логарифм концентрации (активности) ионов водорода в растворе Какой формулой выражается взаимосвязь между водородным и гидроксильным показателями? +рН + рОН = 14 Чему равно значение рН раствора гидроксида бария с концентрацией 0,05 моль/дм3 (α=1)? +13,0 Чему равно значение рН раствора муравьиной кислоты (рК=3,75) с концентрацией 0,01 моль/дм3? +2,875 По какой формуле рассчитывается рН сильных однокислотных оснований (α=1)? +рН = 14 + lgСосн. По какой формуле рассчитывается рН раствора соли слабого однокислотного основания и сильной одноосновной кислоты? +рН = 7 − ½ рКосн. – ½ lgСсоли Чему равна молярная концентрация (в М) 20% раствора сульфата железа(II) (плотность 1,21 г/см3)? +1,6 По какой формуле вычисляется концентрация ионов комплексообразователя в растворе гексацианоферрата(II) калия? + корень 7 степени Kнест. C / 6^6 По какой формуле рассчитывается рН слабых одноосновных кислот? +рН = ½ pKкисл.− ½ lgCкисл. По какой формуле рассчитывается рН раствора соли слабой одноосновной кислоты и сильного однокислотного основания? +рН = 7 − ½ pKкисл.− ½ lgCсоли По какой формуле вычисляется концентрация ионов лиганда в растворе гексагидроксоантимоната калия К[Sb(OH)6]? +корень 7 степени из 6Кнест.С Чему равно значение рН раствора цианистоводородной кислоты (рК=9,30) с концентрацией 0,001 моль/дм3? +6,15 Тест 3 Как называются методы анализа, основанные на измерении объема раствора реагента с точно известной концентрацией, затраченного на взаимодействие с определенным объемом раствора (или с точной навеской) определяемого вещества? +титриметрические В титриметрических методах анализа при расчете концентрации определяемого вещества в исследуемом растворе используется … +закон эквивалентов Какие из перечисленных химических соединений используются в качестве первичных стандартных веществ для установления точной концентрации кислот? +натрия карбонат, натрия тетраборат Какие индикаторы применяют в методе кислотно-основного титрования? +метиловый оранжевый, фенолфталеин Чему равен объем раствора серной кислоты с молярной концентрацией эквивалентов 0,2 моль/л, необходимый для нейтрализации 34 мл раствора гидроксида натрия c эквивалентной концентрацией 0,1 моль/л? Результат в миллилитрах нужно ввести в поле для ответа. +17,000 Чему равна масса гидроксида калия, содержащаяся в 10 л раствора (α = 1), значение pH которого 11? Результат в миллиграммах нужно ввести в поле для ответа +560,00 Чему равен объем 0,5М раствора NaOH, необходимый для нейтрализации раствора соляной кислоты, в котором содержится 73 мг HCl? Результат в миллилитрах нужно ввести в поле для ответа. +4 Какой метод анализа применяется при определении содержания хлороводорода в хлористоводородной кислоте разбавленной? +алкалиметрия Чему равен фактор эквивалентности тетрабората натрия при стандартизации раствора соляной кислоты? +1/2 Какие индикаторы используют в реакции Na2B4O7·10H2O + 2HCl → 4H3BO3 + 2NaCl + 5H2O при количественном определении натрия тетрабората? +метиловый оранжевый Водные растворы каких из перечисленных веществ имеют щелочную реакцию среды (вследствие гидролиза)? +натрия карбоната, натрия тетрабората Водные растворы каких из перечисленных веществ имеют кислую реакцию среды? +цинка сульфата, алюминия хлорида Какие из перечисленных веществ количественно определяют методом перманганатометрии? +натрия нитрита, железа(II) сульфата Чему равен фактор эквивалентности калия перманганата как окислителя в кислой среде? +1/5 Раствор натрия тиосульфата с эквивалентной концентрацией 0,1 моль/л применяют в качестве титранта при количественном определении … +раствора йода спиртового 5% Какие из перечисленных веществ проявляют свойства окислителя при взаимодействии с раствором калия йодида в кислой среде? +калия перманганат, калия дихромат, водорода пероксид Какими титриметрическими методами определяют общую жесткость воды в аналитических лабораториях? +комплексонометрическим Какие индикаторы применяют при определении карбонатной жесткости воды методом кислотно-основного титрования? +метиловый оранжевый Что такое Трилон Б? +двунатриевая соль этилендиаминтетрауксусной кислоты Чем обусловлена синяя окраска раствора в точке эквивалентности при определении магния сульфата методом комплексонометрического титрования? +формой ионизации свободного индикатора Какие титранты используются в методе комплексонометрического титрования? +раствор эдетата натрия Что из перечисленного необходимо для количественного определения магния сульфата методом комплексонометрического титрования? +аммиачный буферный раствор с рН 10,0, индикатор Эриохром черный Т Чему равна масса осадка, образующегося при сливании 10 мл 0,1М раствора Ba(NO3)2 и 40 мл 0,05М раствора K2CO3? мг +197 Чему равна масса осадка, образующегося при сливании 14 мл 0,5М раствора CaCl2 и 40 мл 0,1М раствора (NH4)2C2O4? мг +512 Чему равен объем раствора хлорида кальция c молярной концентрацией 0,1 моль/л, необходимый для осаждения карбонат-ионов из 200 мл раствора карбоната калия c эквивалентной концентрацией 0,05 моль/л?Результат в миллилитрах нужно ввести в поле для ответа. +50 Какие из перечисленных анионов не реагируют с перманганатом калия в кислой среде? +ацетат-ионы В каких рядах все анионы относятся к I аналитической группе анионов? +SO42– , CO32– , SO32– , РО43– Какие реагенты (из перечисленных) являются групповыми на анионы II аналитической группы? +нитрат серебра в разбавленной азотной кислоте Какие реагенты (из перечисленных) по кислотно-основной классификации катионов являются групповыми для ионов Ca2+, Sr2+, Ba2+ ? +H2SO4 Соединения какого ряда входят в состав бурого осадка, образующегося при действии группового реагента V группы на смесь катионов IV и V групп? +Zn(ОН)2 , МnO2•nH2O , BiOCl Какие из катионов VI аналитической группы присутствуют в растворе, если при действии раствора щелочи на реакционную смесь образовался осадок голубого цвета, который чернеет при нагревании? +Cu2+ Какие из катионов VI аналитической группы присутствуют в растворе, если при действии концентрированного раствора аммиака цвет исследуемого раствора становится ярко-синим? +Cu2+ Какими аналитическими эффектами сопровождается реакция обнаружения катионов калия с гидротартратом натрия? +образуется белый кристаллический осадок Какими аналитическими эффектами сопровождается реакция взаимодействия хлорида серебра с избытком раствора аммиака? +растворение осадка Какими аналитическими эффектами сопровождается реакция обнаружения фосфат-иона с нитратом серебра? +выпадает желтый осадок Соли каких катионов окрашивают пламя в желто-зеленый цвет? +Ва2+ Соли каких катионов окрашивают пламя в карминово-красный цвет? +Sг2+ Какие аналитические реакции на катионы свинца(II) (из перечисленных) являются специфическими? +реакция с йодидом калия ("золотой дождь") Какие реакции (из перечисленных) позволяют обнаружить анионы SO2−3 ? +с перманганатом калия в кислой среде, с хлоридом бария в кислой среде Какими реагентами (из перечисленных) можно обнаружить катионы Fe3+ ? +тиоцианат натрия, жёлтая кровяная соль В каких рядах все катионы образуют гидроксокомплексы? +Zn2+ , Sn2+ , Cr3+ Какими реагентами (из перечисленных) можно обнаружить катионы K+ ? +Na3[Co(NO2)6] Действием каких реагентов (из перечисленных) можно обнаружить присутствие ионов Fe2+ в растворе? +K3[Fe(CN)6] Чем обусловлена синяя окраска раствора в точке эквивалентности при определении магния сульфата методом комплексонометрического титрования? +формой ионизации свободного индикатора Какой метод анализа применяется при определении содержания хлороводорода в хлористоводородной кислоте разбавленной? +алкалиметрия Как называются методы анализа, основанные на измерении объема раствора реагента с точно известной концентрацией, затраченного на взаимодействие с определенным объемом раствора (или с точной навеской) определяемого вещества? +титриметрические Какие титранты (из перечисленных) используются в методе комплексонометрического титрования? +раствор эдетата натрия В титриметрических методах анализа при расчете концентрации определяемого вещества в исследуемом растворе используется … +закон эквивалентов Какие индикаторы используют в реакции Na2B4O7•10H2O + 2HCl → 4H3BO3 + 2NaCl + 5H2O при количественном определении натрия тетрабората? +метиловый оранжевый Какие индикаторы применяют при определении карбонатной жесткости воды методом кислотно-основного титрования? +метиловый оранжевый Чему равен фактор эквивалентности тетрабората натрия при стандартизации раствора соляной кислоты? +1/2 По какой формуле рассчитывается pH слабых одноосновных кислот? +pH = ½ pKкисл. − ½ lgCкисл. По какой формуле рассчитывается концентрация ионов Cd2+ в растворе комплексного соединения K2[CdI4] , если C – молярная концентрация раствора этого комплексного соединения, а β – его константа устойчивости? +C44β−−−√5 К раствору, который содержит катионы Ba2+, Sr2+, Ca2+, Ag+, в равных молярных концентрациях, постепенно приливают раствор серной кислоты. Какая из солей будет осаждаться в последнюю очередь в равновесных условиях, если ПР(BaSO4)=1,1×10-10 ПР(SrSO4)=3,2×10-7 ПР(CaSO4)=2,5×10-5 ПР(Ag2SO4)= 1,6×10-5 ? +CaSO4 Чему равен объем раствора серной кислоты с молярной концентрацией эквивалентов 0,1 моль/л, необходимый для нейтрализации 17 мл раствора гидроксида натрия c эквивалентной концентрацией 0,5 моль/л? +85 При титровании 0,1 моль/л раствора хлороводородной кислоты 0,1 моль/л раствором натрия гидроксида реакция среды в точке эквивалентности будет [нейтральной] При титровании 0,1 моль/л раствора уксусной кислоты 0,1 моль/л раствором натрия гидроксида реакция среды в точке эквивалентности будет [слабощелочной] При титровании 0,1 моль/л водного раствора аммиака 0,1 моль/л раствором соляной кислоты реакция среды в точке эквивалентности будет [слабокислой] Какая фундаментальная физическая постоянная является коэффициентом в выражении, связывающем энергию кванта электромагнитного излучения E с его частотой ν ? +постоянная Планка h Какой вид имеет выражение, связывающее энергию кванта электромагнитного излучения E с его частотой ν ? +E = hν Какая фундаментальная физическая постоянная является коэффициентом в выражении, связывающем длину волны электромагнитного излучения λ с его частотой ν ? + скорость света в вакууме c Какой вид имеет выражение, связывающее длину волны электромагнитного излучения λ с его частотой ν ? +λ = c/ν Единицей измерения частоты электромагнитного излучения является [герц] Чему равно произведение одного герца на одну секунду? +1 Длины волн электромагнитного излучения в фотометрическом анализе обычно выражают в [нанометрах] 100 нанометров – это ... +1000 ангстремов, 10–7 м Расположите виды электромагнитного излучения в порядке увеличения (слева направо) частоты [инфракрасное] [видимое] [ультрафиолетовое] [рентгеновское] [гамма‑излучение] Электромагнитный спектр – это зависимость ... +интенсивности электромагнитного излучения от его частоты, интенсивности электромагнитного излучения от его длины волны Электромагнитное излучение с одной длиной волны (или обладающее очень малым разбросом длин волн) – это [монохроматическое] излучение Атомы и молекулы (как квантовые объекты) могут иметь [только дискретный] энергетический спектр При переходе с нижележащего уровня энергии (E1) на вышележащий (E2) молекула [поглощает] квант электромагнитного излучения с энергией, равной [E2 – E1] Какие виды излучения инициируются переходами внешних (валентных) электронов? +ультрафиолетовое, видимое Вода при комнатной температуре является прозрачной бесцветной жидкостью. Это означает, что её молекулы [не поглощают] электромагнитное излучение в [видимой] области спектра Методы абсорбционной спектрофотометрии (спектроскопические методы анализа) основаны на … +избирательном поглощении электромагнитного излучения Что является аналитическим сигналом в фотометрических методах анализа? +оптическая плотность раствора Инфракрасные (ИК) спектры возникают за счет … +возбуждения колебаний ядер атомов в молекулах при поглощении квантов электромагнитного излучения Возникновение спектров поглощения в ультрафиолетовой и видимой областях объясняется … +способностью электронов на некоторых орбиталях поглощать кванты электромагнитного излучения и переходить на более высокие энергетические уровни Что из перечисленного используют в методе спектрофотометрии в видимой области спектра? +окрашенные растворы Оптическая плотность A (или D) – это ... +логарифм отношения интенсивности I0 падающего монохроматического потока излучения, к интенсивности I потока излучения, прошедшего через исследуемый объект Оптическая плотность [является безразмерной величиной] Электронный спектр поглощения – это зависимость ... +оптической плотности раствора от длины волны Диапазон длин волн электромагнитного излучения, который используется в фотометрическом анализе: от 200 до 1000-1100 нм. Нижняя граница этого диапазона (200 нм) лежит в [ультрафиолетовой] области электромагнитного спектра, а верхняя (1000 нм) – в [инфракрасной] Приборную базу фотометрического анализа составляют ... +спектрофотометры для работы в УФ-области спектра, спектрофотометры для работы в видимой области спектра, фотоколориметры Наиболее частыми причинами некорректных/нестабильных показаний спектрофотометра являются ... +пузырьки воздуха, наличие испытуемого раствора на внешних стенках кюветы, недостаточное количество раствора в кювете, конденсация, грязь, отпечатки пальцев на кювете Какие области спектра используются при определении содержания вещества методом фотоколориметрии? +видимая Какие характеристики химических веществ и процессов можно измерить с помощью метода колориметрии? +оптическую плотность УФ-спектрофотометрия и фотоколориметрия отличаются друг от друга по ... +используемой области оптического спектра Какие преимущества имеет спектрофотометрия по сравнению с фотоколориметрией? +обеспечивает более высокую чувствительность и точность определения Основной закон светопоглощения – это закон ... +Бугера-Ламберта-Бера Какие формулы являются правильными математическими выражениями основного закона светопоглощения? +I = I0⋅10−ελlCI = I0⋅10−ελlC , A =ελlCA =ελlC , lg(I0I) =ελlC В спектрофотометрии λmax – это ... +длина волны, при которой интенсивность поглощения достигает максимума Сколько полос с выраженными максимумами имеет спектр поглощения, который называют синглетным? +1 Сколько полос с выраженными максимумами имеет спектр поглощения, который называют дублетным? +2 Диапазон длин волн, границы которого отвечают половине максимальной величины свктопоглощения, называется [полушириной] полосы спектра поглощения [Гипсохромный] оптический эффект выражается в смещении максимума светопоглощения в коротковолновую область спектра [Гипохромный] оптический эффект выражается в понижении оптической плотности на длине волны максимума светопоглощения [Батохромный] оптический эффект выражается в смещении максимума светопоглощения в длинноволновую область спектра [Гиперхромный] оптический эффект выражается в повышении оптической плотности на длине волны максимума светопоглощения Длина оптического пути l – это ... +толщина поглощающего слоя, толщина кюветы Молярный коэффициент светопоглощения ελ – это оптическая плотность раствора с концентрацией [1 моль/л] , измеренная в кювете с длиной оптического пути [1 см] Какую размерность имеет молярный коэффициент поглощения ελ ? +л×моль–1×см–1 Величина молярного коэффициента светопоглощения ελ зависит от ... +природы поглощающего вещества, длины волны падающего электромагнитного излучения, температуры Какие условия являются необходимыми для выполнения основного закона светопоглощения в молекулярной спектроскопии? +поглощаемое излучение должно быть монохроматическим, толщина светопоглощающего слоя не должна превышать 5 см, температура и рН раствора должны быть постоянны, исследуемый раствор должен быть истинным, исследуемый раствор должен быть разбавленным Удельный показатель поглощения – это оптическая плотность [1%] раствора вещества в кювете с толщиной слоя [1 см] Градуировочный график в спектрофотометрии – это зависимость ... + оптической плотности эталонного раствора от концентрации Стандартные (эталонные) растворы для фотометрического анализа готовят ... +из фиксаналов (стандарт-титры), по навеске вещества на аналитических весах Какие методы определения концентрации используются в фотометрическом анализе? +метод градуировочного графика, метод сравнения, метод стандартных добавок Какие методы фотометрического анализа применяют при однократном анализе однокомпонентного раствора? +метод сравнения Какие методы определения концентрации используются для проведения серийных анализов при контроле технологических процессов? +метод градуировочного графика Какое уравнение используется для расчета концентрации в методе сравнения? +Cx = C0× Ax / A0 Что измеряют при подтверждении подлинности (идентификации) лекарственных веществ в методе спектрофотометрии в УФ-области? +зависимость величины оптической плотности от длины волны При количественном определении лекарственных веществ методом спектрофотометрии в УФ-области расчет содержания проводят по … + значениям оптических плотностей испытуемого и стандартного растворов Какие законы используются при спектрофотометрическом анализе смеси окрашенных компонентов? +закон аддитивности, основной закон светопоглощения Закон аддитивности оптической плотности для многокомпонентного раствора утверждает, что оптическая плотность раствора смеси равна … +сумме значений оптической плотности её компонентов Возможно ли одновременное фотоколориметрическое определение двух компонентов при их совместном присутствии в растворе? +возможно при соблюдении основного закона светопоглощения для каждого из компонентов, возможно, если полосы поглощения компонентов находятся в разных областях видимого спектра или перекрываются только частично Возможно ли одновременное фотометрическое определение двух компонентов при их совместном присутствии в смеси, если полосы поглощения этих компонентов в спектре полностью перекрываются? +невозможно В каких случаях используется правило аддитивности оптической плотности? +когда в любой области спектра одновременно свет поглощают несколько компонентов и необходимо определить концентрацию каждого из них Как концентрация веществ повлияет на вид электронного спектра поглощения, если в системе образуется одно окрашенное соединение при сливании двух неокрашенных компонентов? + никак, может измениться полуширина полосы светопоглощения Что является критерием оценки чувствительности фотометрических измерений? +величина молярного коэффициента поглощения Фотометрической реакцией называется реакция, при которой происходит образование ... +окрашенного растворимого соединения Какие требования предъявляются к цветным реакциям в фотометрическом анализе? +высокая скорость, избирательность, необратимость, стабильность окраски аналитической формы во времени, устойчивость окраски аналитической формы к световому воздействию Оптическая плотность (A или D) изменяется от [0] до [+∞] Светопропускание (T) изменяется от [0] до [1] Если исследуемый раствор не поглощает свет, то оптическая плотность А = [0] и светопропускание Т = [1] Если исследуемый раствор полностью поглощает свет, то оптическая плотность А = [+∞] и светопропускание Т = [0] Чему равна величина светопоглощения 10–4 М раствора в кювете с толщиной поглощающего слоя 1 см, если ελ= 104 ? +1 Если logab = c , то ... +ac = b Если b ≠ c , то blogbc = ... +c Рассчитайте значение величины молярного коэффициента светопоглощения калия дихромата, если значение оптической плотности раствора калия дихромата, измеренное на спектрофотометре в кювете с длиной оптического пути 5 мм, равно 0,501, а анализируемый раствор приготовлен разбавлением стандартизированного раствора калия дихромата с эквивалентной концентрацией 0,1 моль/л в 50 раз. +1002,00 |
