Белки. Коллоквиум БЕЛКИ. Коллоквиум 1 по Биохимии 1
 Скачать 2.14 Mb. Скачать 2.14 Mb.
|
|
Коллоквиум № 1 по Биохимии 1 вариант 1. На рисунке представлена схема белка, состоящего из одной полипептидной цепи и имеющего активный центр, а также структуры 4-х лигандов. 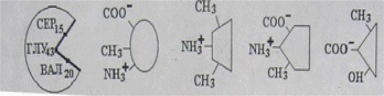 Выберите из 4-х представленных лигандов один, который с наибольшей вероятностью будет взаимодействовать с активным центром белка. Для этого: а) напишите формулы аминокислот, входящих в состав активного центра. б) объясните, чем обусловлена специфичность связывания белка с лигандом; в) какие связи возникают между выбранным вами лигандом и активным центром. в) дайте определение, что такое «активный центр» белка и объясните, на каком уровне структурной организации он формируется? Какую роль играет активный центр в функционировании белка. Какое значение имеет первичная структура белка в формировании активного центра. Приведите примеры влияния первичной структуры на активность белков. 2. Концентрация 2,3 бисфосфоглицерата в эритроцитах при хранении консервированной крови может уменьшаться с 8,0 до 0,5 ммоль/л. Можно ли переливать такую кровь тяжело больным людям, если концентрация 2,3 бисфосфоглицерата восстанавливается не ранее чем через 3 суток? Для ответа поясните: а) что такое 2,3 бисфосфоглицерат и где он синтезируется; б) когда и на каком участке он присоединяется к гемоглобину в) какую роль играет 2,3 бисфосфоглицерат в регуляции сродства гемоглобина к О2? 3. В процессе переваривания белков в кишечнике участвует панкреатический протеолитический фермент трипсин, который разрушает пептидные связи, образованные карбоксильной группой лизина или аргинина. а) напишите реакцию, катализируемую трипсином, и назовите класс фермента; б) рассчитайте удельную активность трипсина, если 0,05 мг фермента за 15 мин, гидролизует белки с образованием 100 мкмоль олигопептидов при оптимальных условиях инкубации: рН=8,0 и 37. в) нарисуйте график зависимости скорости реакции от рН среды для трипсина и объясните, как и почему изменится его активность при снижении рН до 3,0; г) объясните, почему изменится активность трипсина при введении трасилола (контрикала или гордокса)? Назовите, к какому виду ингибиторов относятся препараты этой группы - (учитывая их пептидную природу), каков механизм их действия и как они используются в медицине? 4. Пепсиноген (неактивная форма фермента), образующийся в главных клетках желудка, имеет молекулярную массу 42000. В желудочном соке пепсиноген превращается в активный фермент: пепсин, при этом его молекулярная масса уменьшается до 35000. а) назовите вид регуляции активности пепсина; б) объясните причину увеличения активности фермента, нарисовав соответствующую схему; в) укажите, какие уровни структурной организации белка изменяются при активации пепсина. 5. Рассмотрите схему последовательного окисления глюкозы до СО2 и Н2О; Е1 Е2 Е3 Е4 Еn Глк-бф <----->Р1 ------> Р2 <-----> Рэ <-----> Р4..... CO2+H2O+АТФ Основное значение этого процесса - синтез АТФ. Однако при избытке АТФ скорость окисления глюкозы снижается. а) какой из ферментов может быть регуляторным в указанной цепи реакций? б) как называется цепь взаимосвязанных реакций, приводящих к образованию конечного продукта? в) нарисуйте схематическое изображение регуляторного фермента, перечислите его структурно-функциональные особенности. С какими лигандами он может взаимодействовать? Укажите, какой из продуктов реакций может быть ингибитором метаболического пути г) как называется такой вид регуляции активности? 6. Аспарагиназа - фермент, использующийся при лечении некоторых видов лейкозов. Она катализирует реакцию расщепления аспарагина на аспарагиновую кислоту и аммиак. Объясните механизм ее лекарственного действия. Для этого: а) напишите формулами реакцию, катализируемую аспарагиназой в клетках; б) назовите, к какому классу ферментов она относится; в)объясните, почему этот фермент, введенный в кровь, оказывает губительное действие только на злокачественные клетки и не нарушает метаболизм здоровых лейкоцитов. Коллоквиум № 1 по Биохимии 2 вариант 1. На рисунке представлено схематическое изображение белка и структуры различных лигандов. 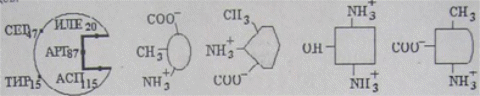 Выберите из 4-х представленных лигандов один, который с наибольшей вероятностью будет взаимодействовать с активным центром белка. Для этого: а) напишите формулы аминокислот, входящих в состав активного центра. б) объясните, чем обусловлена специфичность связывания белка с лигандом; в) какие связи возникают между выбранным вами лигандом и активным центром. г) что такое «информационная лабильность» белка, и какую роль она играет в функционировании белков? 2. В результате мутаций в гене а цепи гемоглобина А вместо Гис, входящего в состав активного центра, находится тирозин. Это приводит к тому, что Fe+2 окисляется до Fe+3. Какова причина развития гемоглобинопатии при данном наследственном заболевании? Для ответа на вопрос объясните: а) как называется такая форма Нв? б) каково строение активного центра Нв и какую роль играют остатки Гис, входящие в состав активного центра, в функционировании Нв? в) сколько молекул О2 способен переносить в ткани мутантный гемоглобин? 3. 5 мг лактатдегидрогеназы за 30 мин катализируют превращение пирувата с образованием 20 мкмолей лактата при оптимальных условиях (37 °С и рН=6,2}: CH3-CO-COOH <----> CH3 - СНОН-СООН Пируват Лактат а) рассчитайте удельную активность фермента, укажите единицы измерения; б) назовите, к какому классу и подклассу откосится данный фермент; в) назовите витамин и кофермент, участвующий в работе лактатдегидрогеназы. г) нарисуйте график зависимости скорости реакции от рН, объясните, как изменится активность фермента при рН=10 и почему? д) нарисуйте график зависимости скорости ферментативной реакции от концентрации субстрата, объясните его кинетику. Что такое Км и какое значение имеет определение этой константы? 4. У мужчины, который использовал инсектицид хлорофос для уничтожения колорадского жука на листьях картофеля, появились признаки отравления: головная боль, тошнота галлюцинации. Известно, что хлорофос является фосфоорганическим соединением. Опишите механизм его действия и объясните, почёму хлорофос токсичен. а) активность каких ферментов и как изменяется при отравлении этим инсектицидом? б) напишите реакции, скорость которых изменяет хлорофос. 5. В метаболической цепи реакция, катализируемая ферментом Е1 протекает с наименьшей скоростью E1 Е2 Е3 Е4 Е5 Еn S1 + S2 P1 P2 P3 P4 P5... Pn а) назовите, какой фермент может быть регуляторным в указанном цепи реакции. Обоснуйте ответ; б) нарисуйте схематическое изображение регуляторного фермента; в) обозначьте центры связывания этого фермента, укажите, с какими лигандами он может взаимодействовать; какой из продуктов реакции может служить ингибитором метаболического пути и как называется механизм его действия; г) как называется такой вид регуляции активности ферментов? 6. Пациента с жалобами на боль в груди в течение трех дней госпитализировали с подозрением на инфаркт миокарда. Результаты биохимического анализа крови подтвердил диагноз. Опишите метод энзимодиагностики и объясните: а) какие особенности состава и распределения ферментов лежат в основе энзимодиагностики; б) активность каких ферментов и как изменилась в крови пациента, если диагноз подтвердился? Коллоквиум № 1 по Биохимии 3 Вариант 1. На рисунке дана схема строения фермента, имеющего активный и регуляторный центры.  Выберите из представленных лигандов один, который с наибольшей вероятностью будет взаимодействовать с регуляторным центром. Для этого: а) объясните, что такое активный и аллостерический центры белка и какова их функция; б) напишите формулы аминокислот, входящих в состав регуляторного центра. в) чем обусловлена специфичность связывания белка с лигандом? г) укажите типы связей, возникающие между лигандом и регуляторным центром г) объясните, почему при взаимодействии с лигандом-регулятором изменяется ферментативная активность белка, назовите этот вид регуляции: 2. Кислород необходим клеткам для процессов окисления веществ и получения энергии. Недостаток О2 в тканях также как и его избыток губителен для тканей. Каким образом регулируется количество О2доставляемого в ткани в точном соответствии с клеточными потребностями? При ответе объясните; а) что такое эффект Бора, как связан этот эффект с метаболической активностью тканей? б) как измениться количество кислорода, доставляемого в ткани при изменении рН среды в основную сторону? 3. Ацетилхолинэстераза /АХЭ/ при оптимальных условиях (рН=8,4 и 37 °С) в течение 15 мин катализирует гидролиз ацетилхолина с образованием 9.0 ммоль холина. а) напишите схему реакции, катализируемой АХЭ. укажите класс фермента: б)рассчитайте активность фермента: в) нарисуйте график зависимости скорости ферментативной реакции от рН среды и объясните изменение активности фермента при рН=4,0: г) объясните, какую роль играет АХЭ в функционировании холинэргических синапсов; д) укажите, как изменится активность фермента и количество субстрата при добавлении в раствор прозерина. Объясните механизм его действия. При каком заболевании используется этот лекарственный препарат? 4. ТАГ-липаза, гидролизующая жиры в жировой ткани, может находиться в 2-х формах с различной активностью: фосфорилированной (активной) и дефосфорилированной (неактивной). Объясните, почему переход от одной формы к другой сопровождается изменением активности. Для этого: а) нарисуйте схему этого вида регуляции активности фермента; б) назовите радикалы аминокислот, которые могут присоединять остаток фосфорной кислоты в) укажите, какие ферменты осуществляют фосфорилирование и дефосфорилирование белков г) почему переход от одной формы к другой сопровождается изменением активности фермента 5. Гем синтезируется в клетках печени и костного мозга в результате серии последовательных реакций: Е1 E2 Ез Е4 En Глицин + Сукцинил-КоА P1Р2 P3 Р4... Гемм При повышении концентрации гема и гемоглобина синтез его прекращается. Объясните, как регулируется скорость процесса, для этого: а) укажите, как называется цепь взаимосвязанных реакций, приводящих к образованию конечного продукта; б) перечислите признаки регуляторных реакций и назовите, какие ферменты являются регуляторными в данной цепи реакций; в) нарисуйте их схематическое строение, перечислите структурно-функциональные особенности; г) укажите лиганды, которые могут взаимодействовать с соответствующими центрами; д) назовите вид регуляции активности фермента. 6. Дитилин, структурная формула которого приводится ниже, используется в качестве миорелаксанта для расслабления скелетных мышц на время операции. На чем основан механизм лекарственного действия препарата? При ответе объясните: а) как проводится импульс через нервно-мышечный синапс? б) какое вещество используется в качестве нейромедиатора в данном типе синапсов? в) каков механизм действия препарата, если сравнить строение дитилина и нейромедиатора? Коллоквиум № 1 по Биохимии 4 вариант 1. На рисунке схематически изображены 4 протомера. из которых один содержит активный центр, три других являются вариантами регуляторных протомеров, содержащих центр связывания с лигандом-регулятором.  Определите, какой из представленных регуляторных протомеров может объединится с каталитическим протомером. Для этого: а) дайте определение понятиям «четвертичная структура белка», «протомер», «олигомерный белок»; б) объясните, чем обусловлено взаимное узнавание протомеров; в)напишите структуры аминокислот и назовите типы связей, возникающие между протомерами; г) объясните, почему при взаимодействии лиганда-регулятора с регуляторной субъединицей происходит изменение функциональной активности белка. 2. В крови студента одной из африканских стран, поступившего в больницу по поводу одышки головокружения, учащенного сердцебиения и болей в конечностях, при анализе крови были найдены эритроциты, имеющие форму серпа. Объясните причину развития данного заболевания. Для ответа на этот вопрос объясните: а) какое строение имеет гемоглобин А? б) какие изменения в структуре гемоглобина привели к образованию патологической формы гемоглобина? в) как называется такая форма гемоглобина? г) почему изменяется форма и функция эритроцитов? 3. Несколько лет назад в токийском метро террористы распылили одно из самых сильных отравляющих веществ - зарин, относящийся к группе органических фторфосфатов. Многие пассажиры потеряли сознание, некоторые умерли в результате остановки дыхания. На чем основано нервно-паралитическое действие зарина? Для ответа на вопрос объясните: а) с какими ферментами взаимодействуют органические фторфосфаты, опишите особенности строения их активного центра б) с какой аминокислотой активного центра взаимодействуют органические фторфосфаты и обратимо ли это взаимодействие? в) напишите реакцию, снижение скорости которой приводит к остановке дыхания? 4. 5 мг пепсина при оптимальных условиях (pH=1,5, 37°С) в течение 10 минут катализирует переваривание белков с образованием 500 мкмоль фенилаланина. а) напишите реакцию, катализируемую пепсином, если известно, что он гидролизует преимущественно пептидные связи, образованные циклическими аминокислотами. К какому классу ферментов он относится? б) рассчитайте удельную активность фермента. в) нарисуйте график зависимости скорости реакции от рН для пепсина, объясните изменение скорости реакции при различных значениях рН г) нарисуйте график зависимости скорости ферментативной реакции от температуры и объясните его кинетику. д) объясните, можно ли использовать этот протеолитический фермент в качестве лекарств- венного средства при обработке гнойных ран? 5. Гликогенсинтетаза (фермент, участвующий в синтезе гликогена) может находиться в двух формах с различной активностью: в виде простого белка (активная форма) и в виде фосфопротеина (неактивная форма). Объясните, почему переход от одной формы к другой сопровождается изменением активности. Для этого: а) нарисуйте схему этого вида регуляции активности фермента; б) назовите, радикалы аминокислот, которые могут присоединять остаток фосфорной кислоты в) перечислите, какие ферменты осуществляют фосфорилирование и дефосфорилирование белков? г) назовите, к каким классам относятся эти ферменты. 6. При инфаркте миокарда в сыворотке крови больных изменяется активность фермента лактатдегидрогеназы (ЛДГ), которая поступает из поврежденных клеток сердечной мышцы. Обоснуйте справедливость применения данного метода диагностики, для чего: а) напишите реакцию, катализируемую ЛДГ; б) назовите кофермент ЛДГ, напишите формулу витамина, входящего в его состав в) опишите строение коферментов ЛДГ. особенности распределения их в тканях г) объясните, что такое «органослецифичность» ферментов. Ответы на коллоквиум № 1 по Биохимии Вариант 1 а) Сер → -CH2-OH Глу → -(CH2)-COO- Вал → -CH(CH3)2 б) Специфичность связана с: 1 - пространственные соответствия. 2 - химическое соответствие (возникают нековалентные - ионные, водородные, гидрофобные и ковалентные связи)  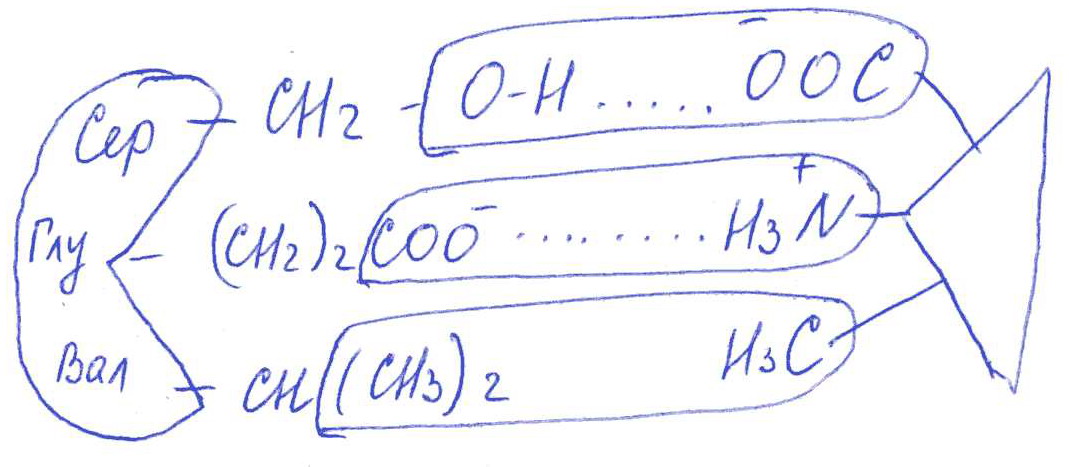 в) Выбираем лиганд: г) Активный центр - определенный участок белковой молекулы, как правило, находящейся в ее углублении, сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способной комплементарно связываться с лигандом. Формируется на уровне третичной структуры и отвечает за взаимодействие с лигандом. Первичная структура определяет, какая будет третичная структура, а, следовательно, и активный центр. Если заменить хотя бы одну аминокислоту в первичной структуре гемоглобина, как, например, замена Глу на Вал развивается серповидноклеточная анемия. а 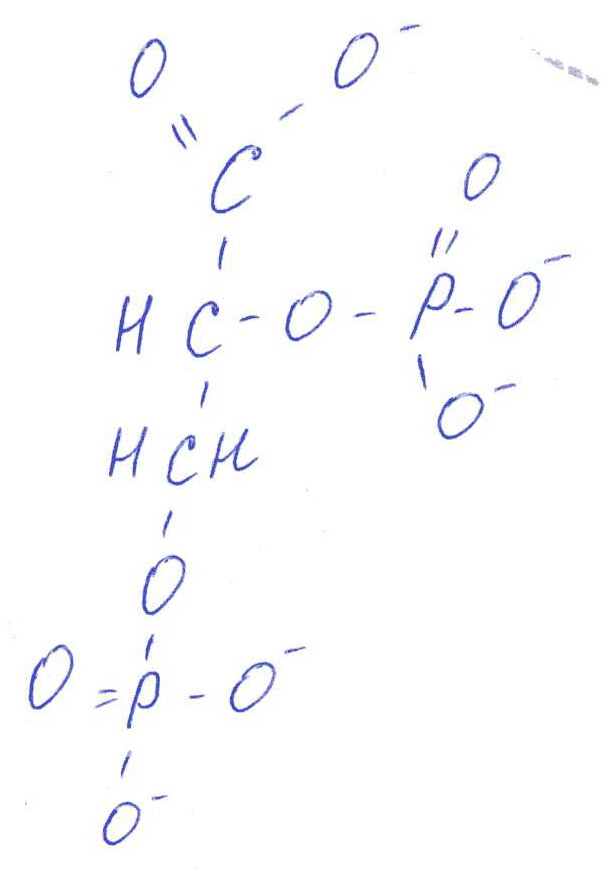 ) 2,3-БФГ синтезируется в эритроцитах из промежуточного продукта окисления глюкозы-1,3-БФГ. В нормальных условиях БФГ присутствует в эритроцитах в довольно высоких концентрациях. ) 2,3-БФГ синтезируется в эритроцитах из промежуточного продукта окисления глюкозы-1,3-БФГ. В нормальных условиях БФГ присутствует в эритроцитах в довольно высоких концентрациях.б) Присоединяется к дезоксигемоглобину в центральной полости, образованной аминокислотными остатками всех 4-х протомеров. При отщеплении кислорода от гемоглобина, сродство БФГ к аллостерическому центру увеличивается. Он стабилизирует дезоксигемоглобин. в) Присоединяясь к дезоксигемоглобину, снижает сродство к кислороду, увеличивается эффективность отдачи кислорода в тканях и присоединения его в легких. В консервированной крови, где резко упала концентрация БФГ, гемоглобин имеет очень высокое сродство к кислороду. Он будет плохо отдавать его в тканях, вызывая кислородное голодание, что очень опасно для ослабленных людей. 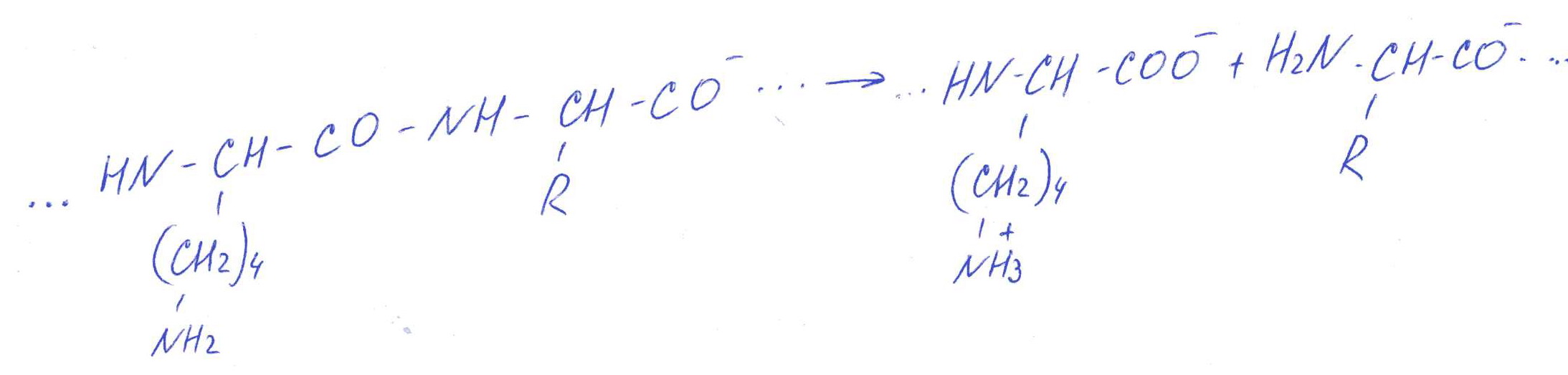  а) Трипсин - сериновая протеаза. Класс – гидролазы. б) Удельная активность = 100мкмоль/15мин * 0.5 мг = 133,33 мкмоль/мг*мин 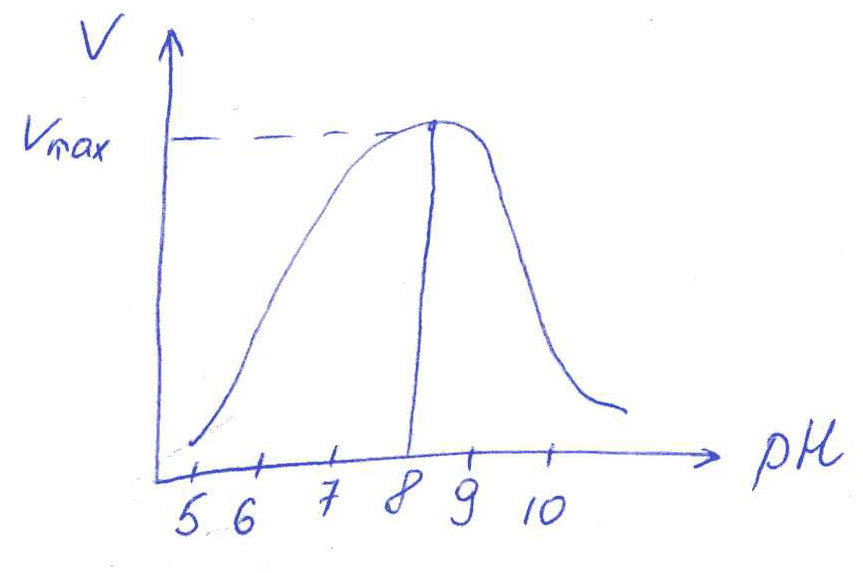 в) При рН = 3 произойдет изменение конформации трипсина и снижение комплементарности активного центра субстрата из-за протонирования остатков АК в его третичной структуре. г) Трасилол – структурный аналог субстратов (белков), чьи превращения катализирует трипсин. Конкурентный ингибитор трипсина Предотвращает активацию трипсина в поджелудочной железе и её самопереваривание при панкреатитах. а) Частный протеолиз. ( 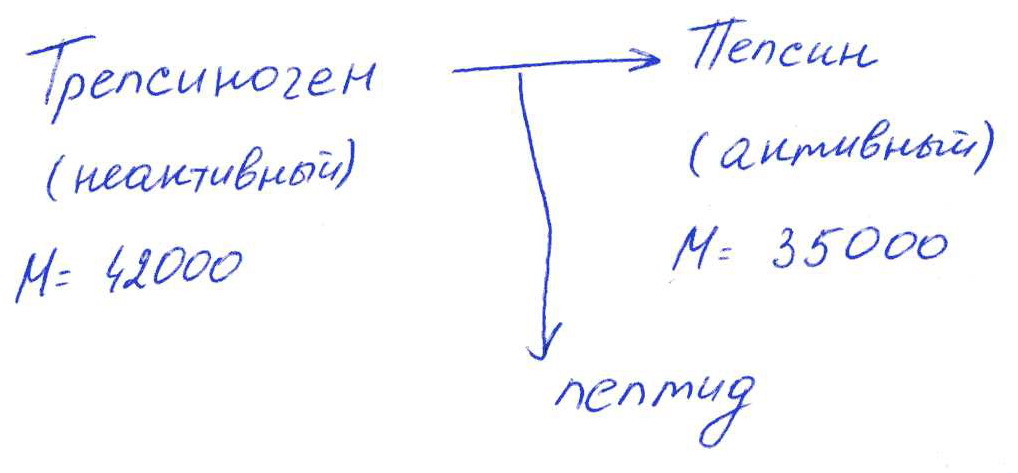 Трепсин, а не Пепсин – исправьте.) Трепсин, а не Пепсин – исправьте.)б) в) Изменяется первичная структура. Это необратимая активация. а) Е2, потому что необратимая реакция. б) Метаболический путь. 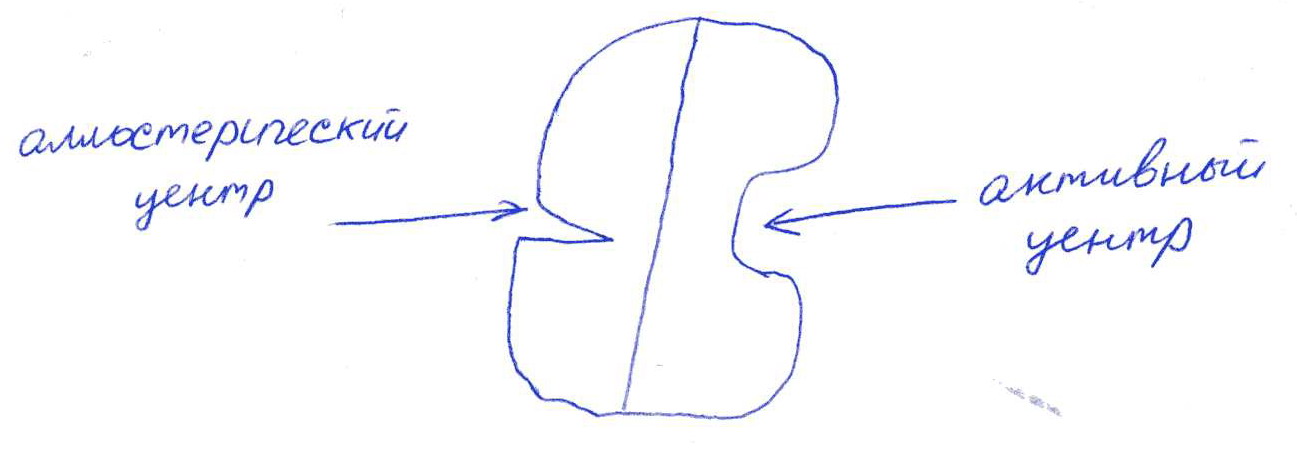 в) Е2 взаимодействует в активном центре с B1, в аллостерическом - с АТФ. г) Аллостерическая регуляция.  а) б) Гидролаза. в) Лейкозные клетки не могут синтезировать аспарагин. Они берут его из крови. Если его в крови превратить в аспарагиновую кислоту, то лейкозные клетки погибнут из-за нарушения метаболизма. Ответы на коллоквиум № 1 по Биохимии Вариант 2 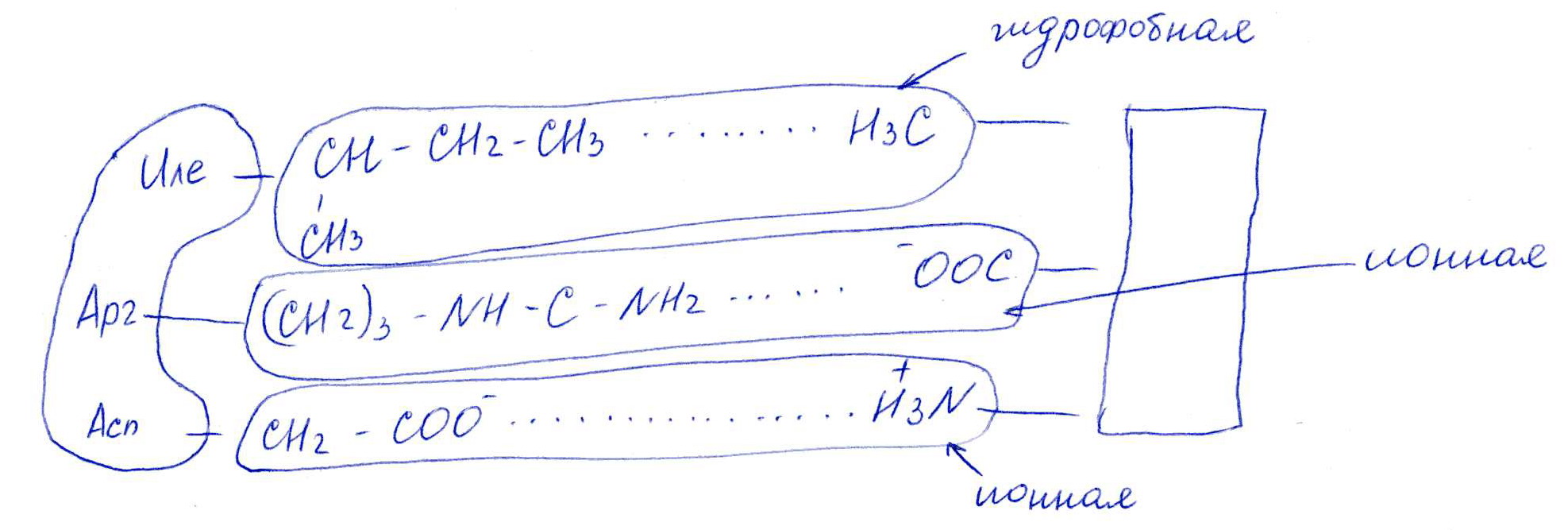 а) б) Пространственной и химической комплементарностью. в) Гидрофобные, ионные. г) Конформационная лабильность - подвижность третичной структуры белка, что обеспечивает кооперативные изменения и более полные взаимодействия с лигандами. а) Метгемоглобин Нb-М. б) Гис Е7 и Гис F8 участвует в стабилизации Fe2+ Hb в) 2 молекулы кислорода из-за присоединения воды. а) Удельная активность = 20мкмоль/30мин * 5 мг = 0,1333 мкмоль/мг*мин б) Оксидоредуктаза, дегидрогеназа. в) НАД, НАДФ, Витамин РР (никотинамид). а) Ферментов, имеющих Сер в активном центре наиболее опасно ингибирование ацетилхолинэстеразы 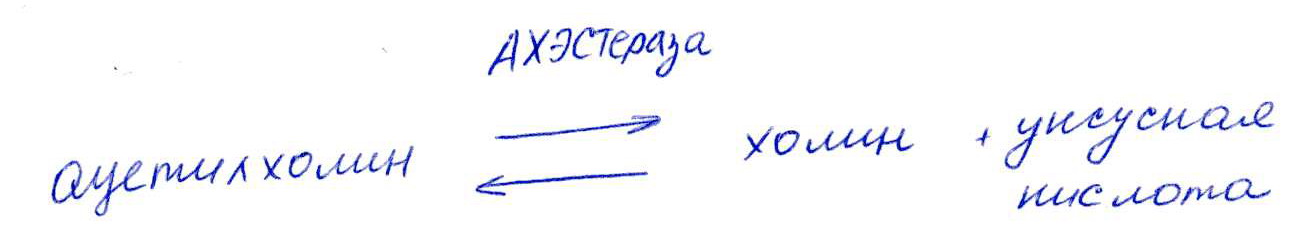 б) а) Е1, так как регулируются те ферменты в активном центре, которые катализируют необратимые, наиболее медленные, начальные и ключевые реакции. б) Метаболический путь.  в) Е1 взаимодействует в активном центре с S1 или S2, в аллостерическом - с Pn. г) Аллостерическая регуляция. а) Существуют органоспецифические ферменты. Повышение их уровня в крови говорит о разрушении ткани. б) ЛДГ, КК, АСТ. Через 3 дня после инфаркта в крови будут повышены АСТ И ЛДГ, КК повышена в первые сутки. Ответы на коллоквиум № 1 по Биохимии Вариант 3 а) Активный центр - связывание субстрата. Аллостерический - регулирование активности фермента. б 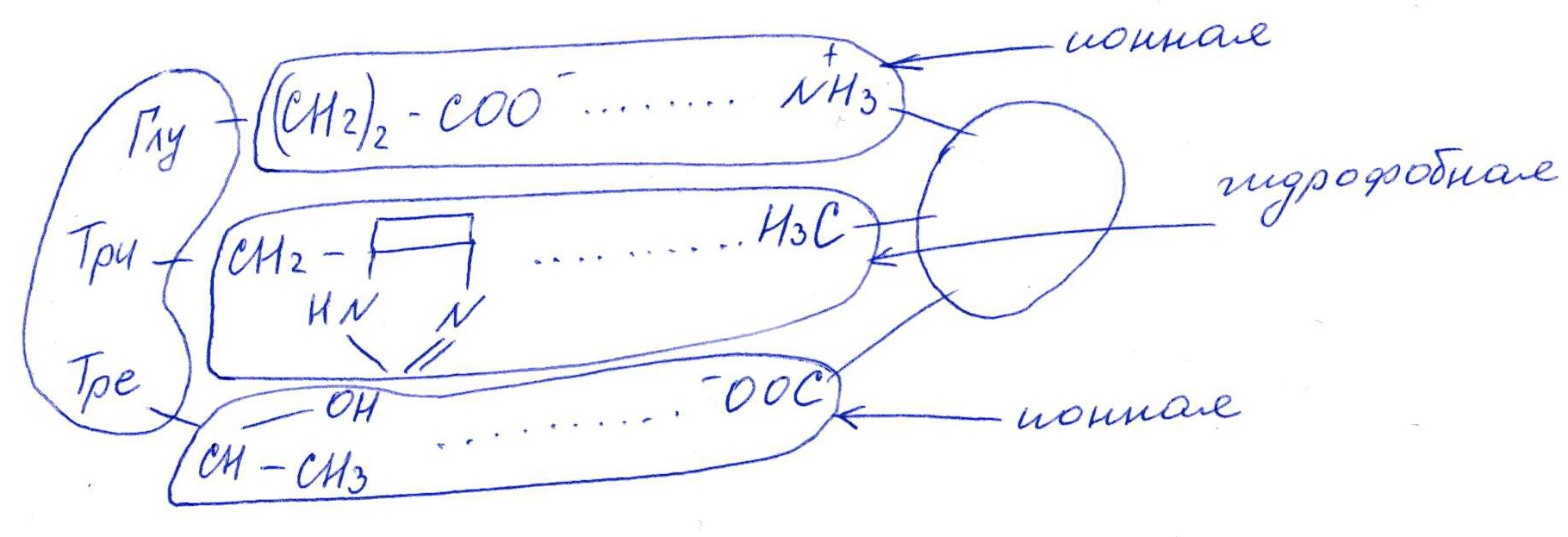 ) ) в) Пространственной и химической комплементарностью. г) Ионная и гидрофобная. д) Взаимодействие с аллостерическим центром приводит к кооперативным изменениям конформации ИК, и изменениям конформации активного центра, в результате чего снижается сродство активного центра к субстрату и активность фермента. Это аллостерическая регуляция. а б) Уменьшается. а) 9ммоль * 1000/15 мин = 600 мкмоль/мин  б) в 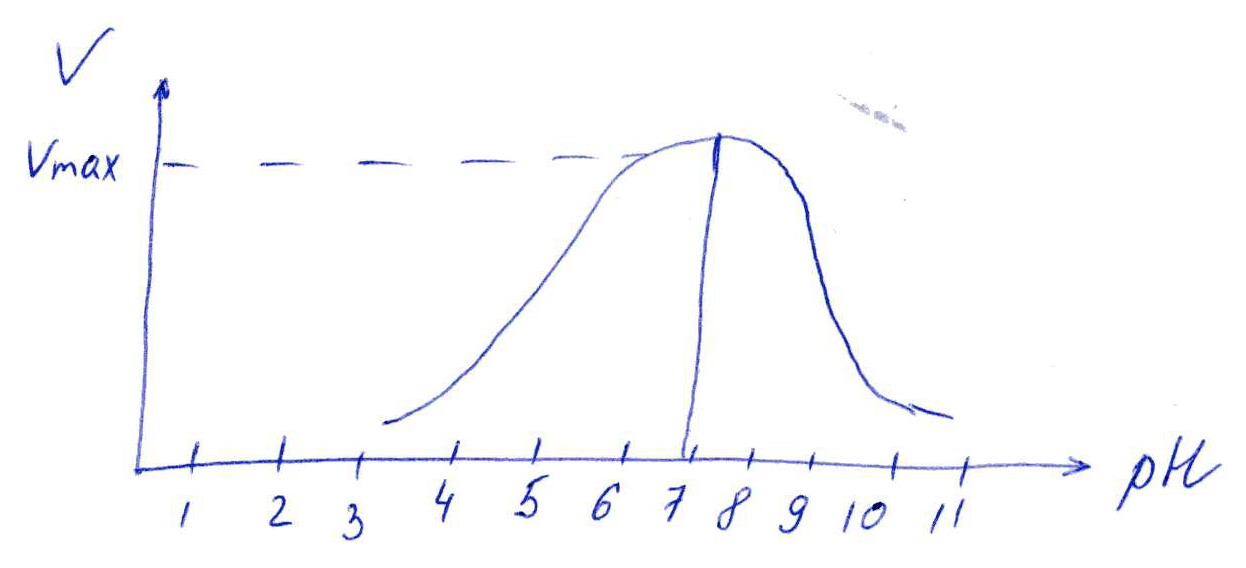 ) ) Протонирование при Рн=4. Произойдет изменение конформации фермента и снижение комплементарной активности центра субстрата из-за протонирования остатков АК в его третичной структуре. г) АХЭ разрушает АХ в постсинаптической мембране, чтобы наступила реполяризация. Д) Уменьшится активность фермента. Количество АХ увеличится. Прозерин – конкурентный ингибитор АХ-азы. Используется при миастении. 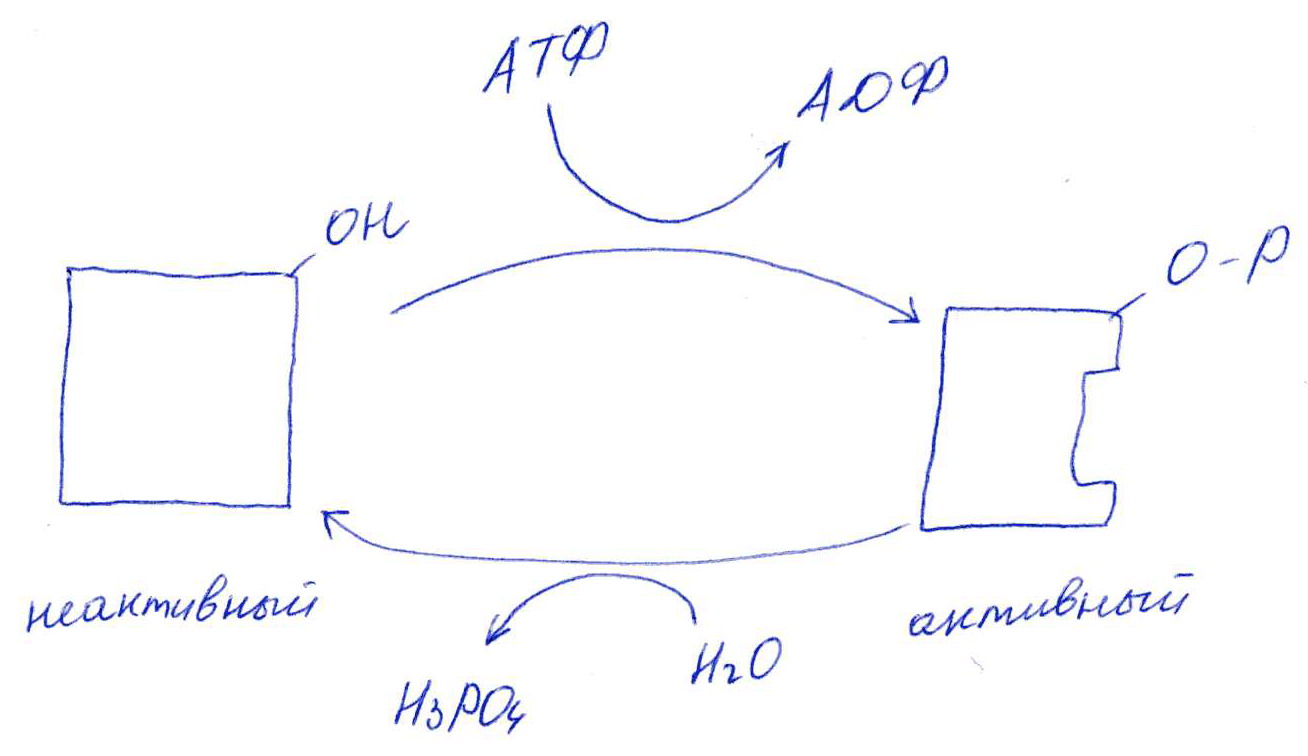 а) б) Серин, Треонин, Тирозин - то есть те, которые содержат ОН в своём радикале. в) Киназа фосфорилирует Трансфераза. Фосфотаза дефосфорилируют Гидролаза. г) Фосфорилирование изменяет конформацию, в том числе активного центра. а) Метаболический путь. б) Наиболее медленная реакция, необратимая реакция, начальная реакция. Место разветвления метаболического пути. Е1 взаимодействует в активном центре с P1, в аллостерическом - с геном.  в) Аллостерическая регуляция. а) Выделяется АХ, он взаимодействует с постсинаптической мембраной, вызывая деполяризацию (открытие Na каналов). б) АХ. в) Оптимум и АХ структурные аналоги. Это конкурентное обратимое ингибирование. Ответы на коллоквиум № 1 по Биохимии Вариант 4 а) Четвертичная структура - количество и взаиморасположение полипептидных цепей. Протомер - отдельная полипептидная цепь в таких белках. Олигомерный белок - белок, содержащий несколько протомеров. б) Взаимное узнавание основано на пространственной и химической комплементарности. 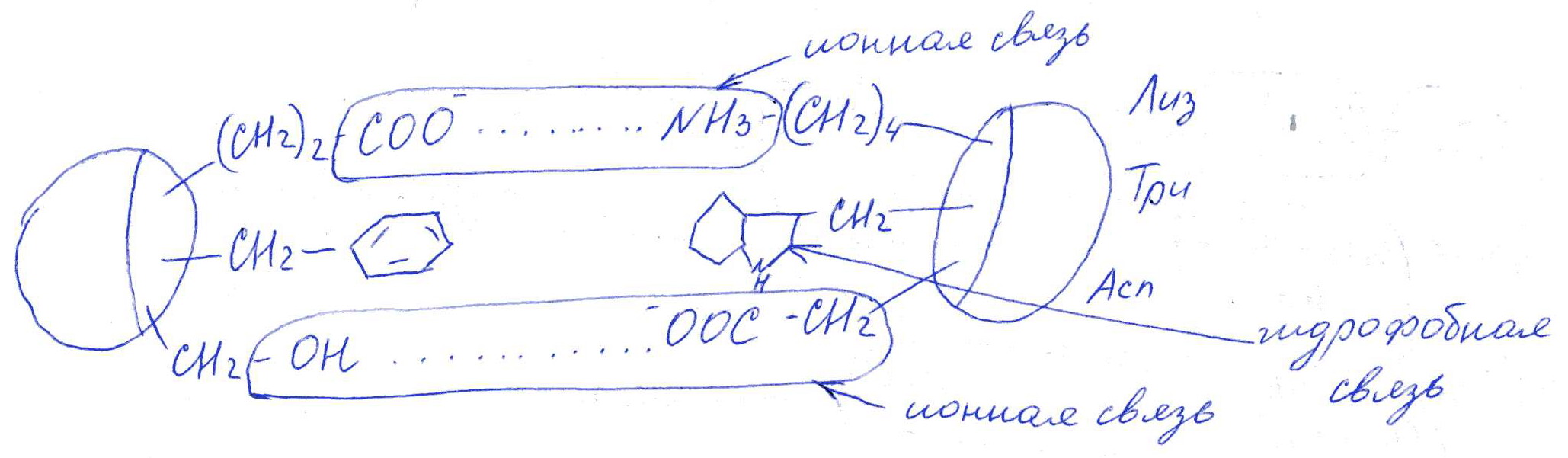 в) г) Происходят корпоративные конформационные изменения, в ходе которых меняется конформация активного центра, снижается комплементарность активного центра к субстрату и активность фермента. а) HbA = 2x и 2/3 цепи 4 молекула гема. Каждая цепь имеет участки связывания с гемом и с тремя другими протомерами. б) Замена Глу на Вал в 6 положении в цепи. в) Hb-S. г) слипание цепей, деформирование эритроцитов, плохое их прохождение через капилляры, гипоксия тканей. а) В активном центре таких ферментов есть ОН содержащие аминокислоты – Сер, Тре, Тир. С ним связывается ковалентно фторфосфат. б) С Серином. Необратимое. в  а) б) Удельная активность = 500мкмоль/10мин * 5 мг = 10 мкмоль/мг*мин в) 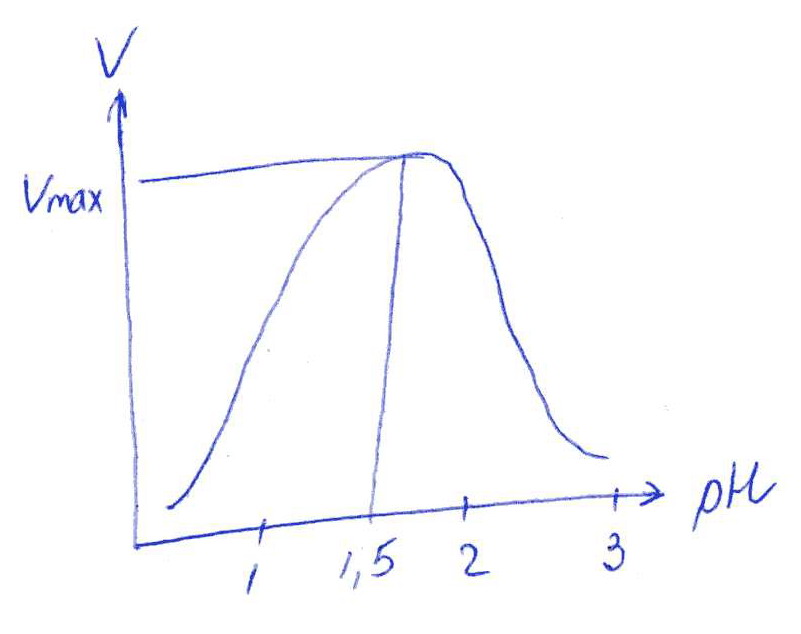 Изменение pH приводит к ионизации тех или иных групп, что вызывает конформационное изменение и снижение сродства к субстрату. г) 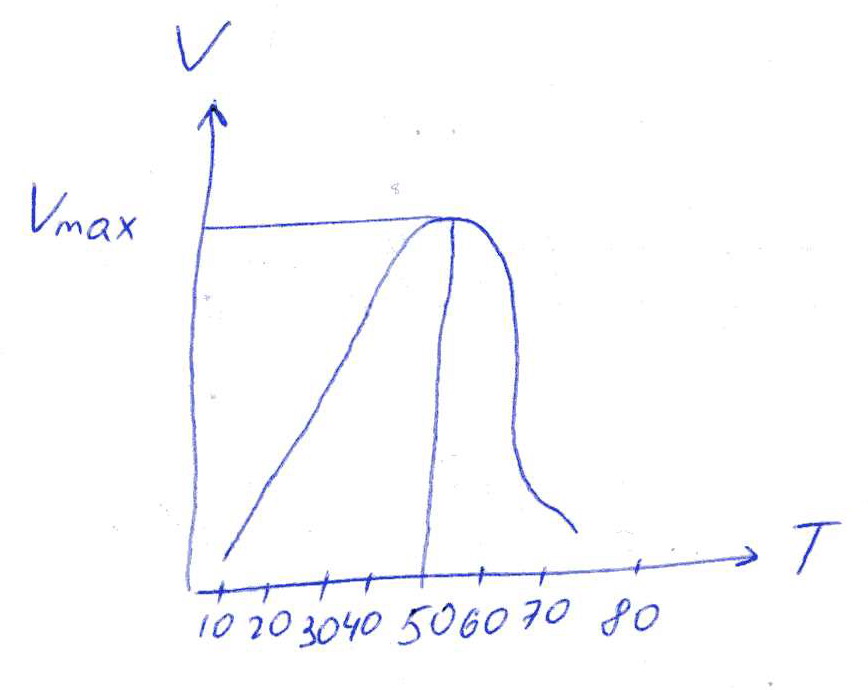 Оптимум – 50-60˚ С. Далее – денатурация. До 50-60 – низкая активность д) Вряд ли, поскольку нужна очень кислая среда (pH = 1.5) для эффективного действия. Проще Трипсин (pH=8.0) а)  б) Серин, Треонин, Тиризин - то есть те, которые содержат ОН в своём радикале. в) Киназа фосфорилирует. Трансфераза. Фосфотаза дефосфорилируют. Гидролаза. г) Фосфорилирование изменяет конформацию, в том числе активного центра. 6 б) Кофермент НАД. в) Изоферменты ЛДГ: ЛДГ1-5. Субъединица М и Н. ЛДГ1 + ЛДГ2 – сердце, почки. ЛДГ3 – почки. ЛДГ4, 5 – печень, мышцы. г) Органоспецифичность – встречаемость фермента только в данной ткани (органе) или в большом количестве только в этом органе (ткани). |
