Химия 1-ый курс КР вариант 17. Контрольная работа по химии 1 Вариант 17 14 Из 35 г оксида металла получается 15 г его нитрата. Вычислите эквивалентную массу его металла
 Скачать 91.5 Kb. Скачать 91.5 Kb.
|
|
УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИНФОРМАТИКИ И РАДИОЭЛЕКТРОНИКИ Факультет непрерывного и дистанционного обучения Специальность: Информационные технологии и управление в технических системах КОНТРОЛЬНАЯ РАБОТА ПО ХИМИИ №1 Вариант № 17 №14 Из 1.35 г оксида металла получается 3.15 г его нитрата. Вычислите эквивалентную массу его металла. Решение: Эквиваленты соли и оксида металла можно расписать: MЭ(MeOn) = MЭ(Me) + 8; MЭ(Me(NO3)n) = MЭ(Me)+ MЭ(NO3); Тогда в соответствии с законом эквивалентов: Выразим из этого уравнения MЭ(Me): Ответ: 32.5 г/моль.(цинк) № 32 Запишите электронные формулы элементов с порядковыми номерами 17 и 25. К каким семействам элементов они относятся и почему? Объясните сходство и различие в их свойствах. Элементом с порядковым номером 17 является хлор. Рассмотрим атом хлора: Электронная формула: 17Cl 1s22s22p63s23p5 Он принадлежит к p-семйству, находится в главной группе, так как у него происходит заполнение внешнего p-подуровня. Хлор проявляет сильные окислительные свойства, так как на последнем энергетическом уровне у хлора 7 электронов, и до устойчивой конфигурации благородного газа ему не хватает одного электрона. Элементом с порядковым номером 25 является марганец. Электронная формула марганца: 25Mn 1s2 2s2 2p6 3s2 3p6 4s2 3d5. Он принадлежит к d-семейству, находится в побочной подгруппе, т. к. идет заполнение конкурирующих энергетических подуровней (внешнего и предвнешнего энергетических уровней). Марганец проявляет восстановительные (металлические) свойства, т. к. на последнем – четвертом энергетическом уровне имеется 2 электрона, которые он способен легко отдать. Сходство данных элементов в том, что у них по 7 валентных электронов и формулы оксидов в высших степенях окисления для обоих элементов имеют общую формулу Э2О7, но в отличие от хлора для марганца свойственны восстановительные свойства. А в высшей степени окисления, равной +7, для обоих элементов характерны сильные окислительные свойства. № 67 Вычислите энергию активации (Еа) реакции 2NO2(г) = 2NO(г) + O2(г) если константы скоростей (К) этой реакции при 600 и 640 К соответственно равны 84 и 407 моль/л*с. Какой физический смысл К и Еа и от каких факторов зависят их численные значения? Для определения энергии активации реакции воспользуемся уравнением Аррениуса: Учтя что Энергия активации реакции – это минимальная энергия, которую необходимо сообщить частицам, чтобы их взаимодействие было эффективным, выражается в кДж/моль. Численное значение Еа зависит от природы реагирующих веществ и присутствия катализатора. Константа скорости К – показывает с какой скоростью протекает реакция при концентрациях веществ, равных 1 моль/л. Численное значение константы скорости зависят от природы реагирующих веществ, температуры и от присутствия катализатора. Ответ: № 92 При 782 К константы скоростей прямой и обратной реакций равны соответственно 0.16 и 0.0047. Чему равна константа равновесия? При каких кинетических условиях наступает равновесие? От каких факторов зависит численное значение константы равновесия? Запишем выражение для Кс: Тогда: Кинетическим условием наступления равновесия является равенство скоростей прямой и обратной реакций. Численное значение константы равновесия зависит от природы веществ и температуры, но не зависит от концентраций или парциальных давлений. №109 Запишите уравнения диссоциации HNO2 (Кд = 4*10-4) и HNO3 (α = 1) и определите рН и рОН растворов этих кислот одинаковой молярной концентрации, равной 0,01 М. Кислота HNO2 является слабым электролитом и в растворе не полностью диссоциирует на ионы. Для характеристики числа продиссоциировавших молекул существует такое понятие как константа диссоциации, численное значение которой зависит от природы электролита и от температуры. Для HNO2 Кд = 4*10-4 Уравнение диссоциации HNO2 HNO2 ↔ H+ + NO2- Определим рН 0.01М раствора HNO2 рОН1 = 14 – рН1 = 14 – 2,7 = 11,3 Кислота HNO3 является сильным электролитом и в растворе полностью диссоциирует на ионы: HNO3 = H+ + NO3- Определим рН 0.01М раствора HNO3 рОН2 = 14 – рН2 = 14 – 2 = 12 Ответ: №111 Вычислите константу равновесия при 250С и стандартном давлении для реакции Fe2O3(кр) + 3СО(г) = 2Fe(кр) + 3СО2(г) Как изменится численное значение константы равновесия при повышении температуры до 1250С (докажите расчетом)? Величина константы равновесия связана с изменением изобарно-изотермического потенциала соотношением: ΔG0 = -2.3*R*T*lgKp: Изменение изобарно-изотермического потенциала определяется по следующей формуле: ∆rGº 298 = ∆rH º 298 - T∆rS º 298 Определим изменение энтальпии в результате протекания химической реакции: ∆rHº 298 = ∑∆fHº 298(прод. реакц.) - ∑∆fHº 298(исх. в-в) ∆rHº 298 =2* ∆fHº 298 (Fe (кр)) + 3*∆fHº 298(СО2(г)) – (∆fHº 298(Fe2O3 (кр)) + 3*∆fHº 298(CO(г))) = 2*0 + 3*(-393.51) – 3*(-110.53) – (-822.16) = -26.78 (кДж); Определим изменение энтропии химической реакции: Также не совсем строго, но уже лучше... ∆rS298º = ∑S298º(прод. реакц.) - ∑S298º(исх. в-в) ∆rSº298 = 2*Sº 298 (Fe (кр)) + 3*Sº 298(СО2(г)) – (Sº 298(Fe2O3 (кр)) + 3*S º 298(CO(г))) = 2*27.15 + 3*213.56 – 87.45 – 3*197.56 = 14.85 (Дж/К); Тогда изменение энергии Гиббса реакции: ∆rG298º = --26.78 – 298*14.85 *10-3 = - 31.20 (кДж); Тогда lgKp = - ΔG0/(2.3*R*T) = 5.48; Kp298 = 3*105 Используя уравнение изобары, определим значение константы равновесия при 1250С : 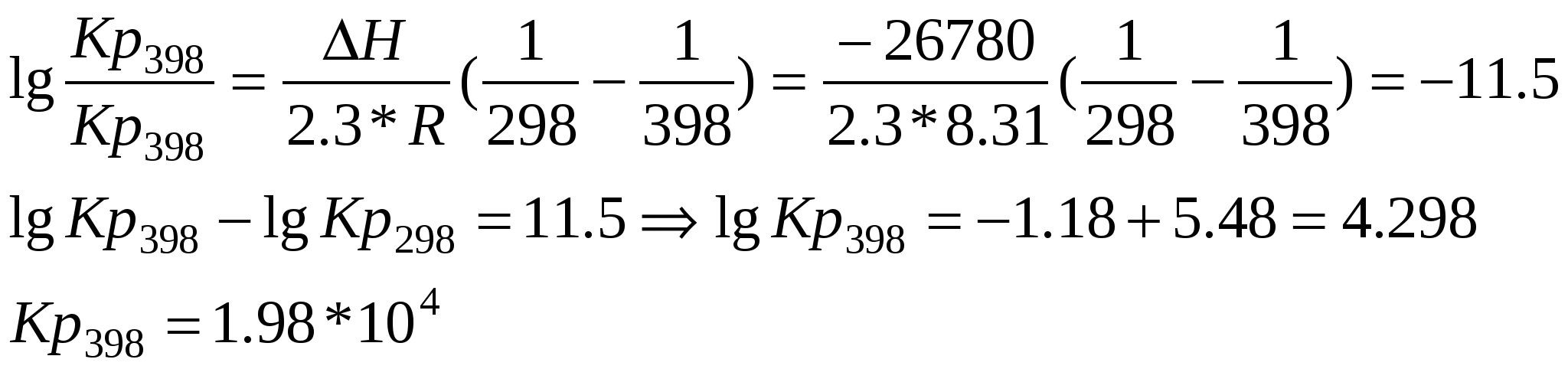 Ответ: Kp298 = 3*105, при повышении температуры до 1250С величина константы равновесия уменьшилась и стала равна № 137 Составьте схему гальванического элемента, в котором самопроизвольно протекает реакция Ni2+ + H2 + 2OH- Ni + 2H2O. Определите рН раствора электролита водородного электрода, если никелевый электрод – стандартный, а ЭДС элемента равна 340 мВ. Запишите уравнения анодно-катодных процессов и рассчитайте значения А’max, G и Кр. Решение: Схема гальванического элемента: (А) H2 / H2O // Ni 2+ / Ni (K) Уравнения электродных процессов: А: H20 + 2OH-– 2е = 2H2O К: Ni 2+ + 2е = Ni 0 ЭДС процесса определяется по формуле: Е = φк - φа = φ(Ni2+/Ni) – φ(H2O/H2); Зная ЭДС процесса и потенциал стандартного никелевого электрода, определим потенциал водородного электрода: φ(H2O/H2) = φ(Ni 2+/ Ni) – Е = - 0.25 – 0.340 = - 0.59 (В); Величина электродного потенциала водородного электрода связана с рН соотношением: φ(H2O/H2) = - 0.059*рН; рН = - φ(H2O /H2)/ 0.059 = - (- 0.59/0.059) = 10; Определим энергию Гиббса: ∆G = - А’м = - n*F*E = - 2*96500*0.34 = - 65.62 (кДж); Определим константу равновесия: 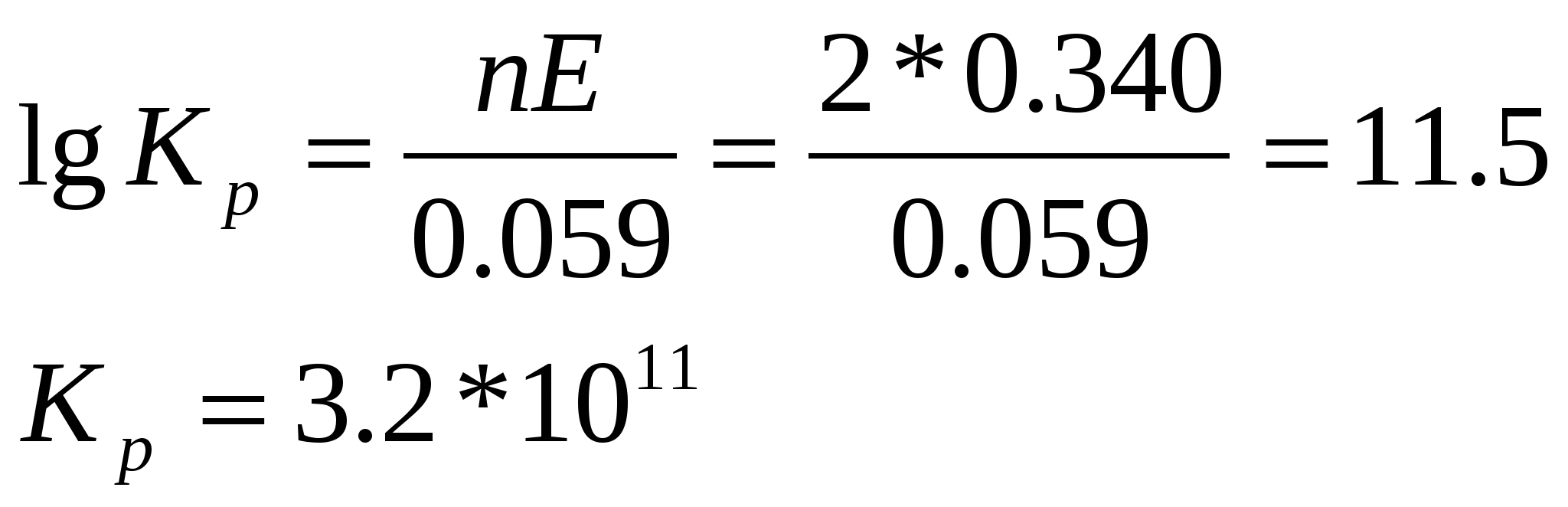 Ответ: рН = 10, ∆G = - 65.62 кДж; №149 Ток силой 4 А пропускали через электролит в течение 15 мин 5 с. На катоде выделился свинец массой 4.14 г. из расплава одного из его соединений. Определите валентность свинца в этом соединении. Запишите уравнения анодно-катодных процессов, если известно, что на аноде выделился хлор, рассчитайте его объем (н.у.). Из закона Фарадея выразим и определим валентность свинца: Из закона Фарадея для газообразных продуктов определим количество хлора которое выделилось на аноде, зная что эквивалентный объем хлора равен 11.2 л: Процессы на электродах: A: Pb0 - 2e = Pb+2 ; К: Cl2 + 2e = 2Cl- Ответ: Z(Pb) = 2; V(Cl2)= 0.42 л; № 164 Цинк находится в контакте со стальным изделием в условиях влажной атмосферы (Н2О, О2), рН =7. За 1 мин 20 с восстановилось 0.034 л О2(н.у.). На сколько уменьшится масса корродируемого металла и чему будет равна сила тока, возникающего при коррозии? Составьте схему электрохимической системы и уравнения коррозионных процессов. При контакте железа и цинка в условиях влажной атмосферы (Н2О, О2) возникает гальваническая пара в которой железо будет катодом (φ0(Fe2+/Fe) = -0.44 B) и на нем будет восстанавливаться кислород из воздуха, а цинк (φ0(Zn2+/Zn) = -0.769 B) – анодом и будет разрушаться. Процессы на электродах: A: Zn0 - 2e = Zn+2 ; К: O2 + 2H2O + 4e = 4OH- Суммарное уравнение реакции: 2Zn + O2 +2H2O = 2Zn+2 +4OH- ; Из закона Фарадея для газообразных продуктов определим силу тока, зная что эквивалентный объем кислорода равен 5.6 л: Из закона Фарадея определим, на сколько уменьшится масса цинка: Ответ: 7.32 А. m(Zn) = 0.2 г. Литература:
|
