математика. 6_константа диссоциации (кондуктометрия). Лабораторная работа Определение степени диссоциации слабого электролита кондуктометрическим способом
 Скачать 90.27 Kb. Скачать 90.27 Kb.
|
Лабораторная работа № 6. Определение степени диссоциации | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Наименование слабого электролита | |
| Химическая формула слабого электролита | |
| Ориентировочное значение концентрации слабого электролита С0 (указано на емкости с этим электролитом), моль/л | |
| Концентрация титранта (гидроксид натрия) СNaOH, экв./л | |
| Объем пробы слабого электролита, взятый для титрования Vа, мл | |
Зависимость удельной электропроводности от концентрации слабого электролита
| № колбы | Концентрация, моль/л (по ориентировочному значению) | Удельная электропроводность , ______* |
| 1 | С0 = _____ | |
| 2 | С1 = С0/2 = _____ | |
| 3 | С2 = С0/4 = _____ | |
| 4 | С3 = С0/8 = _____ | |
| 5 | С4 = С0/16 = _____ | |
Данные для построения кривой кондуктометрического титрования
| № п/п | VNaOH, мл | Удельная электропроводность , ____* |
| 1 | 0 | |
| 2 | 1 | |
| 3 | 2 | |
| 4 | 3 | |
| 5 | 4 | |
| 6 | 5 | |
| 7 | 6 | |
| 8 | 7 | |
| 9 | 8 | |
| 10 | 9 | |
| 11 | 10 | |
| 12 | 11 | |
| 13 | 12 | |
| 14 | 13 | |
| 15 | 14 | |
| 16 | 15 | |
| 17 | 16 | |
| 18 | 17 | … |
| 19 | 18 | |
| 20 | 19 | |
| 21 | 20 | |
*!!!!! Единицы измерения – см. на табло прибора!!!!!!
Обработка экспериментальных данных
I. Определение точного значения концентрации слабого электролита
1. По данным таблицы «Данные для построения кривой кондуктометрического титрования» построить кривую кондуктометрического титрования
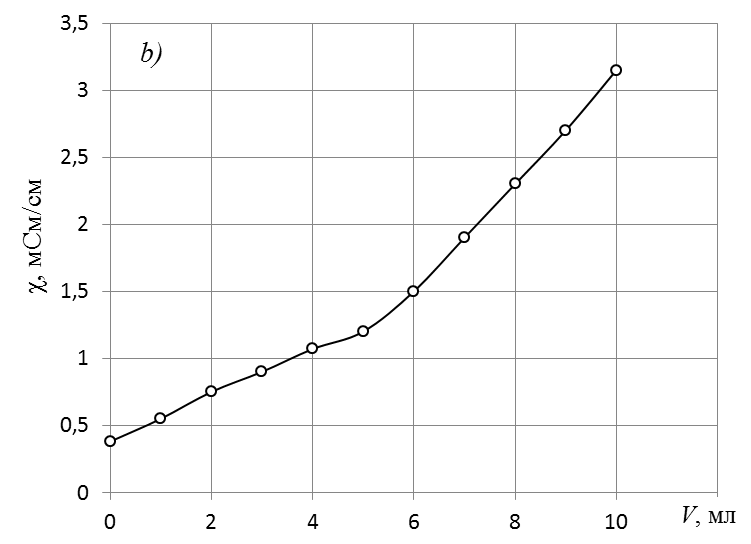
Экспериментальная кривая кондуктометрического титрования.
2. Обработать графически кривую титрования
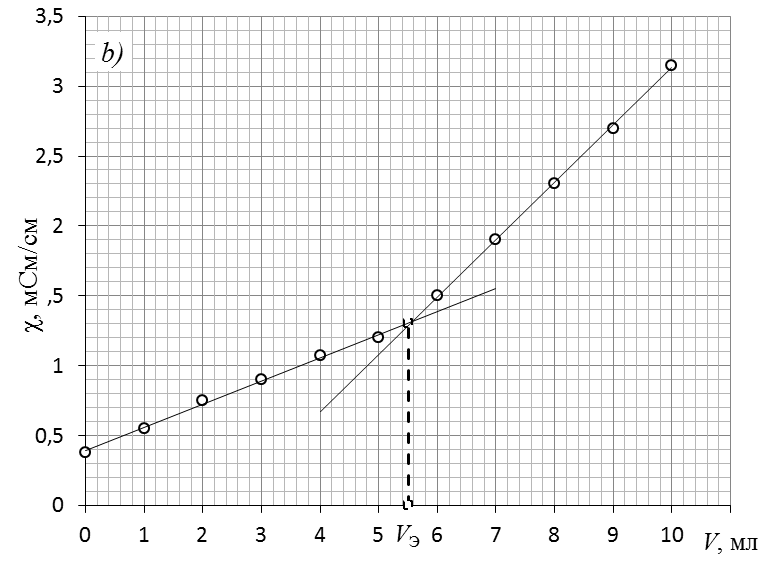
Обработка экспериментальной кривой титрования и определение точки эквивалентности.
2.1. Массив экспериментальных данных разделить на 2 части относительно точки перегиба.
2.2. Каждую часть аппроксимировать линейной зависимостью.
2.3. При построении линий тренда начального и конечного периодов на вкладке «формат линии тренда» отметить прогноз «вперёд» для начального периода и «назад» для конечного периода.
2.4. От места пересечения прямых опустить перпендикуляр с оси абсцисс и определить значение эквивалентного объема щелочи.
2.5. Координату точки пересечения можно найти рассчётным путём, решив систему из двух уравнений линий тренда.
3. Точное значение концентрации слабого электролита вычислить по формуле:
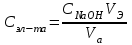 ,
, где VЭ – эквивалентный объем щелочи, определенный по кривой титрования, мл; СNaOH – концентрация раствора щелочи, экв./л; Va – объем аликвоты слабого электролита, мл.
II. Определение константы и степени диссоциации слабого электролита
Далее в расчетах используется точное значение концентрации слабого электролита, определенное в п. I.
1. Вычислить эквивалентную электропроводность каждого раствора по формуле:
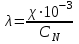 .
.2. Заполнить таблицу, используя данные эксперимента «Зависимость удельной электропроводности от концентрации слабого электролита»
| Электролит | С, экв/л | , См·м−1 | λ, Смм2·экв1 | 1/λ | λС |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | |
3. По данным таблицы построить графики зависимостей = f(C) и 1/λ = f(λС).
4. По графику 1/λ = f(λС) найти 1/λ∞ посредством экстраполяции зависимости на ось ординат 1/λ и вычислить λ∞. Полученное значение λ∞ сопоставить с данными [1]. При наличии сильного расхождения в дальнейших расчетах рекомендуется использовать справочные данные.
5. Рассчитать значение степени диссоциации по уравнению:
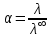 .
.6. Вычислить значение константы диссоциации по уравнению:
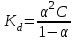 .
.7. Результаты вычислений занести в таблицу:
| Электролит | С, моль/л | α | Kd | Kd = Kd среднее Kd | |
| | | | | | |
| | | | | | |
| | | Kd среднее = … | | ||
8. Среднее квадратичное отклонение σ рассчитывают по уравнению:
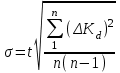 ,
, где t – коэффициент Стьюдента. Для доверительной вероятности 0,95 t = 3,2.
9. Окончательный результат представляют в виде:
Kd = Kd среднее ± σ.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.
