Лаба термодинамика. Лабораторная работа №113 цикл карно ст гр. Угф-19-01 Абдурахмоно. Лабораторная работа 113 цикл карно ст гр. Угф1901 Абдурахмонов М. Принял Хашаев М. М
 Скачать 118.41 Kb. Скачать 118.41 Kb.
|
|
Лабораторная работа № 113 ЦИКЛ КАРНО. Выполнил: ст. гр. УГФ-19-01 Абдурахмонов М. Принял: Хашаев М. М. Цель работы: изучить на компьютерной модели цикла Карно для идеального газа. Задание: ознакомиться с компьютерной моделью, иллюстрирующей цикл Карно для идеального газа. определить по данным, полученным на основе компьютерной модели цикла Карно: работу, совершённую газом за цикл; приведенное количество тепла; коэффициент полезного действия цикла Карно. рассмотреть цикл Карно с точки зрения изменения энтропии. Описание установки: 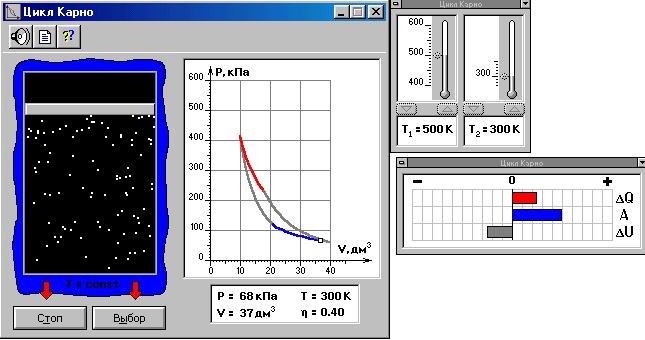 Рис.1. Компьютерная модель цикла Карно для идеального газа. Рис.1. Компьютерная модель цикла Карно для идеального газа.Установкой в данной лабораторной работе является компьютерная модель, иллюстрирующая цикл Карно для идеального газа. Как видно из рис.1 данная установка представляет собой регулятор термометров, цикл Карно в системе координат P-V, а также значения термодинамических параметров и коэффициента вязкости в момент остановки процесса. Методика выполнения работы:  1 12. Нажимаем кнопку «СТАРТ» и наблюдаем перемещение точки по замкнутой кривой цикла Карно. 3. Затем, нажав кнопку «СТОП», останавливаем процесс вблизи точки 2, которая соответствует переходу изотермического расширения газа в адиабатическое. Записываем в таблицу 2 значения V2 и p2, которые в момент остановки процесса в точке 2 будут обозначены в нижнем прямоугольнике окна опыта. 4. Аналогичные измерения проводим для состояний 3, 4 и 1 и записываем значения давлений и объёмов газа в соответствующие столбцы таблицы 2. 5. Повторяем измерения еще два раза. Данные записываем в строки 2 и 3 таблицы 2. 6. Повторяем весь цикл измерений ещё два раза. Результаты опытов заносим в таблицы 3 и 4, аналогичные таблице 2. Обработка результатов измерений: 1. Для каждого из вариантов температур Т1, Т2 находим средние значения давлений (р1, р2, р3 и р4) и объемов (V1, V2, V3 и V4). Результаты записываем в таблицы 2,3,4. 2. Используя полученные средние значения давлений и объемов, находим 3. С помощью уравнения состояния идеального газа определяем число молей газа в данной компьютерной модели. Оцениваем погрешность . 4. Рассчитываем Q1, Q2, A и записываем полученные значения в таблицу 5. 5. По формуле  рассчитываем и записываем в таблицу 5 коэффициенты полезного действия цикла Карно для всех рассмотренных случаев. рассчитываем и записываем в таблицу 5 коэффициенты полезного действия цикла Карно для всех рассмотренных случаев. 6. Вычисляем приведенное количество тепла для всех процессов. Результаты записываем в таблицу 5. 7. Находим изменение энтропии для всех рассмотренных процессов. 8. Проанализировав полученные результаты, делаем выводы. Ответы на контрольные вопросы: 1. В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой считают, что: 1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда; 2) между молекулами газа отсутствуют силы взаимодействия; 3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие. Уравнение состояния идеального газа (уравнение Клапейрона-Менделеева): pV = νRT =(m/M)RT 2. Внутренняя энергия макросистемы – это функция состояния системы, т.е. она не зависит от предыстории системы и состоит из: суммарной кинетической энергии хаотического движения молекул; потенциальной энергии взаимодействия всех молекул системы; внутренней энергии частиц, составляющих систему. Внутренняя энергия идеального газа равна произведению средней энергии молекул газа < > к их числу N = NA, где число молей, NA число Авогадро (NA = 6.021023моль-1): U = N < > 3. Первое начало термодинамики: количество теплоты, сообщенное системе, идет на приращение ее внутренней энергии и на совершение системой работы над внешними телами. 4. Второе начало термодинамики (закон возрастания энтропии замкнутой системы при необратимых процессах): любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает. 5. Первое начало термодинамики для изотермического процесса: δQ = δA Q = A12=(m/M)RTln(V2/V1) = (m/M)RTln(p1/p2) Первое начало термодинамики для адиабатического процесса: δA = -dU pdV = -(m/M)CVdT 6. Тепловые двигатели – это периодически действующие двигатели, совершающие работу за счет получаемого извне количества теплоты. Основные элементы теплового двигателя: нагреватель, холодильник и рабочее тело. 7. Холодильник поглощает часть энергии рабочего тела, он нужен для того, чтобы работа, совершаемая телом за один цикл, была положительной. В двигателе внутреннего сгорания роль холодильника играет атмосфера. 8. Обратимые и необратимые процессы отличаются тем, что обратимый процесс допускает возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения, а необратимый процесс не допускает такой возможности. Все реальные процессы необратимы, потому что они протекают с конечной скоростью и сопровождаются трением, диффузией и теплообменом при конечной разности между температурами системы и внешней среды. 9. Энтропия – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Размерность энтропии равна Дж∙моль-1∙K-1. 10. Энтропия замкнутой системы может либо возрастать (для необратимых процессов), либо оставаться постоянной (для обратимых процессов). Энтропия не замкнутой системы может вести себя любым образом. 11. Вероятностное определение энтропии: энтропия при абсолютном нуле температуры равна нулю. 12. Первая теорема Карно: коэффициент полезного действия тепловой машины, работающей по циклу Карно, зависит только от температур Т1 и Т2 нагревателя и холодильника, но не зависит от устройства машины, а также от вида используемого рабочего тела. Вторая теорема Карно: КПД всякой тепловой машины не может превосходить КПД идеальной тепловой машины, работающей по циклу Карно с теми же самыми температурами нагревателя и холодильника. 13. Вывод формулы для коэффициента полезного действия цикла Карно: Qн=Tн (S2 – S1); Qх=Tх (S2 – S1) η = 1 - 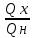 = 1 - = 1 - 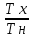 14. Пути повышения КПД тепловых двигателей: уменьшение потерь на трение сопрягающихся деталей, увеличение качества топлива и его сгорания, совершенствование систем отвода сгораемых газов. 15. Изотермический и адиабатический процессы и цикл Карно в системе координат T-S. 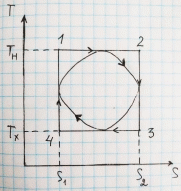 |
