антибиотики лекция. Лекции 1, 2, по плану 25. 1030. 10 01. 1106. 11
 Скачать 162.97 Kb. Скачать 162.97 Kb.
|
|
ЛЕКАРСТВЕННЫЕ СРЕДСТВА – АНТИБИОТИКИ (Лекции 1, 2, по плану 25.10-30.10; 01.11-06.11) Антибиотики – это химиотерапевтические вещества, образуемые микроорганизмами или получаемые из иных природных источников, а также их производные и синтетические продукты, обладающие способностью убивать или подавлять в организме больного возбудителей заболеваний или задерживать развитие злокачественных образований. Антибиотики должны обладать антимикробной активностью в организме человека и не должны проявлять токсического действия. В настоящее время открыты тысячи антибиотиков с различным спектром действия, однако в медицинской практике находят применение лишь несколько десятков. Это объясняется тем, что большинство антибиотиков не удовлетворяет требованиям современной медицины. Современные требования к эффективности и безопасности антибиотиков 1. Высокая избирательность антимикробного действия в дозах, нетоксичных для организма. 2. Отсутствие или медленное развитие резистентности возбудителя к лекарственному средству. 3. Сохранение антимикробного эффекта в жидкостях и тканях организма, отсутствие или низкий уровень инактивации белками сыворотки крови. 4. Хорошая всасываемость, распределение и выведение из организма, обеспечение терапевтической концентрации в крови, тканях и жидкостях организма. 5. Удобная лекарственная форма, обеспечивающая максимальную стабильность при хранении. Эффективность антибиотиков увеличивается в случае: 1. повышения степени чистоты и освобождения от сопутствующих примесей; 2. создания новых производных, обладающих повышенной активностью, пролонгированным действием; 3. разработки инновационных лекарственных форм. К группе антибактериальных средств относится большое количество лекарственных средств различного химического строения и направленности действия. В связи с вышесказанным, существует несколько классификаций антибиотиков, объединяющих их в группы по различным признакам. Классификация антибиотиков по химическому строению 1. Антибиотики алициклического строения: эта группа представлена антибиотиками группы тетрациклинов – в основе строения лежит конденсированная система из четырех циклов. В основе механизма действия лежит подавление биосинтеза белка микробной клетки на уровне рибосом (в терапевтических дозах действуют бактериостатически). 2. Антибиотики ароматического строения: эта группа представлена хлорамфениколом [левомицетином] и его эфирами. В основе механизма действия – нарушение синтеза белка микроорганизмов (в терапевтических дозах действуют бактериостатически). 3. Антибиотики гетероциклического строения: эта группа представлена конденсированными производными β-лактамного цикла и циклов тиазолидина или дигидротиазина (пенициллины и цефалоспорины.) В основе механизма действия – блокирование конечной стадии образования клеточной стенки бактерий, которое вызывает лизис клетки (в терапевтических дозах действуют бактерицидно). 4. Антибиотики аминогликозидного строения: характерной особенностью их химического строения является то, что они являются гликозидами с агликонами – производными аминоциклонолов и сахарными компонентами – аминосахарами (группа стрептомицина). Механизм действия связан с ингибированием синтеза белка на уровне рибосом (в терапевтических дозах действуют бактерицидно). 5. Антибиотики – макролиды: в основе строения лежит макроциклическое лактонное кольцо (группа эритромицина). Механизм действия сходен с аминогликозидными антибиотиками (в терапевтических дозах действуют бактериостатически). 6. Антибиотики-полиены: в основе строения - полиеновая углеродная цепь, представлены антибиотиками противогрибкового действия. 7. Противоопухолевые антибиотики (группа рубомицина и брунеомицина). Механизм действия связан с блокированием матричной активности ДНК в системах ДНК-полимеразы и ДНК-зависимой РНК-полимеразы, что приводит к нарушению синтеза нуклеиновых кислот опухолевой клетки. 8. Антибитики-полипептиды (группа грамицидина и полимиксина): в структуре содержат остатки полипептидов. В основе механизма действия: нарушение функции клеточных мембран (в терапевтических дозах действуют бактериостатически). 9. Антибиотики, производные фторхинолонов (группа ципрофлоксацина): в основе лежит замещенный фторхинолоновый цикл. Механизм действия связан с ингибированием фермента ДНК-гиразы и нарушением биосинтеза ДНК микробной клетки (в терапевтических дозах действуют бактерицидно). 10. Антибиотики различного химического строения: представлена лекарственными средствами различной химической структуры и механизма действия. Классификация антибиотиков по направленности действия 1. Антимикробные: 1.1. активные в отношении грамположительных возбудителей (пенициллины, макролиды); 1.2. активные в отношении грамположительных и грамотрицательных возбудителей (аминогликозиды); 1.3. широкого спектра действия (тетрациклины, цефалоспорины, фторхинолоны, левомицетин). 2. Противогрибковые (нистатин, леворин, фузидин-натрий). 3. Противоопухолевые (рубомицин, брунеомицин). Антимикробные лекарственные средства можно разделить по типам антимикробного действия. Классификация антибиотиков по типам антимикробного действия 1. бактерицидного действия (пенициллины, цефалоспорины, тетрациклины, некоторые аминогликозиды); 2. бактериостатического действия (макролиды, аминогликозиды, полиены). Классификация антибиотиков по механизму действия 1. Специфические ингибиторы синтеза клеточной стенки микроорганизмов (пенициллины, цефалоспорины). 2. ЛС, нарушающие молекулярную организацию и функции клеточных мембран (полимиксины, полиены, противогрибковые антибиотики). 3. Ингибиторы синтеза белка на уровне рибосом (тетрациклины, аминогликозиды, левомицетин). 4. Ингибиторы синтеза РНК микробной клетки (рифампицин, актиномицин). 5. Ингибиторы синтеза ДНК микробной клетки (фторхинолоны, противоопухолевые антибиотики). Антибиотики являются одними из самых широко используемых в современной медицине лекарственных средств для лечения различных заболеваний. Успех антибактериальной терапии и эффективность лечения во многом зависит от рационального применения антибиотиков. Основные принципы рациональной антибиотикотерапии 1. Выделение и идентификация возбудителя заболевания. 2. Выбор наиболее активного и менее токсичного лекарственного средства. 3. Определение оптимальных доз и методов введения в организм. 4. Своевременное начало лечения и проведения курсов лечения необходимой продолжительности. 5. Знание особенностей проявления и частоты побочных явлений. 6. Комбинирование антибиотиков между собой и с другими лекарственными средствами с целью усиления антибактериального эффекта и снижение частоты побочных явлений. Антибиотики группы бета- лактамидов К β-лактамным антибиотикам относятся пенициллины и цефалоспорины. В основе строения пенициллинов лежит 6-аминопенициллановая кислота (6-АПК), которая состоит из двух циклов, конденсированных между собой: четырехчленного- β-лактамного (В) и пятичленного – тиазолидинового (А):  Пенициллины отличаются друг от друга строением ацильного остатка в аминогруппе. Пенициллины оптически активные вещества содержат асимметрические атомы углерода в 3, 5, 6 положениях. Общая формула пенициллинов: 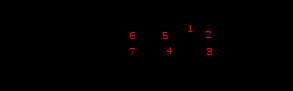 История открытия антибиотиков-пенициллинов 1871 – 1872 год – русские ученые В.А. Манассеин и А.Г. Полотебнов наблюдали, что культуральная жидкость, образующаяся при выращивании плесени Penicillium notatum, не содержит бактерий. 1876 год – английский ученый Д. Тиндаль также отмечает способность плесени Penicillium убивать бактерии. 1877 год - русский ученый П.В. Лебедев наблюдает уменьшение бактерий в ЖКТ подопытного животного под влиянием плесени. 1929 год – А. Флеминг описывает способность плесени Penicillium notatum Westling угнетать рост золотистого стафилококка. Было сделано предположение, что культура выделяет особое бактерицидное вещество, уничтожающее возбудителя. 1940 год – Х. Флори и Д. Чейн (США) впервые выделили из культуральной жидкости Penicillium notatum биологически активное вещество – пенициллин. 1942 год – русский исследователь профессор З.В. Ермольева получила отечественный пенициллин из культуральной жидкости плесени. Работы по модификации структуры антибиотиков пенициллинового ряда ведутся и по настоящее время. Лекарственные средства группы природных пенициллинов
Лекарственные средства группы полусинтетических пенициллинов
Связь строения с действием В основе химического строения должна быть 6-аминопенициллановая кислота. Расщепление β-лактамной связи или тиазолидинового цикла ведет к полной потере антибактериальной активности. Карбоксильная группа в положении 3 должна быть свободной или представлена анионной формой, этерифицированные производные утрачивают активность. Природа радикала в ацильном остатке определяет степень связывания пенициллина белками плазмы крови, влияет на устойчивость к пенициллиназе (например, остаток оксазола в молекуле оксациллина определяет его устойчивость к ферменту). Характер связи фенильного радикала с метиленовой группой в ацильном остатке определяет кислотоустойчивость пенициллинов (например, феноксиметилпенициллин, ампициллин и амоксициллин устойчивы к воздействию кислоты ЖКТ, поэтому применяются в виде пероральных форм). Заместитель в метиленовой группе ацильного остатка определяет спектр действия пенициллина. Способы получения пенициллинов 1. Метод биосинтеза (микробиологический метод). Биосинтез складывается из нескольких стадий: 1.1. Подготовка питательной среды и проращивание спор; 1.2. Ферментация; 1.3. Выделение антибиотика и его очистка. 2. Полусинтетический метод. Описание и растворимость Белые или почти белые кристаллические порошки без запаха или со слабым специфическим запахом, бензилпенициллина калиевая и натриевая соли слегка гигроскопичны, натриевые соли амоксициллина и ампициллина - гигроскопичны. Кислотные формы мало растворимы в воде, калиевые и натриевые соли очень легко растворимы в воде, новокаиновая соль бензилпенициллина мало растворима в воде. Все ЛС практически нерастворимы в эфире, бензоле. Физико-химические свойства 1. Оптическая активность. Растворы пенициллинов обладают оптической активностью, т.е. способностью вращать плоскость поляризованного луча света. В молекулах ЛС содержатся асимметрические атомы углерода в 3, 5, 6 положениях. Ампициллин и карбенициллин имеют асимметрические атомы углерода в ацильных остатках. 2. Поглощение света в УФ- и ИК-области спектра. Пенициллины поглощают свет в УФ- и ИК-области спектра. 3. Кислотные свойства пенициллины проявляют за счет карбоксильной группы (-COOH). ЛС образуют соли с катионами щелочных металлов и органическими основаниями, могут быть получены сложные эфиры. 4. Гидролитическое расщепление. Наиболее лабильной частью молекулы пенициллина является β-лактамное кольцо, которое подвергается гидролитическому расщеплению под действием кислот, щелочей, фермента пенициллиназы с потерей биологической активности. Реакция щелочного гидролиза: 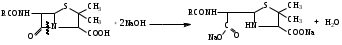 Динатриевая соль пенициллоиновой кислоты Подлинность 1. ИК-спектрометрия. ИК-спектры, снятые для субстанций ЛС в области от 400 до 4000 см-1 , должны соответствовать спектрам ГСО (государственного стандартного образца) этих же ЛС, снятых в тех же условиях. 2. Тонкослойная хроматография. Параллельно хроматографируют ЛС и стандартный образец. Пятна на хроматограммах субстанции и стандартного образца должны быть на одном уровне. 3. ВЭЖХ. Метод используют в анализе лекарственных препаратов промышленного производства. Время удерживания пика основного вещества на хроматограмме испытуемого раствора должно соответствовать времени удерживания пика ЛС на хроматограмме раствора стандартного образца ЛС. 4. Спектрофотометрия. Снимают УФ-спектр растворов ЛС, определяют оптическую плотность при определенной длине волны или отношение между значениями плотностей при различных длинах волн. Для разных представителей могут быть использованы способы: По количеству и положению максимумов поглощения на спектре испытуемого образца – бензилпенициллин и его соли имеют в области от 240 нм до 300 нм два выраженных максимума (бензильный радикал). В УФ-спектре феноксиметилпенициллина наблюдают два интенсивных максимума при 268 нм и при 274 нм (феноксигруппа). В УФ-спектре ампициллина тригидрата (0,075% водный раствор) наблюдают три максимума при 256, 261 и 267 нм (сравнение с УФ-спектром ГСО ампициллина тригидрата). Рассчитывают также отношение оптических плотностей при длинах волн 263 и 280 нм: А263 нм/А280 нм не менее 0,72 (бензилпенициллина калиевая и натриевая соли); А268 нм/А274нм не менее 1,21 и не более 1,24 (феноксиметилпенициллин). 5. Общие качественные реакции. 5.1. Гидроксамовая реакция (бензилпенициллин калия и бензилпенициллин натрия. Реакция основана на способности антибиотиков, содержащих лактамную группу, гидролизоваться в присутствии гидроксиламина в щелочной среде до гидроксамовой кислоты, которая с солями железа и меди в кислой среде даёт характерное окрашивание за счёт образования гидроксаматов железа и меди. 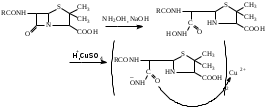 зеленое окрашивание С солями железа образуется красно-фиолетовое окрашивание. 5.2. Реакции на катионы калия и натрия. Калиевые соли пенициллинов: реакция А на калий с винной кислотой после сжигания ЛС в тигле или окрашивание бесцветного пламени горелки в фиолетовый цвет (реакция Б). Натриевые соли пенициллинов: реакция А на натрий с калия пироантимонатом после сжигания ЛС в тигле или Б (окрашивание пламени в желтый цвет). Специфические качественные реакции Бензилпенициллина новокаиновая соль Реакция образования азокрасителя на первичную аминогруппу:   Удельное вращение. Например, для бензилпенициллина калиевой соли (+ 2700 - + 3000); для бензилпенициллина натриевой соли (+ 2850 - + 3100) в пересчете на сухое безводное вещество(2% водный раствор субстанции). Чистота 1. Прозрачность и цветность водных растворов, аномальная токсичность, бактериальные эндотоксины, стерильность (для субстанций, предназначенных для производства ЛП для парентерального применения). 2. pH водных растворов: от 5,5 до 7,5 (2% водный раствор бензилпенициллин калия); от 8,0 до 10,0 (10% раствор). Светопоглощающие примеси определяют спектрофотометрическим методом в УФ области по значению оптической плотности. Например, оптическая плотность раствора амоксициллина натрия при длине волны 430 нм не должна превышать 0,30. Родственные примеси определяют методом ВЭЖХ (определяют допустимое содержание примесей по площади пика – площадь пика любой примеси должна быть не более площади основного пика на хроматограмме раствора сравнения (не более 1%). 5. Специфические примеси определяют методом ВЭЖХ и ГЖХ. 6. Общие примеси: тяжелые металлы, сульфатная зола. 7. Содержание воды по методу Фишера. Количественное определение Фармакопейные методы количественного определения. 1. Специфическим испытанием лекарственных средств из группы антибиотиков является определение антимикробной активности методом диффузии в агар. Определение основано на их способности угнетать рост микроорганизмов. Определение проводят методом диффузии в агар на плотной питательной среде путём сравнения размеров зон угнетения роста тест-микробов, образующихся при испытании растворов определённых концентраций ГСО и испытуемого препарата. Антимикробная активность антибиотиков выражается в единицах действия – ЕД или «мкг». Для большинства антибиотиков 1 ЕД или «мкг» соответствуют 1 мкг активного вещества (кислоты или соли); для антибиотиков, имеющих иное количественное выражение единицы, соответствующие указания даются в частных фармакопейных статьях. При определении антимикробной активности антибиотиков используют стандартные образцы, активность которых устанавливается в соответствии с Международными биологическими стандартами. Стандартные образцы - это высокоочищенные антибиотики, выпускаются в запаянных ампулах нейтрального стекла. Для определения можно использовать как инструментальные, так и химические методы. 2. Метод ВЭЖХ. Расчёт содержания ЛС проводят по площади его пика на хроматограмме в сравнении с площадью пика стандартного образца в пересчёте на сухое вещество (бензилпенициллин калия и натрия). 3. Спектрофотометрия в УФ области для феноксиметилпенициллина. Расчёт ведется по удельному показателю поглощения, либо по величине оптической плотности ГСО. Титриметрические методы. 1. Общий метод определения суммы пенициллинов в солях бензилпенициллина и феноксиметилпенициллина – йодометрический . Метод основан на окислении йодом продуктов щелочного гидролиза ЛС: пенальдиновой кислоты и пеницилламина и восстановлении йода до йодид-иона. При щелочном гидролизе происходит раскрытие β-лактамного кольца с образованием пенициллоиновой кислоты в открытой тиольной форме.  динатриевая соль пенициллоиновой кислоты  пенициллоиновая кислота  пенальдиновая кислота пеницилламин  ациламиномалоновая кислота пеницилламиновая кислота  изб. f экв (ЛС) = 1/8 Пенициллоиновая кислота при рН 4,5 гидролизуется до пенальдиновой кислоты и пеницилламина, которые окисляются раствором йода соответственно до дегидропенальдиновой кислоты (ациламиномалоновая) и пеницилламиновой кислоты. Избыток йода оттитровывают раствором натрия тиосульфата. На окисление ЛС расходуется 8 эквивалентов йода. Параллельно проводят контрольный опыт с таким же количеством ЛС без щелочного гидролиза. Величина титра меняется при изменении температуры, поэтому титры определяются эмпирическим путём. 2. В новокаиновой соли бензилпенициллина определяется основание новокаина ацидиметрическим методом нейтрализации по варианту обратного титрования. Из карбонатной среды основание новокаина извлекают хлороформом. Хлороформное извлечение отделяют, промывают водой от натрия карбоната, прибавляют избыток титрованного раствора серной кислоты, при этом образуется новокаина сульфат. Избыток серной кислоты оттитровывают щелочью.  изб. fэкв (бензилпенициллина новокаиновой соли)=1 индикатор метиловый красный. 3. Метод щелочного гидролиза. Используется для определения суммы полусинтетических пенициллинов. Метод основан на свойстве β - лактамной связи при нагревании со щелочами подвергаться гидролитическому расщеплению. К ЛС добавляют избыток титрованного раствора натрия гидроксида и нагревают на водяной бане 20 минут. Избыток щёлочи оттитровывают кислотой. 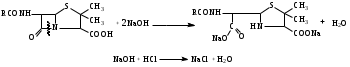 изб. fэкв (ЛС)=1/2 индикатор фенолфталеин Хранение Препараты для инъекций выпускают в герметически укупоренных флаконах с резиновыми пробками и алюминиевыми колпачками. Хранят в сухом месте при комнатной температуре. Применение Природные пенициллины эффективны при инфекциях, вызванных граммположительными бактериями (стрептококки, стафилококки, пневмококки и др.). Пенициллины оказывают бактерицидное действие на микроорганизмы, находящиеся в фазе роста. Полусинтетические аналоги имеют более широкий спектр антибактериального действия и применяются при заболеваниях вызванных смешанной инфекцией. Карбенициллин в отличие от других пенициллинов эффективен по отношению к синегнойной палочке. |

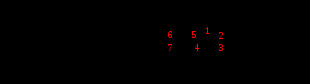

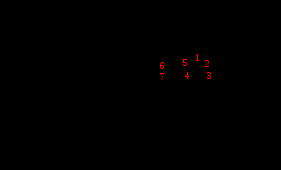

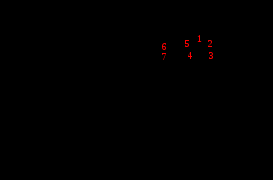
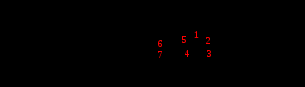
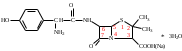 Амоксициллина тригидрат
Амоксициллина тригидрат H2O
H2O