ПЗ.5 Жупарбекова А. Лекция 5 Отчего зависит растворимость органических веществ
 Скачать 2.13 Mb. Скачать 2.13 Mb.
|
|
Жупарбекова Аяжан Вопросы самоконтроля, лекция 5 Отчего зависит растворимость органических веществ, Влияние растворителя на тип и направление реакции, Влияние растворителя на стереохимию и скорость реакции, Объясните термин "клетка растворителя" "Солевой эффект" как фактор управление реакцией. Вода является хорошим растворителем как для солей, легко диссоциирующих на ионы, так и для многих соединений с полярными связями. Такие вещества обычно называют полярными или гидрофильными ("водолюбивыми"). В то же время углеводороды растворяются в воде плохо. Такие вещества называют неполярными или гидрофобными. Растворимость в воде органических соединений определяется соотношением полярных или неполярных групп. Это положение хорошо иллюстрируется на примере жирных кислот. Карбоксильная группа жирных кислот ионизирована и способна образовывать водородные связи. Однако по мере увеличения длины углеводородной цепи растворимость жирных кислот заметно снижается. Жирные кислоты, содержащие в цепи более 10 углеродных атомов, практически нерастворимы в воде. Молекулы, содержащие группы ОН- (спирты, сахара), SH- и NH2-, сильно полярны и хорошо растворимы в воде. Другие жидкости (углеводороды, четыреххлористый углерод, масла, жиры и т.д.), будучи неполярными, очень слабо растворимы в воде. Роль растворителя на течение химической реакции надо связывать с характером процессов сольватации всех участников взаимодействия (исходных, промежуточных и конечных продуктов реакции). В процессах сольватации может происходить перераспределение электронной плотности, что должно приводить к ослаблению или упрочнению химических связей. Так, полярные растворители, облегчающие разделение зарядов, благоприятствуют реакциям, включающим гетеролитическое расщепление. Неполярные растворители, напротив, благоприятствуют радикальным реакциям. Растворители кислотного характера благоприятствуют протеканию реакций электрофильного типа с образованием карбокатиона. Из-за кислого характера растворитель способен сольватировать нуклеофильные анионы и может также облегчать анионоидный отрыв при реакциях замещения. Если растворитель будет связывать катион, оставляя анион несольватированным, то он должен сильно стимулировать нуклеофильные реакции. Способность общего растворителя или сольвации зависит от следующих двух показателей, когда реагирующее вещество является ионом: 1. Чем выше значение дипольного момента растворителя, тем быстрее происходит сольвентация. 2. Диэлектрическая проницаемость, т. е. изменение дипольного момента растворителя под действием внешней среды или, если его нет, появление дипольного момента. С увеличением полярности растворителя доля реакции SN2 увеличивается за счет уменьшения реакции E2 (увеличивается S2/ E2). То есть: в переходном состоянии реакций деления заряды делокализованы больше, чем в переходном состоянии реакций обмена. 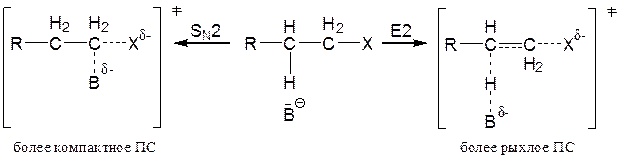  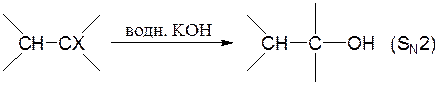 Влияние растворителя на скорость реакций и состояние химического равновесия удобно рассмотреть основываясь на теории переходного состояния (активированного комплекса). Согласно классической теории кинетики реакций Аррениуса, превращению исходных реагентов (ИР) в продукты реакции (ПР) должно предшествовать преодоление ими некоторого энергетического барьера (энергии активации). То есть на пути превращения (ИР ПР) наблюдается образование переходного состояния (ПС), отличающегося от ИР и ПР высокой свободной энергией. Разница свободных энергий ПС и ИР называется энергией активации. Чем меньше ИР, тем выше скорость реакции. Согласно постулату Хэмонда, структура ПС должна быть похожей на исходные или конечные продукты. В ПС намечаются разрыв старых и образование новых связей, то есть происходит перераспределение электронной плотности с изменением характера сольватации растворителем и уровня свободной энергии. Если смена растворителя приведет к усилению сольватации преимущественно ПС, не меняя характера сольватации ИР, тогда энергия активации понизится на величину что будет способствовать увеличению скорости реакции. Если же растворитель будет преимущественно сольватировать ИР, то DG # будет возрастать, а скорость реакции снижаться. Учитывая структуру всех партнеров по химическому взаимодействию с помощью растворителя можно активно вмешиваться в ход процесса. Например, один из вариантов реакции нуклеофильного замещения между анионом и малополярной молекулой может быть представлен схемой Общий эффект растворителя на реакции с участием нейтральных, положительно или отрицательно заряженных частиц можно суммировать следующим образом: а) повышение полярности растворителя приведет к росту скорости реакций, в которых активированный комплекс имеет большую плотность заряда, чем исходная молекула (или молекулы); б) повышение полярности растворителя приведет к снижению скорости реакций, в которых плотность заряда в активированной комплексе меньше, чем в 12 исходной молекуле (или молекулах); в) изменение полярности растворителя практически не будет влиять на скорости реакций, в которых при переходе от реагента (или реагентов) к активированному комплексу плотность заряда остается постоянной или изменяется незначительно. Понятие клетки растворителя распространяется также и на многочисленные радикальные реакции, в частности на рекомбинацию, которая облегчается протеканием реакции в одной клетке. 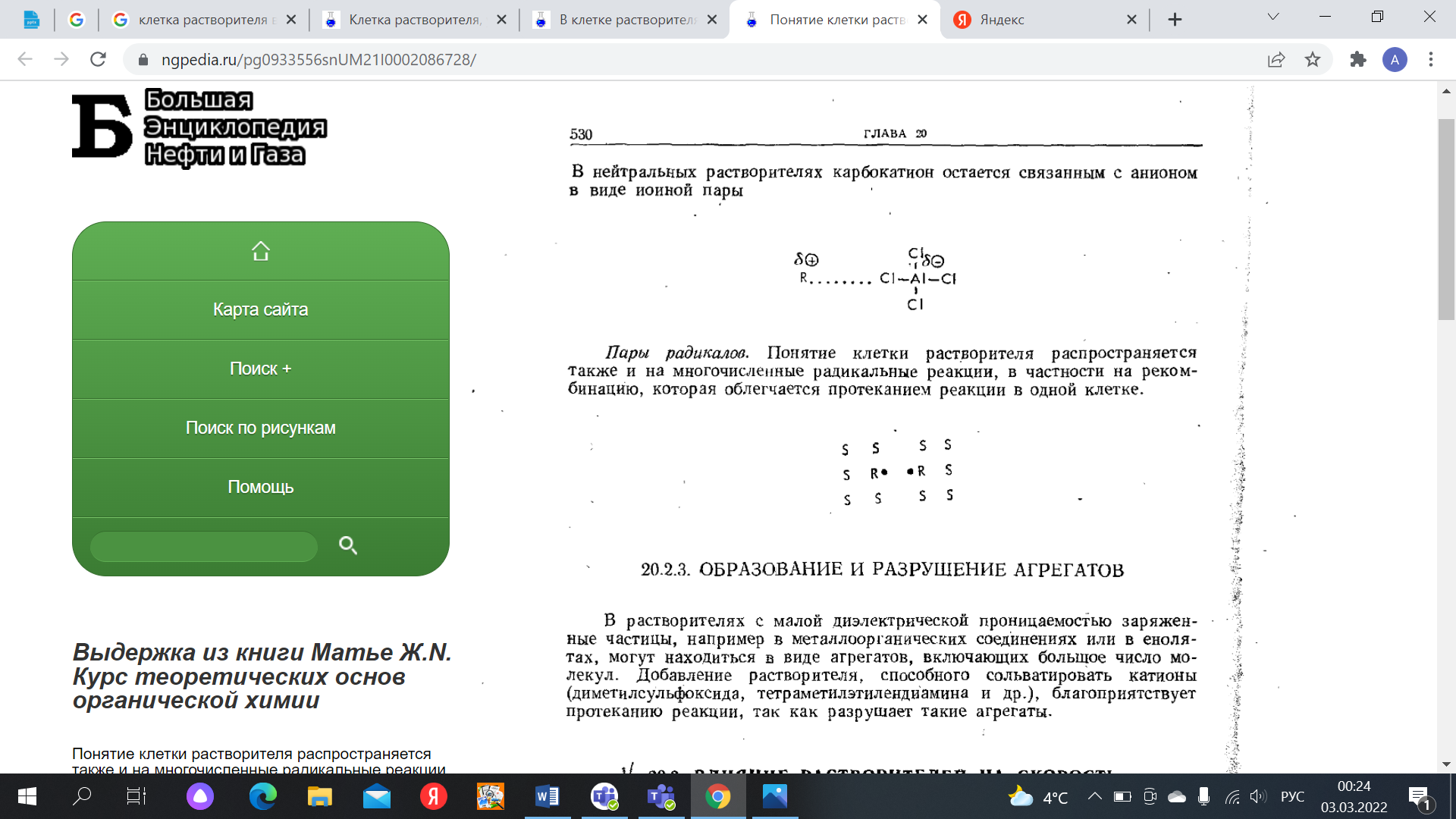 Влияние клетки растворителя на состав продуктов реакции, названное “клеточным эффектом”, наблюдается при многих процессах разложения в растворе. Если молекула R-Z-R' (Z=N2, CO и др.) распадается термически, то реакция из колебательно-возбужденного основного состояния ведет при отщеплении Z к паре радикалов с антипараллельными спинами. Аналогично происходит распад из S1 состояния:  Если же связи разрываются в возбужденном триплетном состоянии, то образуются радикалы с параллельными спинами: 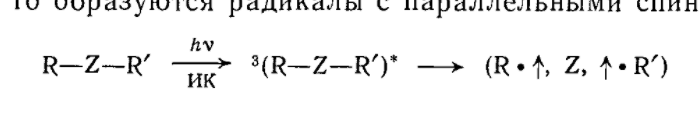 Чем больше концентрация прибавляемой соли, не имеющих общих ионов с малорастворимым электролитом, тем больше повышается его растворимость. Количественной мерой электростатических взаимодейстий между ионами в растворе может быть ионная сила раствора. Солевой эффект связан с увелечением ионной силы раствора. Ионная сила раствора определяется концентрациями и зарядами всех ионов в растворе. Чем больше концентрация ионов и больше величины их зарядов, тем больше ионная сила раствора. Она равна полусумме произведений молярных концентраций каждого иона на квадрат его заряда:  Так как ионную силу раствора можно изменит добавлением инертной соли, то это явление называют первичным солевым эффектом    Вторичный солевой эффект заключается в том, что внесенный электролит приводит к уменьшению коэффициентов активности слабых электролитов. Степень их диссоциации уменьшается, что приводит к снижению скорости реакции. 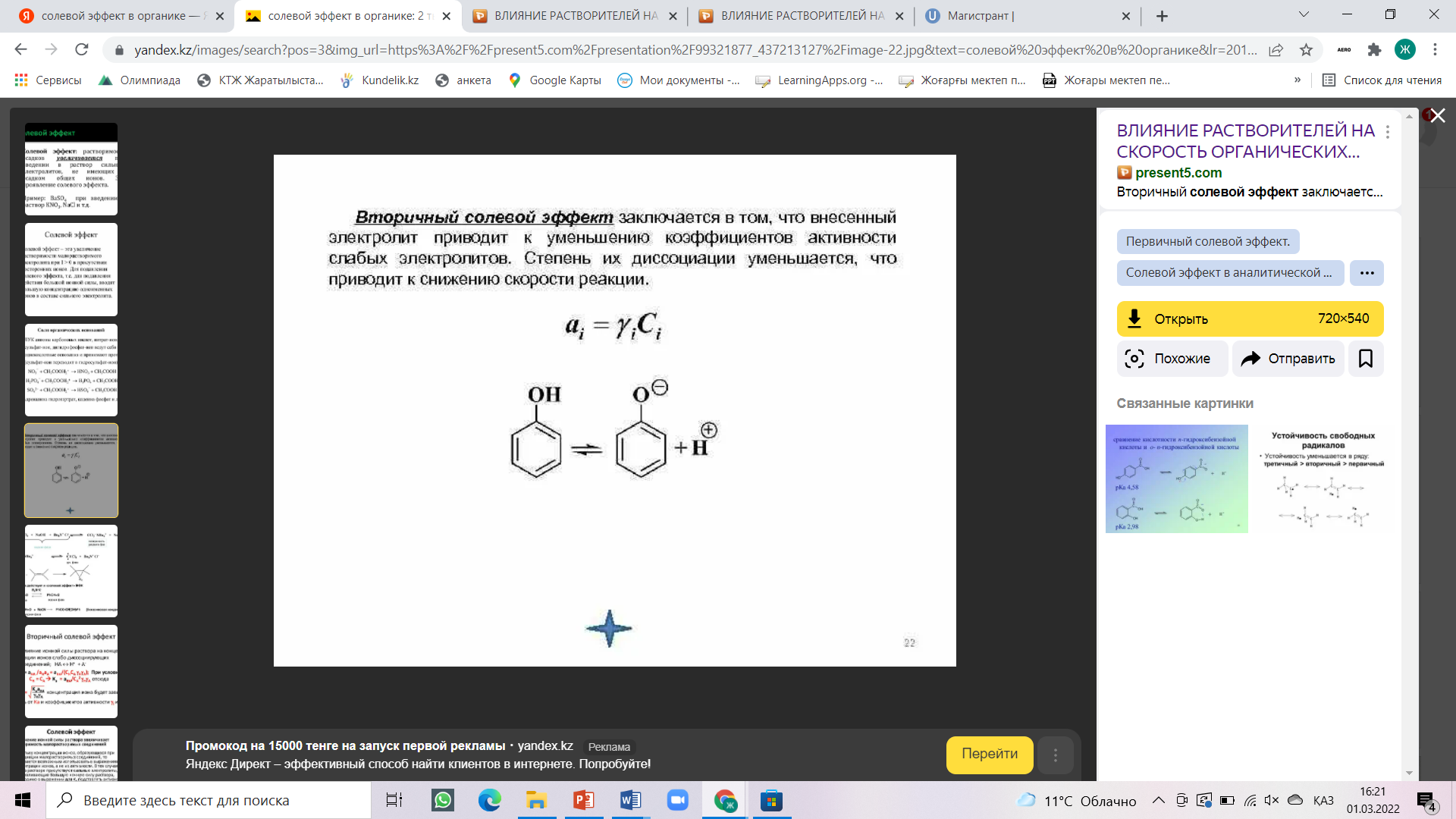 |
