Реальные газы. Лекция 7 (2 часа ) Реальные газы
 Скачать 271 Kb. Скачать 271 Kb.
|
Лекция № 7 (2 часа)Реальные газы1. Молекулярные силы и отступления от законов идеальных газов. Уравнение Ван-дер-Ваальса. 2. Изотермы газа Ван-дер-Ваальса и реального газа. 3. Критические параметры. Понятие о фазовых переходах (переход пар – жидкость). 4. Внутренняя энергия реального газа. Эффект Джоуля – Томсона. Уравнение Ван-дер-Ваальса Поведение реальных газов, таких как гелий, водород, азот, кислород хорошо описывается уравнением Менделеева-Клапейрона лишь до тех пор, пока суммарный объём молекул пренебрежимо мал по сравнению с объёмом сосуда, в котором заключён газ (низкие давления атмосферному и высокие температуры При повышении давления возникают заметные отклонения от уравнения Менделеева-Клапейрона. Так при р = 1000 атм. произведение pV отличается для азота при 0 ºС более, чем в 2 раза 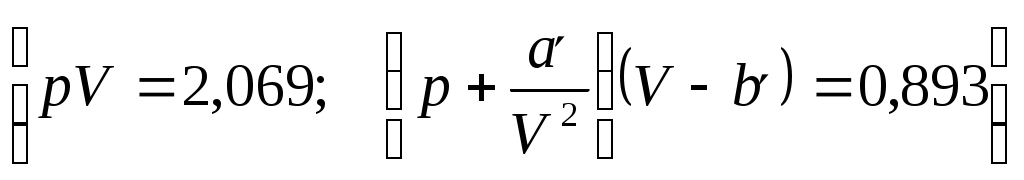 . .При увеличении плотности газов начинают играть всё возрастающую роль объём молекул и взаимодействие между ними на расстоянии. Модель идеального газа и уравнение Менделеева-Клапейрона становятся неприменимыми. В 1873 году голландский физик Ян Фридерик Ван-дер-Ваальс (1837-1923) предложил уравнение вида:  , (1) , (1)где Уравнение Ван-дер-Ваальса – не единственное уравнение состояния реального газа, для него предложено более 150 других уравнений. От уравнения  , написанного для одного моля газа, легко перейти к уравнению для произвольной массы газа m, т.е. количества вещества , написанного для одного моля газа, легко перейти к уравнению для произвольной массы газа m, т.е. количества вещества Заменив  . .Введём обозначение:  . (2) . (2)Постоянная С увеличением V роль поправок в уравнении Ван-дер-Ваальса становится всё менее существенной и в пределе это уравнение переходит в уравнение Реальные газы следуют уравнению Ван-дер-Ваальса лишь приближённо. Воображаемый газ, строго подчиняющийся уравнению (2) называется ван-дер-ваальсовским. Расчёт поправки на объём газа Д 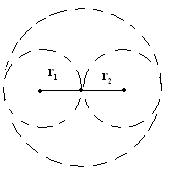 ве молекулы могут сблизиться на расстояния, не меньшие, чем сумма их радиусов. Тогда из всего объёма, занятого газом, надо исключить некоторую часть его b, пропорциональную объёму сферы, описанной радиусом ве молекулы могут сблизиться на расстояния, не меньшие, чем сумма их радиусов. Тогда из всего объёма, занятого газом, надо исключить некоторую часть его b, пропорциональную объёму сферы, описанной радиусом где Примем Тогда Изотермы газа Ван-дер-Ваальса и реального газа Наиболее интересные результаты уравнения Ван-дер-Ваальса путем анализа его изотерм. Уравнение  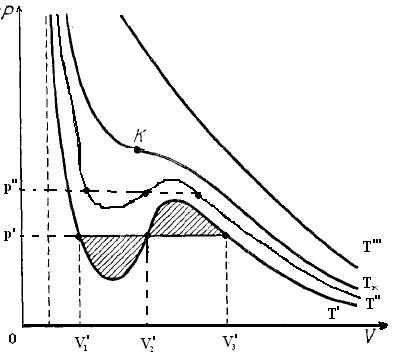 На рисунке изображены изотермы Ван-дер-Ваальса для нескольких значений температуры: при При повышении температуры точки, соответствующие значениям объёма Экспериментальные изотермы 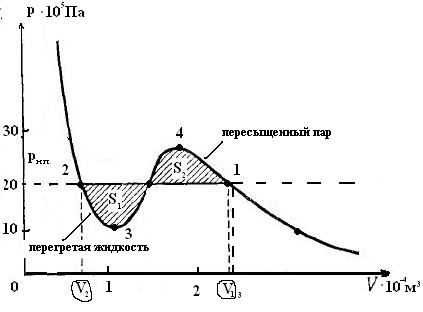 На экспериментальных изотермах отсутствует область, в которой вещество ведёт себя противоестественным образом. В области 3-4 увеличение объёма сопровождается ростом давления. Однородного вещества с такими свойствами быть не может. Поэтому приходится заключить, что в указанной области вещество становится неоднородным, т.е. как говорят, расслаивается на две фазы. В термодинамике фазой называется совокупность однородных, одинаковых по своим свойствам частей системы. (Например, вода-лёд-водяной пар – три фазы термодинамической системы). Чтобы получить изотерму опытным путём, нужно поместить газ в соединённый с манометром термостатированный сосуд, закрытый перемещающимся поршнем. Затем, вдвигая поршень (медленно!), делать одновременные отсчёты давления и объёма. На рисунке изображены результаты такого опыта для азота. Вначале с уменьшением объёма давление растёт, причём ход изотермы довольно хорошо описывается уравнением Ван-дер-Ваальса. Однако, начиная с объёма Таким образом, уравнение Ван-дер-Ваальса описывает не только газообразное состояние вещества, но охватывает также переход вещества в жидкое состояние. Из сопоставления экспериментальной изотермы с изотермой Ван-дер-Ваальса видно, что эти изотермы довольно хорошо совпадают на участках, соответствующих однородным состояниям вещества, но ведут себя совершенно различным образом в области расслоения на две фазы. Вместо S-образного участка изотермы Ван-дер-Ваальса у экспериментальной изотермы имеется горизонтальный участок. В 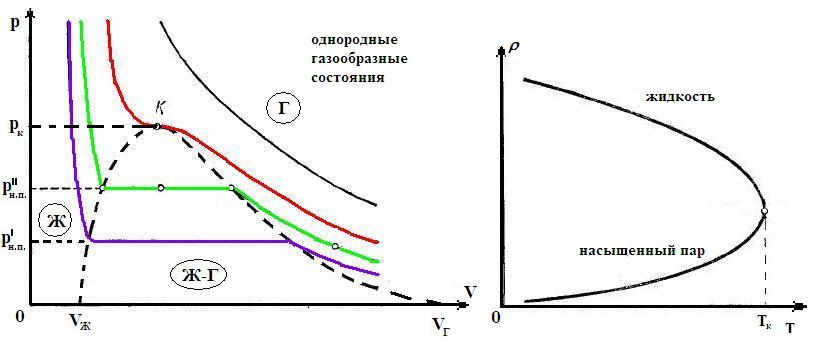 состояниях, соответствующих горизонтальному участку изотермы (экспериментальной), наблюдается равновесие между жидкой и газообразной фазами вещества. Газ, находящийся в равновесии со своей жидкостью, называется насыщенным паром. Давление состояниях, соответствующих горизонтальному участку изотермы (экспериментальной), наблюдается равновесие между жидкой и газообразной фазами вещества. Газ, находящийся в равновесии со своей жидкостью, называется насыщенным паром. Давление Из рис. видно, что с повышением Т горизонтальный участок изотермы сокращается и стягивается в точку К при критической температуре. Соответственно уменьшается различие в плотностях жидкости и насыщенного пара (рис. рядом). При критической температуре это различие полностью исчезает и вещество становится однородным. Колоколообразная кривая и участок критической изотермы, лежащей от точки К слева, делят диаграмму На участках 1-4 и 2-3 экспериментальной изотермы вещество в отношении зависимости давления от объёма ведёт себя нормально. Поэтому, действительно, при известных условиях состояния, соответствующие этим участкам, могут осуществляться. Однако, эти состояния не вполне устойчивы: достаточно, например, попадания в пар или жидкость пылинки для того, чтобы вещество распалось на две фазы. Подобные не вполне устойчивые состояния называются метастабильными. Вещество в состояниях 1-4 называется пересыщенным паром, а в состояниях 2-3 ― перегретой жидкостью. Критические параметры. Понятие о фазовых переходах (переход пар – жидкость) (дать на самостоятельное изучение!!!) Внутренняя энергия реального газа. Эффект Джоуля – Томсона Эта энергия слагается из внутренней энергии молекул, составляющих газ и кинетической энергии движения центра масс молекул, в сумме равной Потенциальная энергия притяжения равна работе, которую надо затратить против сил притяжения для того, чтобы молекулы развести на бесконечно большое расстояние друг от друга, когда взаимодействие между ними можно считать отсутствующим, а потенциальную энергию взаимодействия – равной нулю. Давление за счёт сил притяжения между молекулами в уравнении Ван-дер-Ваальса равно поэтому внутренняя энергия газа Ван-дер-Ваальса равна: Эту формулу можно получить и из термодинамики. Явление (эффект) Джоуля-Томсона В 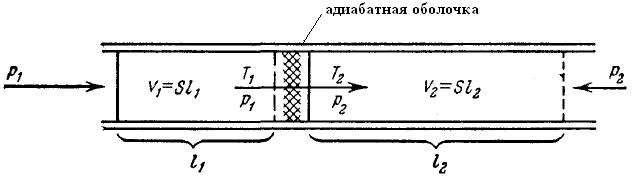 заключенной в адиабатную оболочку трубке помещена пробка из ваты. По одну сторону пробки находится газ при давлении заключенной в адиабатную оболочку трубке помещена пробка из ваты. По одну сторону пробки находится газ при давлении Вследствие разности давлений газ будет медленно перетекать через пробку из одной части трубки в другую. Поместив термометры по обе стороны пробки, можно определить знак изменения температуры в опыте Джоуля-Томсона. Оказалось, что для большинства газов при комнатной температуре происходит охлаждение, лишь для водорода и гелия наблюдается повышение температуры Рассмотрим причины этого явления. Пусть при давлении Рассмотрим два идеализированных предельных случая. 1) Предположим, что молекулы, обладая конечным объёмом, не взаимодействуют друг с другом на расстоянии. Тогда Тогда Изменение Рассмотрим другой предельный случай. Предположим, что объёмом молекул можно пренебречь, но их взаимодействие на расстоянии достаточно велико. Тогда в уравнении Ван-дер-Ваальса пренебрегаем поправкой b: 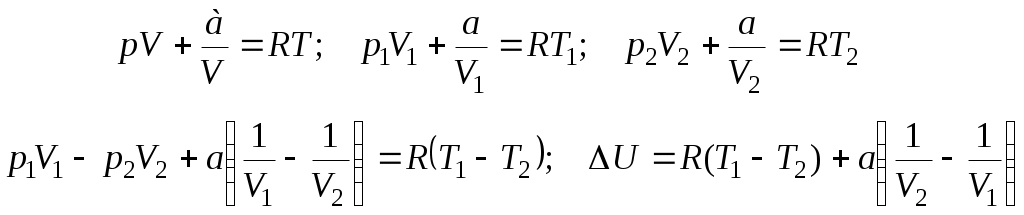 т.к. Следовательно, если взаимодействие молекул играет большую роль, чем их объём, то при расширении газа в опыте Джоуля-Томсона температура газа понижается. Последний случай, т.е. В общем случае нельзя пренебречь ни объёмом, ни взаимодействием молекул. Тогда для изменения температуры можно получить выражение Знак |
