Лекция прототипов. Лекция 12 - Протопласты. Лекция 9 Протопласты растительных клеток как объект биологического конструирования
 Скачать 219 Kb. Скачать 219 Kb.
|
|
Лекция 9 Протопласты растительных клеток как объект биологического конструирования 1 Применение изолированных протопластов 2 Способы получения и культивирования протопластов 3 Парасексуальная гибридизация 4 Виды соматических гибридов 5 Конструирование клеток 1 Применение изолированных протопластов Протопласт - клетка, лишенная целлюлозной оболочки, окруженная цитоплазматической мембраной, сохраняющая все свойства, присущие растительной клетке. Протопласты являются уникальной моделью для изучения фундаментальных физиологических проблем у растений. На схеме (рис.) представлены основные направления физиологических исследований с использованием культуры изолированных протопластов. Изолированные протопласты имеют ряд областей применения, как теоретического, так и прикладного характера: 1. Изучение химии и структуры клеточной стенки (и при разрушении, и при синтезе «de novo»). 2. Изучение свойств плазмалеммы: ее организация, функционирование, действие гормонов и патогенов на плазмалемму и протопласт, поступление через плазмалемму низкомолекулярных веществ, частиц, органелл. 3. «Мягкое» выделение органелл. 4. Наблюдение за закономерностями дифференцировки клеток при слиянии протопластов, отслеживание взаимодействия ядра и цитоплазмы в полученной гибридной клетке, изучение соматических гибридов. 5. Биологическое конструирование на уровне клетки (введение чужих органелл, чужеродной ДНК, микроорганизмов). 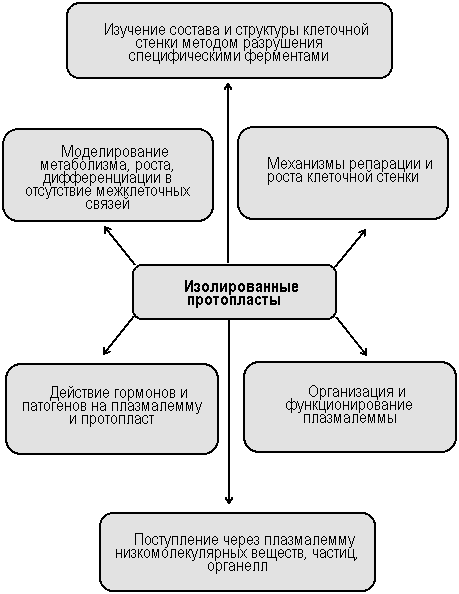 Рис. Изолированные протопласты – объект и модель в физиологических исследованиях (по Р.Г. Бутенко, 1981) 2 Способы выделения и культивирования протопластов Выделение протопластов Протопласты выделяют из клеток листьев, меристем, стеблей. Впервые протопласты в 1892 г. выделил Дж. Клеркер, который использовал механический способ. При этом способе у плазмолированных клеток разрезают клеточную стенку, протопласты выходят в среду. В настоящее время метод претерпел модификации, улучшен, но имеет ряд ограничений: – невысокая производительность; – можно использовать ткани только с экстенсивным плазмолизом; – трудоемкость и длительность. Другой метод выделения протопластов – энзиматический, с использованием ферментов. В 1952 году Салтон с помощью фермента лизоцима впервые разрушил клеточную стенку бактерий. В 1960 году Коккинг обработал кончики корней томата гидролитическим ферментом из культуральной жидкости плесневых грибов (Myrothecium verrucaria) и впервые получил изолированные протопласты высших растений энзиматическим способом. Преимущества энзиматического метода по сравнению с механическим: – одновременно выделяется большое количество протопластов (до 10 млн. из грамма ткани или клеток); – клетки не подвергаются сильному осмотическому стрессу; – клетки не повреждаются; – метод сравнительно быстрый. Для удаления клеточной стенки используют ферменты трех типов: целлюлазы, гемицеллюлазы и пектиназы. Комбинация ферментов и их соотношение специфично для каждого типа клеток. Выделение протопластов проводят в три этапа: – обработка ферментами; – выделение протопластов из клеточных стенок; – отделение интактных протопластов от клеточных осколков. Протопласты можно выделять также из суспензионных и каллусных культур. Лучше всего - в поздней стадии логарифмического роста, когда клеточные стенки легче поддаются разрушению, а протопласты наиболее жизнеспособны. Способы культивирования протопластов Далее протопласты культивируют в тех же условиях, что и клетки. Однако способы культивирования протопластов специфичны. Состав солей может быть несколько изменен. Среда состоит из осмотического стабилизатора (сахароза, глюкоза, ксилоза, маннитол и др.), неорганических соединений, источника углерода, азота, витаминов, фитогормонов. Условия культивирования: рН среды 5,4–5,8, температура 22–28оС, невысокая освещенность (не более 2000 лк). Существуют два способа культивирования протопластов: метод жидких капель и метод платирования. Метод жидких капель. Суспензию протопластов в виде капель помещают на пластиковые чашки Петри. Вариацией этого способа является культивирование единичных изолированных протопластов в микрокаплях объемом 1 мкл, предложенное Ю. Глебой в 1978 г. Метод платирования. Суспензию протопластов наливают в пластиковые чашки Петри, добавляют равный объем той же среды с 1% агаром при температуре не выше 45оС. После остывания чашки Петри переворачивают и культивируют при 28оС. В данном случае протопласты фиксированы в одном положении и физически отделены друг от друга. Это дает возможность наблюдать за развитием интактного протопласта: формированием клеточной стенки, делением, ростом и развитием растения. Вариантом этой техники является использование кормящих протопластов или клеток, подвергнутых воздействию рентгеновского или γ-излучения, что блокирует их способность к делению. Такие протопласты или клетки смешивают с жизнеспособными протопластами и они поддерживают и стимулируют их рост. Сразу после удаления раствора фермента начинается образование клеточной стенки. Труднее добиться деления клеток и регенерации растений. Регенерация растений происходит осуществляется либо через эмбриогенез, либо через развитие каллуса с дальнейшей индукцией морфогенеза. Добиваются этого добавлением в среду ауксинов или сочетания ауксинов с цитокининами. 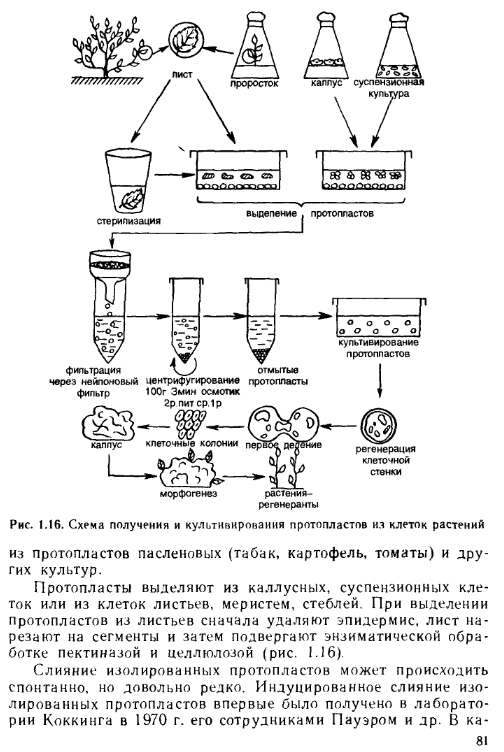 На пролиферацию клеток, возникших из протопластов, влияет 4 фактора: – видовая специфичность и физиологическое состояние исходной ткани растения; – способ и условия выделения протопластов; – плотность высева протопластов; – состав питательной среды. На сегодняшний день успешно осуществляется регенерация из протопластов пасленовых (табак, картофель, томаты), есть проблемы получения регенерантов у многих злаковых (до 2000 года не удавалось получить регенаранты). 3 Парасексуальная гибридизация Изолированные протопласты, еще не образовавшие клеточной стенки, могут сливаться между собой. Слияние протопластов – своеобразный метод гибридизации, так называемая парасексуальная, или соматическая гибридизация. В отличие от обычной гибридизации, где сливаются половые клетки (гаметы), в качестве родительских при парасексуальной гибридизации используются диплоидные клетки растений. Внеядерные генетические детерминанты (цитоплазматическая наследственность) у большинства высших растений наследуются в половом процессе строго одноядерно и матерински. Техника парасексуальной гибридизации может позволить. Возможности соматической гибридизации: – скрещивание филогенетически отдаленных видов растений (организмов), которые невозможно скрестить обычным половым путем; – получение асимметричных гибридов, несущих генный набор одного из родителей наряду с несколькими хромосомами, органеллами или цитоплазмой другого; – слияние трех и более клеток; – получение гибридов, представляющих сумму генотипов родителей; – перевод мутаций в гетерозиготное состояние, что позволяет получать жизнеспособные формы при слиянии протопластов, поскольку мутагенез довольно часто дает дефектное по морфогенезу растение; – получение растений, гетерозиготных по внеядерным генам и др. Парасексуальная гибридизация важна для анализа как ядерных генов, так и внеядерных геномов. Цитоплазматический геном кодирует ряд признаков – скорость фотосинтеза, устойчивость к патогенам, абиотическим факторам и т. д. Наличие косегрегация генов (признаки, контролирующие внеядерный геном, сегрегируют совместно) свидетельствует о физическом сцеплении генов. Слияние протопластов бывает спонтанным (чаще у протопластов из молодых тканей или суспензионных культур) и индуцированным. Для стимуляции слияния протопластов предложен ряд методов, как физических, так и химических. При физическом способе слияния протопластов, разработанном Г. Циммерманом с сотрудниками в 1981 году, протопласты помещают в камеру с неоднородным электрополем. На электродах образуются агрегаты из 2–3 протопластов, либо цепочки из 5–6 протопластов между электродами. Дополнительный единичный импульс постоянного тока приводит к образованию пор в сильно сжатых мембранах, происходит перетекание цитоплазмы, так как переменный ток удерживает протопласты вместе некоторое время, и протопласты в таких агрегатах сливаются. Затухающий ток приводит к возвращению сферической формы у слившихся протопластов. В основе электрослияния лежит различное действие постоянного и переменного электрического тока на плазмалемму. Постоянное эклектическое поле сжимает мембраны, ведя к их локальному разрушению, а переменное электрополе вызывает латеральную диффузию белков мембраны, образуя свободные от гликопротеидов липидные области, где противоположные мембраны могут установить контакт. Чаще для индукции слияния протопластов используют методику "ПЭГ - высокие значения рН – высокая концентрация Са2+", которая дает до 50% слившихся протопластов (рН 9 –11, концентрация Са2+ 100 – 300 ммоль/л). В присутствии полиэтиленгликоля наблюдается сильная адгезия протопластов, после удаления полиэтиленгликоля и добавления кальция - их слияние. Предполагают, что рН и ионы кальция увеличивают текучесть мембран, что связано с их жидкостно-мозаичной структурой. При слиянии протопластов различных растений, например, А и В, могут с равной вероятностью образовываться комбинации АА, ВВ и АВ. Желаемый продукт слияния – АВ, поэтому разрабатываются способы увеличения частоты слияния именно такого типа и избирательного выделения только продукта слияния АВ. Один из таких методов заключается в следующем. Поверхность протопласта обычно несет отрицательный заряд. Путем обработки ее фосфолипидом, несущим положительный заряд, можно временно придать поверхности протопласта положительный заряд. Если теперь протопласты А, имеющие положительный заряд, смешать с необработанными протопластами В, несущими отрицательный заряд, то будут в основном образовываться комбинации АВ в результате притяжения разноименных зарядов. Протопласты могут сливаться как попарно, так и в большем количестве. Многоядерные продукты слияния, как правило, разрушаются. Первое сообщение о получении соматических гибридов на уровне растений появилось в 1972 году (Карлсон и коллеги), в нашей стране подобное осуществили в лаборатории Бутенко Р.Г. в 1975 году. Судьба геномов (ядерного и цитоплазматического) после слияния протопластов может быть различной: 1. Ядерные генетические детерминанты наследуются как дву-, так и однородительски. В последнем случае ядра не сливаются и впоследствии сегрегируют в процессе клеточных делений. 2. Внеядерные генетические детерминанты наследуются двуродительски. При этом в межвидовых комбинациях прослеживается тенденция к соматическому выщеплению и элиминации одного из родительских цитоплазматических геномов. 3. Возникновение гибридных клеток и растений в результате слияния более чем двух родительских клеток. Таким образом, Слияние протопластов приводит к образованию: – гибрида; – цибрида; – асимметричного гибрида. Соматический гибрид – продукт слияния и цитоплазмы, и ядра обоих протопластов. Цибрид (цитоплазматический гибрид) – растение-регенерант, содержащее цитоплазму обоих родителей и ядро одного из них. Цибриды получают, облучая перед слиянием один из протопластов γ-лучами для разрушения ядра. Скрининг таких клеток проводится по генам – маркерам ядерного и цитоплазматических (митохондриального и хлоропластного) геномов. Есть указания на рекомбинацию ДНК митохондрий и хлоропластов в гибридных клетках (Ю.Ю. Глеба, К.М. Сытник, 1984). Цибридизация позволяет ввести цитоплазматические гены, несущие признаки цитоплазматической мужской стерильности, устойчивости к гербицидам и патогенам. Асимметричные гибриды – продукты слияния, имеющие полный хромосомный набор одного из партнеров и часть хромосом другого партнера. Такие гибриды часто возникают при слиянии клеток организмов, филогенетически удаленных друг от друга. В этом случае вследствие неправильных делений клетки, обусловленных некоординированным поведением двух разнородных наборов хромосом, в ряду поколений теряются частично или полностью хромосомы одного из родителей. Асимметричные гибриды бывают устойчивее, плодовитее и жизнеспособнее, чем симметричные, несущие полные наборы генов родительских клеток. В целях асимметричной гибридизации возможна избирательная обработка клеток одного из родителей для разрушения части его хромосом. Возможен прицельный перенос в клетку нужной хромосомы. Асимметричные гибриды могут быть получены путем слияния трех и более родительских клеток. Из таких гибридных клеток могут выращены растения – регенеранты. 4 Виды соматических гибридов Впервые зрелый межвидовой гибрид, полученный в результате парасексуальной гибридизации протопластов 2 сортов табака (Nicotiana glauca, c 24 хромосомами и N.langsdorfii c 18 хромосомами), описан Карлсоном в 1972 г. Каллус амфиплоидного гибрида мог расти на безгормональной среде. Гибридное растение цвело. С тех пор были получены жизнеспособные внутривидовые, межвидовые, межродовые гибриды табака. Осуществлено слияние протопластов культурного картофеля сорта Приекульский ранний (Solanum tuberosum) с протопластами дикого картофеля (S. chacoense). Известно, что у дикого картофеля клубни очень мелкие. Вместе с тем, растение устойчиво ко многим заболеваниям. Картофель сорта Приекульский ранний образует крупные клубни, но растения этого сорта восприимчивы к болезням. Размеры протопластов у этих растений разные. Соматические гибриды по форме листьев и кустов, размеру клубней занимали промежуточное положение между культурными и дикими растениями. Вместе с тем гибрид, полученный в результате соматической гибридизации, оказался устойчивым к вирусу «У», чем отличался от полового гибрида. Первая попытка по созданию межродовых гибридов принадлежит Г. Мельхерсу, создавшему в 1978 году гибрид картофель + томат, так называемый томатофель. Гибрид был стерилен, морфологически аномален: толстые корни, отсутствие типичных столонов, махровые цветки. Было еще несколько попыток получения таких гибридов, но все растения стерильны. Эти эксперименты показали ограниченность применения парасексуальной гибридизации для прикладной селекции. Японскими исследователями (Х. Кисака с соавт., 1997) путем электрослияния протопластов ячменя и риса был получен межродовой соматический гибрид. Протопласты риса получали из суспензионной культуры, а протопласты ячменя были изолированы из молодых листьев. Часть полученных каллусов сформировали зеленые участки и побеги. Только один побег сформировал корни, и это растение было успешно перенесено в почву. По морфологии было близко к растениям риса. Цитологический анализ показал, что растение имело и маленькие хромосомы от риса, и большие от ячменя. Были проанализированы также митохондриальная и хлоропластная ДНК. Растение содержало новые последовательности и в митохондриальной, и в хлоропластной ДНК, которые не обнаруживались ни в одном из родителей. Ю. Ю. Глеба с сотрудниками проводили многочисленные эксперименты по созданию межтрибных гибридов. Триба – таксономическая единица между семейством и родом. Получены гибриды между Arabidopsis и Brassica (турнепс) – Arabidobrassica. У гибридных линий индуцировали морфогенез корней и растения. Растения генетически и морфологически неоднородны, не цвели. На вид – уродливы, очень много тератомоподобных образований, похожих на цветки. Некоторые из регенерантов получили название «растение-монстр». Была осуществлена гибридизация 2-х родов пасленовых Datura innoxia + Atropa belladonna. Удалось регенерировать растения. Во всех случаях выявлены хромосомы обоих родительских видов. Амфиплоиды оказались неспособны к стеблевому морфогенезу, в линиях с полиплоидным и анеуплоидным наборами хромосом получали аномальные стебли. Регенерировавшие растения были стерильны, похожи на дурман, но содержали небольшое количество хромосом красавки. В других экспериментах сливали протопласты красавки с каллусными клетками китайского табака. Получили 12 клонов. В клетках всех клонов обнаружили хромосомные типы обоих родителей, через год только у двух клонов происходила полная элиминация хромосом красавки. Морковь + сныть: из образовавшейся каллусной ткани через полгода регенерировали аномальные растения. Одно из них цвело, но у цветка отсутствовали пыльники и пестик. Первые работы по получению межсемейственных гибридов проведены К.Као и В.Веттером в 1976–77 гг. (соя + табак). Позднее в лаборатории Ю.Ю.Глебы провели аналогичные эксперименты пасленовые + бобовые и лилейные (горошек + табак и лук + табак). И.Ф.Каневскому удалось индуцировать морфогенез стеблеподобных тератом в культуре межсемейственных гибридов N.tabacum + Vicia faba. Практически у всех видов соматических гибридов наблюдали цитогенетические изменения, такие как: – видоспецифичная элиминация хромосом одного из родителей; – в культурах межсемейственных гибридов отмечали много многоядерных клеток, клеток с мини ядрами, в метафазах делений встречались гигантские хромосомы; – отмечена асинхронность в расхождении родительских хромосом в анафазе; – морфогенез у такого материала отмечен не был. Вывод: для отдаленных соматических гибридов характерно (свойства): 1 Относительная стабильность гибридного состояния, при котором не наблюдается полной элиминации генетического материала одного из родителей. 2 Генетические перестройки (реконструкция и частичная элиминация хромосом). 3 Генетическая разнокачественность клонов гибридных клеток. 4 Ограниченная морфогенетическая способность. Изучение межцарственных гибридов клеток "животное + растение" показало, что на этапе слияния видоспецифичность не проявляется, поэтому можно слить даже животную и растительную клетки. На более поздних этапах онтогенеза эти различия сказываются, что было установлено в экспериментах по слиянию протопластов арабидопсиса и табака с лимфоцитами человека. При этом происходило слияние цитоплазмы, ядра не сливались. Эдвард Коккинг параллельно проводил изучение ультраструктуры таких гибридов, работая с клетками амфибий и протопластами моркови. После объединения клеток ядра амфибии были окружены тонким слоем собственной цитоплазмы, но уже через 48 часов отмечалось полное смешивание цитоплазмы и регенерация клеточной стенки вокруг гетерокариона. 5 Конструирование клеток Протопласты широко используются в качестве реципиентов для клеточных органелл. В 1973 году И. Потрикусс и Ф. Хоффман успешно трансплантировали изолированные ядра петуньи в протопласты табака. Кроме ядра трансплантируют и другие органеллы, такие как митохондрии и хлоропласты. Выбор этих органелл объясняется их полуавтономностью, то есть наличием собственной ДНК и способность делиться самостоятельно, независимо от деления самой клетки. Кроме того, эти органеллы контролируют важнейшие физиологические процессы растительной клетки, такие как фотосинтез и дыхание. Например, перенос хлоропластов может использоваться для выведения новых форм хозяйственно важных сортов растений. Трансплантация высокоэффективных хлоропластов может способствовать активации фотосинтеза и повышению продуктивности растения. Одним из важных моментов является сохранение клеточных органелл, поэтому для переноса их в последнее время используются субпротопласты – фрагменты, полученные из протопластов. Они могут содержать большую часть цитоплазмы, но без ядра (цитопласты), ядро с небольшим количеством цитоплазмы (кариопласты), часть хромосом с небольшим количеством цитоплазматического материала (микропротопласты). Каким образом можно ввести ядро или другие клеточные органеллы в протопласт? Способы трансплантации ядра и других клеточных органелл в протопласт: 1 При использовании сэндвич-метода трансплантацию проводят в условиях слабого деплазмолиза протопласта. 2 Посредством липосом. Широкий спектр одно- и многоламелльных частиц, которые сливаются с мембранами протопластов, получен с применением таких веществ, как фосфатидилсерин, холистерол и т.д. 3 Путем микроинъекций. Этот метод сначала широко использовался для введения в клетку ДНК, РНК, а затем был успешно использован и для переноса клеточных органелл у растений. Биологическое конструирование на уровне клетки может оказаться полезным и перспективным для создания клеток, клеточных систем и целых растений, удовлетворяющих потребности человека. Под биологическим конструированием следует понимать не только введение отдельных органелл (рис. 16). Аналогичным образом в клетку можно вводить и чужеродный генетический материал как в виде фрагментов ДНК, так и в виде отдельных хромосом. Кроме того, в изолированные протопласты можно вводить клетки микроорганизмов, создавая таким образом искусственные клеточные ассоциации. |
