занятие 3. Лпз 3 Дисперсные системы. Получение и свойства лиофобных золей
 Скачать 258.45 Kb. Скачать 258.45 Kb.
|
|
ЛПЗ 3 Дисперсные системы. Получение и свойства лиофобных золей. 1. Дисперсная система. Степень дисперсности. 2. Классификация дисперсных систем: 1) по степени дисперсности коллоидных систем; 2) по степени взаимодействия между дисперсной фазой и дисперсионной средой; 3) по агрегатному состоянию фазы и среды (аэрозоли, лиозоли, солидозоли). 3. Методы получения лиофобных золей по подвижности дисперсной фазы (конденсационные и дисперсионные; физические и химические). Привести примеры. Пептизация. 4. Методы очистки лиофобных золей: диализ, электродиализ, ультрафильтрация, обратный осмос. 5. Строение мицеллы. Механизм возникновения двойного электрического слоя. Селективная адсорбция ионов. Правило Панета – Фаянса. Зависимость адсорбционной способности ионов от заряда, размеров и степени гидратации. Электрокинетический потенциал коллоидных частиц, его зависимость от присутствия электролитов; методы определения. Электрокинетические свойства. Открытие явлений электрофореза и электроосмоса (работы Рейса). Электрофорез. Уравнение Гельмгольца – Смолуховского. Электрофоретическая подвижность. Электрофоретические методы исследования в медицине. Иммуноэлектрофорез. Электроосмос и его практическое применение в медицине. Теоретическая часть Дисперсная система (ДС) — это система, в которой хотя бы одно вещество находится в раздробленном состоянии. ДС имеет два характерных признака: гетерогенность и дисперсность. Гетерогенность означает, что система состоит как минимум из двух фаз. Особенность ДС состоит в их дисперсности — одна из фаз обязательно должна быть раздробленной, ее называют дисперсной фазой. Сплошная среда, в которой раздроблена дисперсная фаза, называется дисперсионной средой. Фаза считается дисперсной, если вещество раздроблено хотя бы в одном направлении. Характерным свойством ДС является наличие большой межфазной поверхности. В связи с этим определяющими являются свойства поверхности, а не частиц в целом. Характерными являются процессы, протекающие на поверхности, а не внутри фазы. Классификация ДС Классификация ДС может быть проведена на основе различных свойств. Классификация по степени дисперсности. ДС делятся на: - грубодисперсные системы, d > 10 -3 см; - микрогетерогенные системы, 10-5< d < 10-3 см; - коллоидно-дисперсные системы или коллоидные растворы, 10-7< d < 10-5 см; - истинные растворы, d < 10-7 см. Необходимо подчеркнуть, что самую большую удельную поверхность имеют частицы дисперсной фазы в коллоидных растворах. 2. Классификация по агрегатному состоянию фаз Классификация по агрегатному состоянию фаз была предложена Вольфгангом Оствальдом. В принципе возможно 9 комбинаций. Представим их в виде таблицы.  3.Классификация по взаимодействию дисперсной фазы и дисперсионной среды (ПО МЕЖФАЗНОМУ ВЗАИМОДЕЙСТВИЮ) Эта классификация пригодна только для систем с жидкой дисперсионной средой. Фрейндлих предложил подразделить ДС на два вида: - лиофобные, в них дисперсная фаза не способна взаимодействовать с дисперсионной средой, а, следовательно, и растворяться в ней, к ним относятся коллоидные растворы, микрогетерогенные системы; - лиофилъные, в них дисперсная фаза взаимодействует с дисперсионной средой и при определенных условиях способна в ней растворяться, к ним относятся растворы коллоидных ПАВ и растворы ВМС. 4. Классификация по межчастичному взаимодействию Согласно этой классификации ДС подразделяют на: - свободнодисперсные (бесструктурные); - связнодисперсные (структурированные). В свободнодисперсных системах частицы дисперсной фазы не связаны друг с другом и способны независимо передвигаться в дисперсионной среде. В связнодисперсных системах частицы дисперсной фазы связаны друг с другом за счет межмолекулярных сил, образуя в дисперсионной среде своеобразные пространственные сетки или каркасы (структуры). Частицы, образующие структуру, не способны к взаимному перемещению и могут совершать только колебательные движения. Методы получения коллоидных растворов (золей) Все методы получения дисперсных систем сводятся либо к объединению молекул или ионов в агрегаты дисперсной фазы, либо к доведению частиц вещества до определенной степени дисперсности.   Методы получения Методы получения
В соответствии с этим получение дисперсных систем осуществляется конденсацией и диспергированием. В основе этих методов лежат два противоположных процесса – агрегация более мелких частиц (конденсация) и дробление более крупных частиц (диспергирование), приводящих к единому результату – образованию дисперсных систем. Конденсационные методы получения лиофобных коллоидов Взаимодействие ионов и молекул с образованием частиц коллоидных размеров может быть достигнуто физическими и химическими методами. Химическая конденсация Метод окисления. В результате реакции окисления может быть получен коллоидный раствор, например: 2H2S + SO2 → 3S↓ + 2H2O. Образующиеся атомы нейтральной серы затем самопроизвольно конденсируются в коллоидные частицы серы: {[S] m nHS – (n-x) H+ } x– xH + . Реакция восстановления. На реакции восстановления основан один из наиболее распространенных химических методов получения коллоидных растворов металлов. В качестве восстановителей обычно используются вещества, обладающие восстанавливающими свойствами, как, например, газообразный водород, формалин, танин. Например, реакции получения золя серебра восстановлением разбавленных растворов солей серебра в щелочной среде танином (С76Н52О46 ): 2AgNO3 +K 2CO3 →Ag 2O + 2KNO3 + CO2 3 Ag 2O + С76Н52О46 →6Ag ↓+ С76Н52О49 Строение мицеллы данного золя можно представить следующей схемой: {[Ag] m m Ag2O nAgO – (n-x) K + } x– xK + . В медицине применяются коллоидные препараты серебра – колларгол, протаргол. Красный золь золота, применяемый в медицине, получают восстановлением натриевой соли золотой кислоты формальдегидом: NaAuO2 + HCOH + Na 2CO3 →Au↓ + HCOONa + H2O. Строение мицеллы данного золя можно представить следующей схемой: {[Au] m · nAuO2 – · (n-x) Na + } x– xNa + . Реакция обмена. В результате реакции обмена образуется новое малорастворимое вещество, способное сохраняться в высокодисперсном состоянии при наличии ряда соответствующих благоприятных условий (концентрация реагирующих веществ, примеси и др.). Примером может служить получение золя сернистого мышьяка: 2H3 AsO3 + 3H2S →As2S3 ↓ + 6H2O, {[ As2S3]m nНS – · (n-x)Н + } x– xН+ Реакция гидролиза. Гидролизом широко пользуются при получении золей из солей, если в результате реакции гидролиза образуются плохо растворимые вещества. Так, например, нерастворимый гидроксид железа(III) получается при гидролизе хлорида железа(III) при температуре 1000С по уравнению: FeCl3 + 3H2O →t Fe(OH)3 ↓+ 3HCl. Образующийся на поверхности его частиц оксохлорид железа(III), Fe(OH)3 + HCl →FeOCl + 2H2O, диссоциирует на ионы: FeOCl → FeO + +Cl – , которые образуют двойной электрический слой вокруг частиц Fe(OH)3 и удерживают их во взвешенном состоянии: {[Fe(OH)3 ] m nFeO + (n–x)Cl – } x+ xCl – . Физическая конденсация Метод замены растворителя. Метод основан на выделении растворенного вещества из раствора в виде высокодисперсной нерастворимой фазы путем замены растворителя. Молекулы растворенного вещества, находящегося в состоянии молекулярной дисперсности в одном растворителе, попадая в условия малой растворимости при замене растворителя, начинают конденсироваться в более крупные коллоидные частицы. Данным методом можно приготовить золи серы, холестерина, канифоли, мастики при вливании спиртовых растворов этих веществ в воду. Диспергационные методы получения дисперсных систем Диспергированием называют тонкое измельчение твердых материалов или жидкостей и распределение их частиц в жидкой или газообразной среде, в результате чего образуются порошки, суспензии, эмульсии, аэрозоли. Механические методы. Для дробления веществ в лабораториях и на производствах применяются устройства, работающие по принципу ударного размельчения и растирания, диспергируемых материалов; к таким устройствам относятся шаровые и коллоидные мельницы. Ультразвуковой метод. Диспергирующее действие ультразвука связано с тем, что при прохождении звуковой волны в жидкости происходят локальные быстро сменяющиеся сжатия и растяжения, которые создают разрывающее усилие и приводят к диспергированию взвешенных частиц. Таким путем получают высокодисперсные эмульсии и суспензии, в том числе пригодные для внутривенного введения. Кроме того, при действии ультразвука на коллоидные растворы, эмульсии, суспензии происходит их стерилизация, так как кавитация (образование пузырьков) вызывает разрушение тел микроорганизмов и их спор. Кавитация возникает во время ударной волны при липотрипсии и играет важную роль при разрушении камней в почках. Электрический метод. Метод получения коллоидных растворов при помощи электричества, который предложен Бредигом (1898), можно использовать главным образом, для приготовления гидрозолей благородных металлов. Этот метод основан на получении электрической дуги между электродами, состоящими из диспергируемого металла (серебра, золота). Под воздействием высокой температуры происходит испарение материала электродов в дисперсионной водной среде. Затем пары металла конденсируются в коллоидные частицы, образуя соответствующий золь. Процесс проводят при охлаждении. Метод самопроизвольного диспергирования. Этот метод может быть использован для получения растворов высокомолекулярных веществ из твердых полимеров диспергированием их в соответствующих растворителях, как, например, при растворении в воде крахмала, гуммиарабика, желатина, сухого белка, агар-агара. Метод самопроизвольного диспергирования твердого вещества в жидкой среде приводит к образованию двухфазной устойчивой коллоидной системы. Самодиспергирование совершается без внешних механических воздействий на этот процесс; так, например, некоторые масла могут самопроизвольно эмульгироваться в воде при наличии в среде стабилизатора (15 – 35% натриевого мыла). Пептизация. Многие осадки, практически нерастворимые в воде, переходят в коллоидный раствор при действии на них некоторых веществ. Этот старый классический метод получения золей разрабатывался впервые биохимиками, которые назвали его пептизацией, а прибавляемое вещество – пептизатором. В отличие от других методов получения золей при пептизации не происходит изменение степени дисперсности частиц, а наблюдается только их разрыхление. При пептизации из осадка удаляются коагулирующие ионы или пептизатор адсорбируется коллоидными частицами осадка, что ведет к образованию двойных электрических слоев (ДЭС) или сольватных оболочек вокруг коллоидных частиц и преобладанию благодаря им сил сцепления между частицами. Затем частицы равномерно распределяются во всем объеме жидкости. Таким образом, пептизация является процессом, обратным коагуляции. Пептизация протекает при достаточном количестве пептизатора в начальный период быстро, затем замедляется. Скорость пептизации возрастает при перемешивании, так как при этом ускоряется проникновение пептизатора внутрь агрегатов. Повышение температуры также ускоряет пептизацию. При пептизации наблюдается зависимость между количеством пептизированного вещества, взятого осадка и пептизатора. Эта закономерность, называемая правилом осадка, заключается в том, что при постоянном содержании пептизатора с возрастанием количества взятого для пептизации осадка, количество осадка, перешедшего в раствор сначала увеличивается, а затем уменьшается. Объяснение правила осадка заключается в следующем. Для пептизации одной частицы осадка требуется некоторое минимальное количество пептизатора. При введении первых порций осадка, в системе пептизатора много, а осадка мало и он легко переходит в золь. При дальнейшем добавлении осадка на одну его частицу приходится все меньше пептизатора и коллоидное растворение замедляется. Затем, когда пептизирующего вещества в системе станет много, осадок не только перестает растворяться, но даже выпадает уже растворившийся осадок, так как пептизатора не хватает для того, чтобы частицы находились в растворе. Различают следующие виды пептизации: пептизация промыванием осадка; пептизация осадка электролитом; пептизация поверхностно-активными веществами; химическая пептизация. Образование и строение частиц дисперсной фазы Частицы дисперсной фазы в ультрамикрогетерогенных системах (золях) вместе с двойным электрическим слоем называют мицеллами. В качестве примера приведем образование мицелл золя AgCl, полученного реакцией AgNО3 с КС1 при соблюдении двух условий: растворы реагентов должны быть разбавленными и одно из веществ берется в избытке, например, когда к раствору КС1 постепенно, по каплям добавляется раствор AgNО3, т. е. в системе имеется избыток КС1. AgNО3 + КСl изб—► AgCl + KN03 При образовании кристаллов AgCl на их поверхности избирательно адсорбируются ионы Сl- — потенциалопределяющие. Противоионы К+ будут находиться в плотном адсорбционном и в диффузном слоях. В этом случае образуются мицеллы отрицательного золя AgCl, строение которых схематично можно изобразить так: 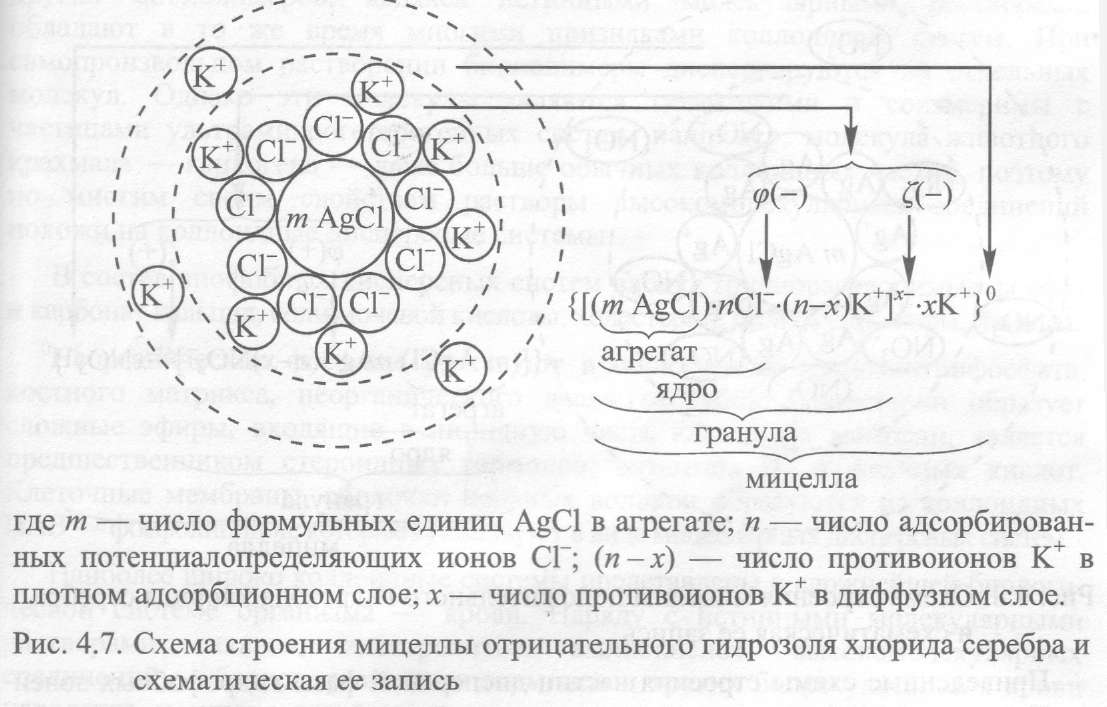 Внутреннюю часть мицеллы составляет кристаллический агрегат вещества дисперсной фазы — AgCl. Агрегат вместе с потенциалопределяющими ионами (С1-) составляют ядро мицеллы. На его поверхности возникает φ-потенциал, в данном случае он отрицательный. Ядро с противоионами (К+) плотного адсорбционного слоя образуют гранулу. На поверхности гранулы возникает ϛ-потенциал, он одного знака с φ-потенциалом. В данном случае ϛ-потенциал отрицательный и гранула тоже заряжена отрицательно. Гранулу окружают гидратированные противоионы диффузного слоя. Гранула вместе с диффузным слоем составляют мицеллу. Мицелла в отличие от гранулы электронейтральна. Если реакцию нитрата серебра с хлоридом калия проводить в других условиях, а именно: к раствору AgNО3 по каплям добавлять раствор КС1, то в системе в избытке будет AgNО3. AgNО3 изб + КС1 —► AgCl + KN03 Кристаллы AgCl образуются и в этом случае, но на их поверхности теперь будут избирательно адсорбироваться ионы Ag+, а ионы N03- станут противоионами. В этих условиях образуются мицеллы положительного золя AgCl. 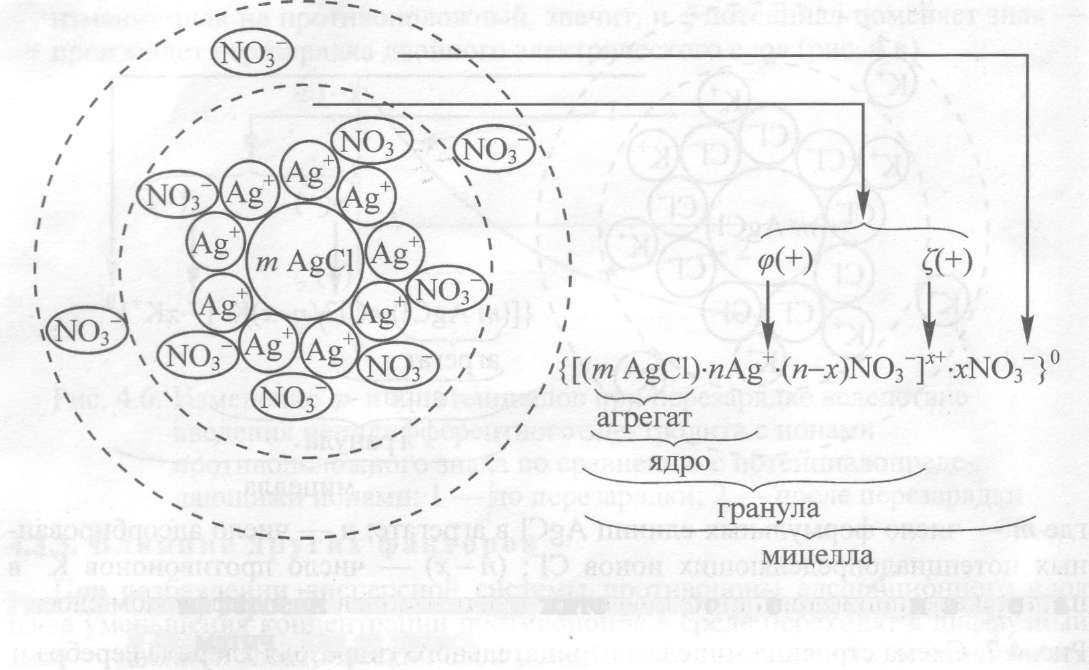 Таким образом, избыток одного из электролитов в рассмотренных случаях — необходимое условие образования коллоидных частиц. Во-первых, этот избыток ограничивает рост кристаллических агрегатов, определяя коллоидные размеры частиц (10 7-10-8см); во-вторых, именно из него возникает ДЭС с определенным ϛ — потенциалом, препятствующим сближению частиц, т. е. избыток электролита является стабилизатором образующихся золей.* Дисперсные системы организма Один из основателей российской школы коллоидной химии ИИ Жуков в свое время произнес афористическую фразу: "Человек — это ходячий коллоид". Действительно, в любом животном или растительном организме представлены практически все коллоидные дисперсные системы: как лиофильные, так и лиофобные, связнодисперсные и свободнодисперсные. К лиофильным относятся системы, содержащие белки, полисахариды, нуклеиновые кислоты. В организме эти биополимеры находятся или в виде связнодисперсных систем, или в виде истинных растворов. Примерами связнодисперсных систем такого типа являются цитоплазма, вещество мозга, водянистое содержимое глазного яблока, мышцы и другие органы. Белки в виде растворов входят в состав крови, лимфы, спинномозговой жидкости. Отнесение истинных растворов белков к дисперсным системам не противоречит понятию о коллоидном состоянии вещества. Растворы белков и других биополимеров, являясь истинными молекулярными растворами, обладают в то же время многими признаками коллоидных систем. При самопроизвольном растворении биополимеры диспергируются до отдельных молекул. Однако эти молекулы являются гигантскими и соизмеримы с частицами ультрамикрогетерогенных систем, например, молекула животного крахмала — гликогена — даже больше обычных коллоидных частиц, поэтому по многим своим свойствам растворы высокомолекулярных соединений похожи на коллоидные дисперсные системы. В состав лиофобных дисперсных систем входят труднорастворимые фосфат и карбонат кальция, соли мочевой кислоты, холестерин, билирубин, жиры, липиды. Неорганические фосфаты участвуют в образовании аденозинтрифосфата, костного матрикса, неорганического вещества зубов. Холестерин образует сложные эфиры, входящие в липидную часть клеточных мембран, является предшественником стероидных гормонов, витамина D3 и желчных кислот. Клеточные мембраны, оболочки нервных волокон образуются из коллоидных ПАВ — фосфолипидов, которые существуют в виде мицеллярных дисперсных систем. Наиболее широко коллоидные системы представлены в сложнейшей биологической системе организма — крови. Наряду с истинными молекулярными растворами Сахаров, электролитов, аминокислот, высокомолекулярных соединений — белков, различных гормонов и других биорегуляторов в крови находятся и ультрамикрогетерогенные системы — золи фосфатов кальция, холестерина, билирубина, уратов, жиров, фосфолипидов, и газовые эмульсии кислорода, азота и диоксида углерода, и суспензии форменных элементов крови — эритроцитов, тромбоцитов, лейкоцитов, а также дисперсные системы, содержащие гены, вирусы, микроорганизмы. ПРАКТИЧЕСКАЯ ЧАСТЬ: Выполнить следующие задания: Охарактеризуйте приведенные ниже дисперсные системы по агрегатному состоянию фаз (в виде дроби г/ж, т/ж и т.д.) по структуре (свободнодисперсные, связанодисперсные) по дисперсности (грубодисперсные, микрогетерогенные, коллоидные р-ры, истинные р-ры): туман, аэрозоль твердого лекарства, сливочное масло, золь гидроксида железа (III) в воде, гель кремневой кислоты, суспензия тромбоцитов в крови. Какие из этих систем можно отнести к лиофильным, а какие к лиофобным? грубодисперсные системы, микрогетерогенные системы, коллоидные растворы, истинные растворы Решите задачи: Напишите формулу мицеллы коллоидного раствора сульфата бария, полученного методом химической конденсации при взаимодействии BaCl2 и Na2SО4 в водной среде. Золь иодида серебра получен методом химической конденсации при избытке нитрата серебра. К какому электроду будет двигаться частица при электрофорезе? Напишите формулу мицеллы золя. При достаточно медленном введении йодида калия в разбавленный раствор нитрата ртути (I) возможно образование гидрозоля Hg2J2. Напишите формулу мицеллы и укажите знак электрического заряда коллоидных частиц этого золя. Какое из рекомендованных веществ является наиболее экономичным коагулятором этого золя. Коагулятор: нитрат калия, нитрат аммония, йодид цинка. |
