Уральский федеральный университет имени первого Президента России Б. Н. Ельцина.
Группа: НМТ-101805
Дисциплина: Аналитическая химия
РЕФЕРАТ
Тема: классификация и особенности коллоидных систем
Преподаватель: Сараева С.Ю.
Студент: Попов Арсений Александрович
Введение
Коллоидные системы (от греч. kolla - клей и eidos – вид) aнгл. colloid systems; нем. Kolloidsysteme; фр. systemes colloidaux; исп., ит. sistemas coloidales, sistemas coloideas), коллоидно-дисперсные системы, коллоиды, - ультрамикрогетерогенные системы, представляющие собой совокупность множества мелких частиц дисперсной фазы, распределённых в объёме непрерывной дисперсионной среды. Величина частиц дисперсной фазы от 1000 нм – 100 нм до 1 нм. B отличие от частиц грубодисперсных систем (суспензий, эмульсий, пен, различных сыпучих материалов, размер которых обычно превышает 1000 нм), коллоидные частицы в легкоподвижной среде участвуют в интенсивном броуновском движении и противостоят седиментации в поле сил земного притяжения, то есть, обладают высокой кинетической устойчивостью.
Коллоидные системы (коллоиды, др.-греч. κόλλα — клей и εἶδος — вид; «клеевидные», золи) — дисперсные системы, промежуточные между истинными растворами и грубодисперсными системами — взвесями. Размеры коллоидных частиц варьируются в пределах от 1 нм до 100 нм. В свободнодисперсных коллоидных системах (дымы, золи) частицы не выпадают в осадок.
Или это:
Система, в которой дискретные частицы, капли или пузырьки дисперсной фазы, имеющие размер от 1 до 100 нм, распределены в другой фазе, обычно непрерывной, отличающейся от первой по составу или агрегатному состоянию и именуемой дисперсионной средой.
Основные свойства:
Коллоидные частицы не препятствуют прохождению света.
В прозрачных коллоидах наблюдается рассеивание светового луча (эффект Тиндаля).
Дисперсные частицы не выпадают в осадок – Броуновское движение поддерживает их во взвешенном состоянии.
Основные виды:
Гидрозоли – двухфазные микрогетерогенные дисперсные системы, характеризующиеся предельно высокой дисперсностью, в которых дисперсионной средой является вода.
Органозоли – дисперсионной средой являются неводные (органические) растворители.
Образование коллоидных систем:
Путем конденсации (при выделении коллоидно-дисперсной фазы из перенасыщенного пара, раствора или расплава).
Путем диспергирования.
Наиболее важны и многообразны коллоидные системы c жидкой дисперсионной средой. Иx делят на лиофильные (лат. «филео» - «люблю») и лиофобные (лат. «фобос» - «страх»).
Лиофильные: частицы дисперсной фазы интенсивно взаимодействуют co средой, поверхностное натяжение на границе фаз очень мало, они термодинамически устойчивы (равновесны). K лиофильным коллоидным системам относятся мицеллярные растворы поверхностно-активных веществ, растворы некоторых природных или синтетических высокомолекулярных соединений, органических пигментов и красителей, эмульсии, (таковы растворы белков, крахмала, пектинов, камедей, эфиров целлюлозы и разнообразных смол, как природных так и синтетических), a также водные дисперсии некоторых глинистых минералов.
Лиофобные: частицы слабо взаимодействуют c дисперсионной средой, межфазное натяжение довольно велико, такие системы обладают значительным избытком свободной энергии и термодинамически неустойчивы (неравновесны). Типичные лиофобные коллоидные системы – золи металлов, оксидов и гидроксидов, сульфидов, золи драгоценных металлов, золи металлоидов (серы, селена, теллура), золи сульфидов мышьяка, сурьмы, кадмия, ртути, золи гидроксидов железа, алюминия, дисперсии полимеров в воде (например, полистирола, фторолона), синтетические латексы и др. Эти системы характеризуются агрегативной неустойчивостью и требуют стабилизации.
Коллоидные системы необычайно лабильны, т.е. неустойчивы. Причина столь легкого изменения состояния коллоидных систем связана с непостоянством степени их дисперсности. Присутствие в жидкой дисперсионной среде адсорбционно-активных веществ – стабилизаторов – обеспечивает агрегативную устойчивость, т.e. длительное постоянство их дисперсного состава. Стабилизаторами коллоидных систем могут быть электролиты или некоторые другие вещества, не имеющие электролитной природы, например высокомолекулярные соединения (ВМС) или поверхностно-активные вещества (ПАВ).
Механизм стабилизации электролитами и неэлектролитами существенно различен. Влияние электролитов на устойчивость коллоидных систем носит сложный характер. В одних случаях ничтожные добавки электролита способны привести к нарушению устойчивости системы. В других - введение электролита способствует увеличению стабильности. Образование адсорбционных слоев таких стабилизаторов, как ПАВ, приобретает особенно большое значение при наличии двухмерных структур, обладающих повышенными структурно-механическими свойствами. Структурно-механические свойства адсорбционных слоев в значительной мере определяют поведение коллоидных систем. Эти слои могут быть образованы или изменены небольшими количествами каких-либо растворенных веществ, поэтому создается возможность регулирования ряда свойств коллоидных систем, что широко используется в различных практических приложениях.
Коллоидные растворы проявляют специфические свойства: коагуляции и адсорбции.
Коагуляция.
Коагуляция (от лат. coagulatio — свертывание, сгущение), также старение – объединение мелких частиц дисперсных систем в более крупные под влиянием сил сцепления с образованием коагуляционных структур. Коагуляция — физико-химический процесс слипания коллоидных частиц, выпадение осадка происходит в результате лишения коллоидных частиц адсорбционной оболочки, нейтрализации заряда или химических превращений.
Коагуляция (иначе агрегация, флокуляция) (англ. coagulation) — слипание коллоидных частиц друг с другом и образование из них более сложных агрегатов. Слияние капель жидкости или газовых пузырьков называется коалесценцией.
Коагуляция представляет собой процесс укрупнения частиц, а седиментация является конечным результатом этого процесса, однако термин «коагуляция» часто используют для обозначения данного явления в целом.
Коагуляция ведёт к выпадению из коллоидного раствора хлопьевидного осадка или к застудневанию. Коагуляция – естественный, самопроизвольный процесс расслаивания коллоидного раствора на твёрдую фазу и дисперсионную среду.
Причины коагуляции:
Столкновение коллоидных частиц в результате броуновского движения. (Столкновения частиц, происходящие ввиду броуновского движения, далеко не всегда приводят к их слиянию.)
Нагревание: при нагревании уменьшается адсорбционная способность коллоидных частиц, поэтому крупные частицы, ставшие нейтральными, притягиваются друг к другу, образуя осадок;
Замораживание: при замораживании образуются кристаллики воды, в результате в оставшейся части системы происходит концентрирование золя, и частицы могут приходить друг с другом в контакт и слипаться.
Действие электрического поля: под действием электрического тока крупные заряженные коллоиды притягиваются к соответствующему (противоположно заряженному) электроду и там разряжаются, образовавшиеся нейтральные частицы притягиваются друг к другу и дают осадок. Явление разряда мицелл под действием электрического тока называется электрофорезом;
Добавлении коагулянтов – веществ, ускоряющих коагуляцию, в частности, электролитов (электрокоагуляция). Прибавление сильного электролита приводит к нейтрализации коллоидных частиц
Механическое воздействие на систему.
Скорость старения (коагуляции) зависит:
от напряжения на границе раздела фаз,
радиуса частиц,
коэффициента диффузии,
температуры,
растворимости макрофазы.
Монодисперсные системы стареют крайне медленно.
Минимальная концентрация электролита, вызывающая быструю коагуляцию, называется порогом коагуляции  и выражается в ммоль экв /л. и выражается в ммоль экв /л.
Порог коагуляции вычисляют по формуле
 , ,
где СЭК – молярная концентрация эквивалента добавляемого
раствора электролита (Сэк – эквивалентное количество
растворенного вещества, содержащееся в 1 л раст-
вора), моль экв/л;
VЭЛ - минимальный объем раствора электролита, при добав-
нии которого началась коагуляция золя, л;
VЗ - объем золя, л.
Величина порога коагуляции зависит от заряда коагулирующего иона. При переходе от однозарядных к двух - и трехзарядным ионам величина порога коагуляции уменьшается в десятки и сотни раз.
Согласно правилу Шульце-Гарди порог коагуляции обратно пропорционален шестой степени заряда иона электролита:
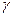 1 : 1 : 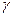 2 : 2 : 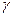 3 = 1-6 : 2-6 : 3-6 = 1 : 0,0156 : 0,0014 3 = 1-6 : 2-6 : 3-6 = 1 : 0,0156 : 0,0014
или 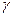 1 : 1 : 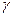 2 : 2 : 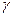 3 = 729 : 11 : 1. 3 = 729 : 11 : 1.
Такая зависимость объясняется тем, что для коагуляции необходимо снизить или нейтрализовать заряд частиц. В этом процессе участвуют не все прибавленные в раствор ионы, а только адсорбирующиеся на их поверхности; адсорбционная же способность ионов резко возрастает с увеличением их заряда.
Адсорбция.
Адсорбция – самопроизвольный процесс увеличения концентрации одного вещества (адсорбата) на поверхности другого (адсорбента). Адсорбция происходит на любых межфазовых поверхностях, адсорбироваться могут любые вещества.
Развитие промышленного адсорбционного метода началось с очистки углем растворов от примесей в 1785 г. До 40-х годов XX века в основном применяли силикагель SiO2 для осушки и очистки, разделения спиртов, аминокислот, витаминов, антибиотиков и др. После 50-х годов XX века и в настоящее время применяются синтетические цеолиты (Me2O×Al2O3×SiO2), где Me - это ионы K+ или Na+ (из них делают молекулярные сита). Диаметр пор 4-7Å, (1Å(анкстрем) = 10-10 м). Молекулы Н2О поглощают, а большие молекулы - пропускают.
Сейчас адсорбционные процессы базируются на синтетических адсорбентах. В то же время поверхность Земли, дно океана содержат огромный потенциал природных адсорбентов.
Применение адсорбции:
Адсорбция широко применяется в различных отраслях народного хозяйства.
В медицинской практике при пищевых отравлениях в качестве адсорбентов используют молоко и активированный уголь.
В сельском хозяйстве в качестве “банков” удобрений используют цеолиты. Они выделяют ионы К+, NH-4, а поглощают и удерживают Са2+, Mg2+.
В химической технологии адсорбцию используют для очистки нефтепродуктов от малых содержаний воды, серы, селена, мышьяка, фосфора.
Процессы адсорбции лежат в основе разделения трудноразделимых соединений. Этот метод назван хроматографией, он предложен в 1903 г. русским учёным М.С. Цветом. Хроматография широко используется при разделении и очистке лекарственных веществ, витаминов, пигментов, алкалоидов. С помощью этого метода были разделены искусственно приготовленные трансурановые элементы: Es(№99), Fm(№100), Md(101).
В горнодобывающей отрасли адсорбенты используют для улавливания ценных элементов из больших объёмов жидкости, из которых выделить эти вещества другими методами нерентабельно.
В текстильной и кожевенной промышленности техника адсорбции применяется при крашении волокон, шерсти, кожи.
Адсорбция является необходимым условием для катализа.
Коллоидные системы, состоящие из частиц диспергированного вещества, способных свободно перемещаться в жидкой дисперсионной среде совместно с адсорбированными на их поверхности молекулами или ионами третьего компонента (стабилизатора), называют лиозолями, а сами частицы, обладающие сложным строением - мицеллами.
Золи.
Золь иначе лиозоль; коллоидный раствор (англ. sol от лат. Solutio – раствор) – высокодисперсная коллоидная система (коллоидный раствор) с жидкой (лиозоль) или газообразной (аэрозоль) дисперсионной средой, в объеме которой распределена другая (дисперсная) фаза в виде капелек жидкости, пузырьков газа или мелких твердых частиц, размер которых лежит в пределе от 1 до 100 нм (10−9 – 10−7м).
В зависимости от дисперсионной среды золи бывают:
твердыми,
аэрозолями (газообразная дисперсионная среда)
лиозолями (жидкая дисперсионная среда). В зависимости от природы дисперсионной среды лиозоли называют:
гидрозолями (вода),
органозолями (органическая среда), в частности:
алкозолями (спирты),
этерозолями (эфиры) и др.
3оли занимают промежуточное положение между истинными растворами и грубодисперсными системами (суспензиями, эмульсиями). Золи диффундируют медленнее, чем неорганические соли, обладают эффектом светорассеяния (Эффект Тиндаля).
В противоположность гелям, в золях частицы дисперсной фазы не связаны в пространственную структуру, а свободно участвуют в броуновском движении.
Частицы дисперсной фазы лиозоля вместе с окружающей их сольватной оболочкой из молекул (ионов) дисперсионной среды называют мицеллами. К лиозолям относятся мицеллярные растворы различных типов, водные растворы биополимеров, органо- и гидрозоли металлов, синтетические латексы. Примером аэрозоля на основе жидкости является туман — взвесь капель воды в воздухе; находящийся в воздухе дым или пыль — пример твердотельного аэрозоля.
Свойства:
большая удельная поверхность;
адсорбция и плёнкообразование на поверхностях раздела;
агрегация, как следствие взаимодействия частиц;
частицы на поверхности обладают большей энергией, чем частицы внутри фазы.
Получение и применение:
Получают золи при помощи диспергаторов и гомогенизаторов (хотя существует точка зрения, что довольно часто это один и тот же агрегат, который разные источники называют по-разному).
Применяют в химии, фармацевтике, военном деле, т.к. вышеперечисленные свойства позволяют резко улучшить качественные и количественные показатели химических реакций.
Гели.
В результате молекулярного сцепления частиц дисперсной фазы из золей при их коагуляции образуются гели. При этом не происходит разделения фаз; другими словами, переход золей в гель не является фазовым превращением. При образовании геля вся дисперсионная среда (например, вода в гидрозоле) прочно связывается поверхностью частиц дисперсной фазы в ячейках пространственной структуры геля.
Ге́ли (ед.ч. гель, от лат. gelo — «застываю») — структурированные дисперсные системы, состоящие из высокомолекулярных и низкомолекулярных веществ. Наличие трёхмерного полимерного каркаса (сетки) сообщает гелям механические свойства твёрдых тел (отсутствие текучести, способность сохранять форму, прочность и способность к деформации (пластичность и упругость).
Гели (или студни) представляют собой студенистые осадки, образующиеся при коагуляции золей. К ним относят большое количество полимерных гелей, столь хорошо известные вам кондитерские, косметические и медицинские гели (желатин, холодец, мармелад, торт “Птичье молоко”) и, конечно же, бесконечное множество природных гелей: минералы (опал), тела медуз, хрящи, сухожилия, волосы, мышечная и нервная ткани и т.д.
Гели состоят, по крайней мере, из двух компонентов, один из которых образует непрерывную трёхмерную макромолекулярную сетку, выступающую в роли каркаса, пустоты в которой заполнены низкомолекулярным растворителем — дисперсионной средой. Вещества, способные образовывать макромолекулярную структуру гелей, называются гелеобразователями.
В качестве низкомолекулярной дисперсионной среды — наполнителя геля — выступают вода, низшие моно- и олигоспирты, углеводороды (общее название «лиогели»).
Гели с водной дисперсионной средой называются гидрогелями,
Гели со спиртовой дисперсионной средой называются алкогелями,
Гели с углеводородной дисперсионной средой называются органогелями.
Гели образуются при коагуляции и последующей коалесценции золей, понижении температуры, концентрировании мицеллярных растворов мыл или выделении новой дисперсной фазы из пересыщенных растворов.
Гели термодинамически неустойчивы: со временем структура гелей нарушается (отслаивается) – из них выделяется вода.
Применение гелей.
Гели широко используются для производства разнообразных косметических, лекарственных препаратов и продукции бытовой химии (для ухода за волосами, для бритья, для наращивания ногтей и т. п.), а также для лабораторных исследований методом электрофореза и др.
Гелями могут заполняться анатомические имплантаты, применяемые в пластической хирургии.
Твердые гели (алюмогель, силикагель) широко применяются как адсорбенты.
Также сложились следующие области применения терминов:
«гель» — химия, химическая технология, косметические и бытовые средства;
«желе» — в кулинарии сладкие фруктовые или ягодные студенистые блюда;
«студень» — в кулинарии мясное или рыбное блюдо из охлажденного мясного (или рыбного) бульона с кусочками мяса (или рыбы), значительно реже — в химической технологии и физиологии (устар.).
| Коллоидная химия
Коллоидная химия, традиционное название физической химии дисперсных систем и поверхностных явлений. Коллоидная химия как самостоятельная наука возникла в 60-е годы 19 в. С тех пор её предмет и методы существенно изменились. В период становления Коллоидной химии «коллоидами» называли клееподобные аморфные тела (в отличие от кристаллических тел, «кристаллоидов»); теперь термин «коллоиды» — синоним высокодисперсных (микрогетерогенных) систем, то есть дисперсных систем с наиболее развитой поверхностью раздела фаз. Коллоидная химия изучает своеобразные процессы и явления, обусловленные особенностями высокодисперсного состояния тел.
К ним относятся:
самопроизвольное укрупнение частиц твёрдой дисперсной фазы или капель жидкости (коагуляция и коалесценция) как проявление термодинамической (агрегативной) неустойчивости дисперсных систем;
застудневание жидких дисперсных систем с образованием гелей и возникновение пространственных дисперсных структур;
взаимодействие соприкасающихся тел (трение, адгезия) и изменение этого взаимодействия под влиянием веществ, адсорбирующихся на поверхностях соприкосновения;
явления в тонких жидких и твёрдых плёнках;
самопроизвольное диспергирование жидкостей и твёрдых тел.
Современная Коллоидная химия включает следующие основные разделы.
1) Молекулярно-кинетические явления (броуновское движение, диффузия) в дисперсных системах; гидродинамика дисперсных систем; дисперсионный анализ.
2) Поверхностные явления: адсорбция (термодинамика и кинетика), смачивание, адгезия, поверхностно-химические процессы в дисперсных системах; строение и свойства поверхностных (адсорбционных) слоев.
3) Теория возникновения новой (дисперсной) фазы в метастабильной (пересыщенной) среде; конденсационные методы образования дисперсных систем.
4) Теория устойчивости, коагуляция и стабилизация коллоидно-дисперсных систем; строение частиц дисперсной фазы (мицелл).
5) Физико-химическая механика дисперсных систем, включающая теорию механического диспергирования, явления адсорбционного понижения прочности твёрдых тел, реологию дисперсных систем; образование и механические свойства пространственных структур в дисперсных системах.
6) Электрические и электрокинетические явления в дисперсных системах.
7) Оптические явления в дисперсных системах (коллоидная оптика) — светорассеяние, светопоглощение; Коллоидная химия фотографических процессов.
Вся природа — организмы животных и растений, гидросфера и атмосфера, земная кора и недра — представляет собой сложную совокупность множества разнообразных и разнотипных грубодисперсных и коллоидно-дисперсных систем.
Коллоидная химия разрабатывает научные основы технологических процессов с участием дисперсных систем:
технология строительных материалов, силикатов (особенно керамики), технология пластмасс, резины, лакокрасочных материалов с использованием высокодисперсных пигментов и наполнителей;
технология бурения горных пород, механической обработки твёрдых материалов, в том числе металлов;
процессы гетерогенного катализа и адсорбционные процессы;
создания дисперсных — наиболее эффективных — форм пестицидных препаратов, широко применяемых в сельском хозяйстве;
использования поверхностно-активных веществ в составе моющих и очищающих средств, эмульгаторов, флоторсагентов, присадок к смазочным маслам и т.д.;
|
Особенности коллоидных систем
По своему внешнему виду коллоидные системы ничем не отличаются от истинных растворов, но обладают рядом характерных свойств, не присущих последним.
Эти свойства определяются:
размером частиц;
структурой частиц;
наличием поверхности раздела и рядом других факторов.
Коллоидным системам присущи следующие особенности:
1) зависящие от размера частиц.
Эффект Тиндаля заключается в том, что путь светового луча, проходящего через коллоидную систему (или взвесь), становится видимым, если луч рассматривать под углом 90о к направлению луча.
Явление опалесценции заключается в том, что неокрашенные коллоидные системы кажутся голубоватыми в отраженном и желтоватыми в проходящем свете. По закону Рэлея
Ip λ –4,
где Iр - интенсивность рассеяния света с длиной волны λ.
Поэтому синие лучи как более короткие сильнее рассеиваются частицами. Вследствие этого в отраженном свете мы видим рассеивающуюся часть спектра (голубая окраска), а в проходящем - ту часть спектра, которая уже не содержит коротких световых волн (желтовато-розовая окраска).
Явление светорассеяния широко используется в важнейших методах изучения коллоидных систем: ультрамикроскопии и нефелометрии.
Неспособность коллоидных частиц к прохождению через полупроницаемую мембрану (т.е. мембрану с диаметром пор, меньшим чем коллоидные частицы) отличает коллоидные системы от истинных растворов;
2) зависящие от структуры коллоидных частиц.
Электрофорез - явление перемещения коллоидных частиц к различным электродам под действием постоянного электрического поля вследствие наличия у коллоидных частиц заряда того или иного знака;
3) связанные с наличием поверхности раздела.
Адсорбция, уже знакомое нам явление, которое в коллоидных системах очень широко распространено, так как коллоидные
системы - это системы с развитыми поверхностями раздела фаз.
Устойчивость коллоидных систем. Лиофильные и лиофобные коллоидные системы
Коллоидные частицы настолько малы, что испытывают интенсивное броуновское движение.
Для коллоидных систем существенны два вида устойчивости: кинетическая и агрегативная.
Кинетическая устойчивость - это устойчивость к действию силы тяжести. Она заключается в том, что хаотическое броуновское движение сравнительно маленьких частиц дисперсной фазы в коллоидной системе компенсирует действие гравитационных сил (при сохранении в системе условий, препятствующих объединению, а значит, и укрупнению частиц дисперсной фазы).
Агрегативная устойчивость - это устойчивость к слипанию частиц дисперсной фазы друг с другом.
В зависимости от факторов, обеспечивающих агрегативную устойчивость коллоидных систем, последние делятся на два типа:
1) лиофильные (т.е. любящие растворитель) коллоидные системы, частицы которых хорошо смачиваются (сольватируются дисперсионной средой или растворителем). Наиболее типичными представителями лиофильных систем являются системы, содержащие высокомолекулярные вещества (растворы белков, полимеров), дисперсии мицеллообразующих поверхностно-активных веществ и другие;
2) лиофобные (т.е. не любящие растворитель) коллоидные
системы, частицы которых при взаимодействии с дисперсионной
средой практически не сольватируются.
Устойчивость лиофильных коллоидных систем определяется наличием большой сольватной (или гидратной, если дисперсионная среда - вода) оболочки вокруг частицы.
В лиофильных коллоидных системах поверхностное натяжение на границе раздела фаз мало (σ 12 = 0,1  0,01 Дж/м2), значит, мала и избыточная энергия, определяемая по формуле 0,01 Дж/м2), значит, мала и избыточная энергия, определяемая по формуле
∆G = σ 12∙  , ,
где σ 12 – поверхностное натяжение на границе раздела фаз;
 - площадь поверхности раздела фаз. - площадь поверхности раздела фаз.
Молекулы высокомолекулярных веществ в сотни тысяч раз крупнее обычных и имеют тот же размер, что и коллоидные частицы. Поэтому лиофильные системы, обладая многими свойствами коллоидных систем, в то же время имеют характерные признаки истинных растворов. К таким признакам относится способность к самопроизвольному растворению и устойчивость образовавшихся растворов при отсутствии стабилизатора.
Лиофобные коллоидные системы вследствие их большой удельной поверхности и большого значения σ12 являются системами термодинамически неустойчивыми, т.е. принципиально агрегативно-неустойчивыми.
Для получения устойчивой лиофобной системы (лиофобного золя) двух компонентов мало. Устойчивая лиофобная коллоидная система кроме дисперсной фазы и дисперсионной среды должна содержать и третий компонент - стабилизатор, снижающий величину σ 12.
Размер частиц дисперсной фазы характеризуют степенью дисперсности
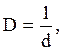
где 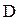 - степень дисперсности; - степень дисперсности;
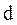 - диаметр частиц, см. - диаметр частиц, см.
Способы получения коллоидных систем
Для получения коллоидной системы необходимо наличие вещества дисперсной фазы в коллоидной степени дисперсности, т.е. в виде частичек размером от 1 до 100 нм, и распределить его в дисперсионной среде. Это можно осуществить только в том случае, если вещество дисперсной фазы нерастворимо в дисперсионной среде.
Существуют два метода получения коллоидных систем:
1) метод диспергирования (т.е. дробление более крупных
частиц до размеров менее 100 нм). Это возможно путем или ультразвукового диспергирования, или механического дробления, а
также электрического диспергирования под влиянием постоянного
или переменного электрического тока;
2) конденсационный метод (метод укрупнения) - соединение
атомов или молекул в агрегаты, размеры которых больше 1 нм, но меньше 100 нм. Для получения коллоидной системы этим методом чаще всего используют проходящую в растворе химическую реакцию, в результате которой образуется нерастворимое вещество. При этом задача сводится к тому, чтобы избежать образования слишком крупных частиц, выпадающих в осадок, и получить частицы коллоидных размеров.
В конденсационном методе используются различные химические реакции: восстановления, окисления, обмена, гидролиза.
Например:
2 AuCl3 + 3 CH2O + 3 H2O = 2 Au↓ + 3 HCOOH + 6 HCl,
2 H2S + O2 = 2 H2O + 2 S↓,
Все эти реакции можно провести таким образом, что выпадающие в осадок вещества останутся в коллоидной степени дисперсности.
Примеры решения задач
Пример 1. Золь иодида серебра получен при добавлении к 0,01 л раствора KI с СЭК = 0,005 моль экв/л, 0,014 л раствора АgNО3 с СЭК = 0,0025 моль экв/л. Определите заряд частиц полученного золя и составьте схему его мицеллы.
Решение. При смешении растворов АgNО3 и KI протекает реакция
Аg NО3 + KI = АgI↓ + KNО3.
Определяем число молей эквивалентов исходных реагентов:
АgNО3 : 0,0025 ∙ 0,014 = 3,5∙10-5 моль экв, KI : 0,005 ∙ 0,01 = 5∙10 -5 моль экв.
Из расчета видно, что в растворе имеется избыток KI, следовательно, ядром коллоидных частиц золя АgI будут адсорбироваться ионы I-, и частицы приобретут отрицательный заряд. Противоионами являются катионы К+.
Практическая часть
В ходе работы мною были проведены следующие опыты:
1. Получение коллоидных систем.
А) AgNO3 + KI = AgI + KNO3
2. Описание работы
А) Добавляем AgNO3 в пробирку KI. Происходит реакция осаждения с характерным цветом.
3. Эффект Тиндаля
В наших опытах использовались прозрачные емкости - стеклянные цилиндры, химические стаканы, и лампа, дающая направленный пучок света (карманный фонарик).
Заключение
В результате изучения литературы и проведения практических опытов я могу предположить, природа отдает предпочтение именно коллоидному состоянию потому, что:
Вещество в коллоидном состоянии имеет большую поверхность раздела между фазами. А это способствует лучшему протеканию обмена веществ.
- Биологический синерезис (самопроизвольное уменьшение объема геля, сопровождающееся отделением жидкости) играет важную роль в процессе свертывания крови.
В практической части проделали опыты, позволяющие познакомиться с эффектом Тиндаля
Из коллоидов, богатых белками соединительной ткани (аминокислоты пролин и глицин), состоят кожа, мышцы, ногти, волосы, кровеносные сосуды, легкие, весь желудочно-кишечный тракт и многое другое, без чего немыслима сама жизнь.
Применение коллоидов находит все большее применение в медицинской практике.
От использования простых коллоидных золей для местной заживляющей терапии и применения солей алюминия и магния для понижения кислотности желудка, до использования гидроокиси алюминия в качестве стабилизатора и носителя лекарственных веществ.
Знания коллоидной химии необходимы и востребованы в наше время, что находит подтверждение в моих словах.
Литература
1. Коровин Н.В. Общая химия. - М: Высш. шк., 2002. Гл. 8.
2. Глинка Н.Л. Общая химия. – М: Интеграл-Пресс, 2002. Гл.10.
3. https://studopedya.ru/1-84591.html
4. https://www.bestreferat.ru/referat-114337.html
5. https://nsportal.ru/ap/library/nauchno-tekhnicheskoe-tvorchestvo/2013/07/06/referat-s-prezentatsiey-na-temu-kolloidnye
|
 Скачать 57.69 Kb.
Скачать 57.69 Kb.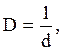

 ,
,