Методическое пособие по химии для учащихся 9х классов, Тема 1 Строение атомов первых 20 химических элементов псхэ д. И. Менделеева. Обязательный минимум знаний
 Скачать 93.56 Kb. Скачать 93.56 Kb.
|
|
Химия В помощь сдающим ОГЭ методическое пособие по химии для учащихся 9-х классов, Тема №1: «Строение атомов первых 20 химических элементов ПСХЭ Д. И. Менделеева». Обязательный минимум знаний. Строение атома: ядро (протоны и нейтроны) + электроны. Число протонов (p+) – равно порядковому номеру химического элемента (Z). Число нейтронов (n0) – равно A-Z, где А – массовое число. Число электронов (е-) - равно порядковому номеру химического элемента (Z). Заряд ядра = число протонов = число электронов (+Z = p+ = е-). Номер периода показывает – число электронных слоев в электронной оболочке атома. Номер группы показывает – число электронов на внешнем электронном слое атома + число валентных электронов. Валентные электроны – электроны, участвующие в образовании химической связи. Распределение электронов по энергетическим уровням: на 1-м максимум 2 электрона, на 2-м – 8 электронов, на 3-м – 18 электронов (если уровень последний – то число электронов на нём равно номеру группы или высчитывается как разница общего числа электронов и электронов на предыдущих уровнях). Если последний (внешний) уровень атома имеет максимальное число электронов, то такой электронный слой называется завершенным (его имеют атомы благородных газов – элементы 8 группы). Тема №2: «Периодический закон и ПСХЭ Д. И. Менделеева». Обязательный минимум знаний. Закономерности изменения свойств элементов и их соединений. В периоде слева направо: Радиус атома уменьшается; Металлические свойства ослабевают; Неметаллические свойства возрастают; Восстановительные свойства ослабевают; Окислительные свойства возрастают; Электроотрицательность возрастает; Число валентных электронов возрастает; Основные оксиды через амфотерные сменяются кислотными. В группе сверху вниз: Радиус атома возрастает; Металлические свойства возрастают; Неметаллические свойства ослабевают; Восстановительные свойства возрастают; Окислительные свойства ослабевают; Электроотрицательность уменьшается; Число валентных электронов постоянно и равно номеру группы. Тема №3: «Химическая связь». Обязательный минимум знаний. Типы химических связей: Ковалентная полярная химическая связь (образуется между атомами неметаллов с разным значением электроотрицательности или между атомами металла и неметалла с небольшой разностью в значении электроотрицательности). Например: H2S, NH3. Ковалентная неполярная химическая связь (образуется между атомами неметаллов с одинаковым значением электроотрицательности). Например: H2, O2, P4, S8. Ионная химическая связь (образуется между атомами неметалла и металла). Например: NaCl, CaO, K2S. Металлическая химическая связь – характерна для металлов и сплавов. Например: Al, Cu, бронза, чугун, латунь. Тема №4: «Степень окисления химических элементов». Обязательный минимум знаний. Правила расчета степени окисления: С.о. водорода = +1 в соединениях с неметаллами и = -1 в соединениях с металлами (гидриды металлов); С.о. кислорода = -2, кроме пероксидов (-1) и фторидов (+2); С.о. металла = заряду его иона (в таблице растворимости); С.о. простого вещества = 0; Сумма с.о. всех элементов в сложном веществе = 0; С.о. иона = заряду иона (в таблице растворимости). Алгоритм определения степени окисления элементов в бинарных соединениях: Выбрать более электроотрицательный элемент и найти его степень окисления, как № группы – 8. Написать над ним степень окисления. Умножить степень окисления на индекс у этого элемента. Полученное число со знаком «минус» подписать под другим элементом. Такое же число со знаком «плюс» подписать под другим элементом. Разделить это число на индекс другого элемента. Полученную степень окисления написать над элементом. Алгоритм определения степени окисления неметалла в кислотах и солях: Отделить кислород вертикальной чертой, записать сверху его степень окисления – 2 и умножить на индекс. Полученное число написать под кислородом. Такое же число с противоположным знаком записать под левой частью формулы. Вычесть из него число атомов водорода (для кислот) или заряд металла*индекс металла (для солей). Полученное число написать над знаком центрального элемента. Тема №5: «Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура органических соединений». Обязательный минимум знаний. Классификация веществ В   ещества ещества     Простые Сложные Простые СложныеМеталлы Неметаллы Оксиды Основания Кислоты Соли  Оксиды – бинарные соединения кислорода, в котором он проявляет степень окисления –2 (CaO, Al2O3). Классификация оксидов. Оксиды   несолеобразующие солеобразующие    CO, N2O, NO, SiO, S2O CO, N2O, NO, SiO, S2O основные амфотерные кислотные Несолеобразующие оксиды – не взаимодействуют с кислотами и щелочами и, как следствие, не образуют солей. Основные оксиды – образованы металлом в с.о.+1 и +2 (Na2O, MgO). Амфотерные оксиды – образованы металлами в с.о. +3 и +4 (Al2O3, PbO2). Исключения: ZnO, PbO, SnO, BeO (у них с.о. металла равна +2). Кислотные оксиды – образованы металлом в с.о.+5,+6,+7 или неметаллов, исключая несолеобразующие (SO3, CO2). Основания – сложные соединения, в составе которых катион металла соединен с гидроксид-анионами: Me(OH)n. Например: NaOH, Ca(OH)2. Основания могут быть растворимыми и нерастворимыми. Растворимые в воде основания – щелочи (они окрашивают индикаторы). Кислоты – сложные соединения, в составе которых атом водорода соединен с кислотным остатком (HCl, H2SO4). Кислотный остаток может состоять из одного элемента (Cl-) и быть сложным (SO4-). Соли – сложные вещества, в составе которых катион металла соединен с кислотным остатком (NaCl, CaSO4). Формулы и названия кислот и солей.
Тема №6: «Условия и признаки протекания химических реакций. Химические уравнения». Обязательный минимум знаний. Физические явления – явления, при которых состав вещества остается постоянным, а изменяется лишь его агрегатное состояние или форма и размеры тел. Примеры: плавление парафина, таяние льда, испарение воды. Химические явления (химические реакции)– явления, при которых одни химические вещества превращаются в другие. Примеры: горение древесины, ржавление металлов, скисание молока. Химическое уравнение – это условная запись химической реакции с помощью химических формул и коэффициентов. Признаки химических реакций: Изменение цвета; Выделение тепла и света; Выделение газа; Растворение осадка; Изменение запаха; Выпадение осадка. . Тема №7: «Классификация химических реакций». Обязательный минимум знаний. Типы химических реакций по числу и составу исходных и полученных веществ: Реакция разложения – это реакции, при которых из одного вещества образуется несколько других. Например: Cu(OH)2 → CuO + H2O Реакция соединения – это реакции, при которых из нескольких веществ образуется одно. Например: S + O2 → SO2 Реакция обмена – это реакции, при которых два сложных вещества обмениваются своими составными частями. Например: CuSO4 + BaCl2 → BaSO4 + CuCl2 Реакция замещения – это реакция между простым и сложным веществом, при которой атомы простого вещества, замещают атомы одного из элементов в сложном веществе. Например: Zn + 2HCl → ZnCl2 + H2 Типы химических реакций по тепловому эффекту: Экзотермические – протекают с выделением теплоты; Эндотермические – протекают с поглощением теплоты. По изменению степени окисления исходных веществ и продуктов реакции: Окислительно-восстановительные реакции (ОВР) – реакции, протекающие с изменением степени окисления; Не окислительно-восстановительные реакции – реакции, протекающие без изменением степени окисления; По участию катализатора: Каталитические – протекают с участием катализатора; Некаталитические – протекают без участия катализатора. По обратимости: Обратимые – протекают в двух противоположных направлениях; NaCl + HNO3 ↔ HCl +NaNO3 Необратимые – протекают только в одном направлении. NaCl + AgNO3 → AgCl↓ + NaNO3 Тема №8: «Электролиты и неэлектролиты. Катионы и анионы». Обязательный минимум знаний. Электролиты – вещества, растворы которых проводят электрический ток. К электролитам относятся – растворимые кислоты, щелочи, соли. Неэлектролиты – вещества, растворы которых не проводят электрический ток. К неэлектролитам относятся – нерастворимые кислоты, основания, соли; оксиды; органические вещества: раствор сахарозы, метанол, этанол, глюкоза. Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 35. Тема №9: «Электролитическая диссоциация кислот, щелочей и солей». Обязательный минимум знаний. Положения ТЭД: При растворении в воде электролиты диссоциируют на положительные ионы (катионы) и отрицательные ионы (анионы). Под действие электрического тока катионы движутся к катоду (-), анионы – к аноду (+). Диссоциация – обратимый процесс. Не все электролиты диссоциируют в равной мере. Химические свойства электролитов определяются свойствами тех ионов, которые они образуют при диссоциации. Кислоты – электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Например: HCl → H+ + Cl- Основания – электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы. Например: NaOH → Na+ + OH- Соли - электролиты, которые при диссоциации образуют катионы металла и анионы кислотного остатка. Например: NaCl → Na+ + Cl- Это важно! При диссоциации индексы выносятся вперед ионов. Например: Al2(SO4)3 → 2Al3+ + 3SO42- Тема №10: «Реакции ионного обмена и условия их осуществления». Обязательный минимум знаний. Взаимодействие кислот, оснований и солей 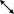 кислота (р) кислота (р)1р р о  снование (р) соль (р) ↓, ↑, H2O снование (р) соль (р) ↓, ↑, H2Oр Э 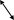   та схема показывает, что кислота может реагировать с основанием, если что-либо одно из них растворимо; растворимая кислота может реагировать с солью; соли между собой могут реагировать, если обе они растворимы; соль с основанием могут реагировать, если и соль, и основание растворимы. Условия реакции – образование осадка, газа или воды. та схема показывает, что кислота может реагировать с основанием, если что-либо одно из них растворимо; растворимая кислота может реагировать с солью; соли между собой могут реагировать, если обе они растворимы; соль с основанием могут реагировать, если и соль, и основание растворимы. Условия реакции – образование осадка, газа или воды.Алгоритм составления реакций ионного обмена: Записать исходные вещества. Подписать классы веществ. Проверить, являются ли они электролитами (по таблице растворимости). По схеме определить, возможна ли такая реакция. Если возможно, над ионами в исходных веществах проставить заряды (по таблице растворимости). Поменять правые части формул местами и записать, таким образом продукты реакции. Правильно составить формулы продуктов. Для этого поставить заряды ионов, снести их крест-накрест и сократить, если нужно. Расставить коэффициенты в уравнении Под формулами продуктов реакции подписать, являются ли они электролитами или неэлектролитами. Записать электролиты в виде ионов с учетом индексов и коэффициентов; неэлектролиты оставить в молекулярном виде. В левой и правой части сократить одинаковые частицы. Записать оставшиеся после сокращения ионы и молекулы. Условия протекания реакций ионного обмена до конца (необратимо): Образуется осадок. Образуется газ. Образуется малодиссоциируемое вещество, например вода. Тема №11: «Химические свойства простых веществ: металлов и неметаллов». Обязательный минимум знаний. + неметалл → соль или оксид (1) + Н2О → Ме(ОН)n+H2 (если Ме от Li-Al) (2) + Н2О → Ме2Оn+H2 (если Ме от Mn-Cd) (3) Металл + кислота → соль (растворимая) + Н2 (Ме левее Н) (4) + соль → соль' (растворимая)+ Ме (5) + Ме2Оn → Ме' + Ме2Om (6) . Образуется бинарное соединение. Металл пишется слева, неметалл справа. У металла с.о. равна +№ группы (есть исключения), у неметалла с.о. равна № группы - 8.Например: 2Са + О2 → 2Са+2О-2. . Металлы от лития до натрия реагируют с водой при комнатной температуре, остальные – при нагревании. 2Na + 2H2O → 2NaOH + H2. . Данная реакция протекает при нагревании. Zn + H2O → ZnO + H2. .Данная реакция характерна только для разбавленных кислот. Металлы, стоящие в ряду напряжений после водорода, с разбавленными кислотами не взаимодействуют. Ещё одно условие данной реакции: в результате неё должна быть образована растворимая соль. Mg + 2HCl → MgCl2 + H2. Это важно!: азотная кислота по особому взаимодейстует с металлами (см. А.14). . Zn + CuCl2 → ZnCl2 +Cu. . 2Al + Cr2O3 → Al2O3 + 2Cr Это важно! Особенности химических свойств некоторых металлов: 1. Особенности щелочных металлов (Li, Na, K): При взаимодействии с кислородом литий образует оксид Li2O, натрий образует пероксид Na2O2: 2Na + O2 → Na2O2. С растворами кислот и солей не взаимодействуют, т.к. в первую очередь будут вступать в реакцию с водой. 2. Особенности алюминия: При обычных условиях малоактивен, т.к. покрыт прочной оксидной пленкой Al2O3 (большинство реакций идут при нагревании); Является амфотерным металлом, поэтому взаимодействует не только с растворами кислот, но и с щелочами, образуя соль - алюминат: 2Al+2NaOH+2H2O→2NaAlO2+3H2↑ На холоду не взаимодействует с концентрированными серной и азотной кислотами (пассивируется). 3. Особенности железа: Для железа характерно образование двух соединений: Fe2+ и Fe3+; Образование соединений железа:
Тема №12: «Химические свойства оксидов: основных, амфотерных, кислотных». Обязательный минимум знаний.  +H2O кислота (р) +H2O кислота (р) кислотные + щелочь соль + H2O кислотные + щелочь соль + H2OО  ксиды + соль ксиды + соль основные + кислота соль +H2O основные + кислота соль +H2O + H2O щелочь + H2O щелочьЭто важно! Амфотерные оксиды будут сочетать свойства основных и кислотных оксидов, т.е. будут вступать в реакции с щелочами и кислотами. Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 40. Тема №13: «Химические свойства оснований». Обязательный минимум знаний. + кислотный оксид → соль + H2O Щелочи + кислота → соль + H2O Основания + соль → соль + основание (↑,↓) Нерастворимые + кислота → соль + H2O нагревание → МеО + H2O Тема №14: «Химические свойства кислот». Обязательный минимум знаний. + Ме (до Н) → соль + Н2 + основный/амфотерный оксид → соль + Н2О Кислота + основание/амфотерный гидроксид → соль + Н2О + соль → соль + кислота (↓,↑) !Особенности взаимодействия азотной кислоты с металлами: Водород никогда не выделяется; Металл в полученном нитрате имеет максимальную степень окисления; На холоду не взаимодействует с: Al, Fe, Cr, Co, Ni. Продукты реакции зависят от двух факторов: Активность металла; Концентрация кислоты. HNO3 (к) + Ме (I, II группа, гл.подгр.) → нитрат + N2O + H2O HNO3 (к) + Ме (остальные) → нитрат + NO2 +H2O HNO3 (р) + Ме (I, II группа, гл.подгр.) → нитрат + NH3 (или NH4NO3) + H2O HNO3 (р) + Ме (остальные) → нитрат + NO + H2O Например: Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 38. Ag + 2HNO3 (к) → AgNO3 + NO2 + H2O. !Особенности химических свойств концентрированной серной кислоты: С металлами: Может взаимодействовать с металлами, стоящими в ряду напряжений после водорода; Металл в полученном сульфате имеет максимальную с.о. Водород никогда не выделяется; На холоду не взаимодействует с: Al, Fe, Cr, Co, Ni. H2SO4 (к) + Me (I, II группа, гл.подгр, Zn) → сульфат + H2S/S/SO2 +H2O H2SO4 (к) + Me (остальные) → сульфат + SO2 + H2O. С неметаллами: 2H2SO4 (к) + C → CO2 + 2SO2 + 2H2O 2H2SO4 (к) + S → 3SO2 + 2H2O С органическими веществами: обугливает бумагу, ткань, древесину, сахарозу. Тема №15: «Химические свойства солей». Обязательный минимум знаний. 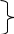 + Ме (левее) → соль + Ме' + Ме (левее) → соль + Ме'+ кислота → соль + кислота' Соли + щелочь → соль + основание' (↑,↓). + соль → соль + соль' Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008г., § 41. Тема №16: «Первоначальные представления об органических веществах». Обязательный минимум знаний. Общие признаки органических веществ: Наличие углерода; Наличие в молекулах только ковалентных связей; Валентность углерода всегда равна четырем. Основные классы органических веществ. Предельные углеводороды (алканы). Общая формула CnH2n+2. Важнейшие представители алканов:
Характерные реакции: замещение и окисление. Непредельные углеводороды (алкены). Общая формула CnH2n. Важнейшие представители:
Особенность строения: наличие двойной С-С связи. Характерные реакции: присоединения и окисления. Непредельные углеводороды (алкины). Общая формула CnH2n-2. Важнейшие представители:
Особенность строения: наличие тройной С-С связи. Характерные реакции: присоединения и окисления. Спирты. Общая формула CnH2n+1ОН. Важнейшие представители:
Карбоновые кислоты. Общая формула CnH2n+1СООН. Важнейшие представители:
Характерны все свойства кислот (взаимодействие с металлами, оксидами металлов, основаниями, солями). Тема №17: «Чистые вещества и смеси. Правила безопасной работы в школьной лаборатории. Разделение смесей и очистка веществ». Обязательный минимум знаний. Химические формулы соответствуют чистым веществам. Все изучаемы в школьном курсе способы разделения смесей относятся к физическим. Смесь – многокомпонентная система (воздух, нефть, морская вода, стекло, бронза, молоко, лимонад). Смеси бывают однородными (нельзя увидеть границу раздела между веществами): раствор сахара в воде и неоднородными (видна граница раздела между веществами): взвесь мела в воде. Способы разделения неоднородных смесей: Отстаивание (этим же методом можно разделить две несмешивающиеся жидкости с помощью делительной воронки). Ускоряют отстаивание центрифугированием; Фильтрование; Некоторые твердые смеси можно разделить при помощи магнита (смесь железных и медных опилок, смесь железных опилок и серы). Способы разделения однородных смесей: Выпаривание; Перегонка (дистилляция). Некоторые правила безопасной работы в химической лаборатории: При растворении серной кислоты нужно вливать её тонкой струей в воду и перемешивать; При работе с растворами едких веществ необходимо надевать защитные перчатки и очки; Воспламенившиеся ЛВЖ (нефть, спирт, ацетон) необходимо тушить песком; Опыты с получением токсичных газообразных веществ (SO2, H2S, NO2) необходимо проводить в вытяжном шкафу. Дополнительная информация: Габриелян О. С., Химия 8 кл., 2008 г., § 23. Тема №18: «Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе и на газообразные вещества». Обязательный минимум знаний. Индикаторы
Качественные реакции
Тема №19: «Вычисление массовой доли химического элемента в веществе». Обязательный минимум знаний. Вычисления производятся по следующей формуле: ω = Ar∙n/Mr ∙ 100%, где Ar – атомная масса химического элемента; n – число атомов того элемента, массовая доля которого находится; Mr – молярная масса молекулы. Например: вычислите массовую долю кислорода в карбиде натрия. Решение: 1. Составляем формулу карбида натрия: Na4C. 2. Ar(Na)=23 г/моль; n(Na)=4; Mr(Na4C)=104г/моль. 3. Подставляем в формулу и вычисляем: ω(Na)=23∙4/104 ∙100% = 88,5% 4. Ответ: 88,5%. Задания части В. Тема №1: «Периодический закон Д. И. Менделеева». Обязательный минимум знаний. См. тема №2 части А. Тема №2: «Химические свойства простых веществ и оксидов». Обязательный минимум знаний. Химические свойства неметаллов.
+ см. тема № 12 части А. Тема №3: «Окислительно-восстановительные реакции». Обязательный минимум знаний. Окислительно-восстановительные реакции (ОВР) – реакции, в ходе которых атомы меняют степени окисления. Восстановитель – элемент, отдающий электроны (в ОВР его степень окисления повышается). Им может быть атом, ион, имеющий минимальную или промежуточную степень окисления. Например: Zn0 – 2e- = Zn+2. Окислитель – элемент, принимающий электроны (в ОВР его степень окисления понижается). Им может быть атом, ион, максимальную или промежуточную степень окисления. Например: S0 + 4e- = S+4. Атом или ион, имеющий промежуточную степень окисления, может проявлять как восстановительные, так и окислительные свойства, т.е. проявлять окислительно-восстановительную двойственность. Для элементов главных подгрупп максимальная степень окисления = +№ группы; минимальная № группы – 8. Восстановление – процесс принятия электронов. Окисление – процесс отдачи электронов. + см. тема №4 части А. Тема №4: «Химические свойства кислот, оснований и солей». Обязательный минимум знаний. см. тема №13, 14, 15 части А. Задания части С. Тема №1: «Взаимосвязь различных классов неорганических веществ». Обязательный минимум знаний. Схема генетической связи веществ. +O2 +H2O м   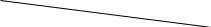      еталл основной оксид основание соль еталл основной оксид основание сольн    еметалл кислотный оксид кислота соль еметалл кислотный оксид кислота соль +O2 +H2O +O2 +H2OДополнительная информация: Габриэлян О. С., Химия 8 кл., 2008г., § 42. Тема №2: «Вычисление массовой доли растворенного вещества в растворе». Обязательный минимум знаний. Алгоритм решения расчетных задач на нахождение массы выпавшего осадка по уравнению реакции: Составить уравнение реакции, уравнять его. По таблице растворимости определить в правой части реакции осадок, обозначить его ↓. Рассчитать массу вещества в растворе по формуле: m(вещества) = m(раствора)∙ω. Рассчитать количество вещества по формуле: n = m/M. По уравнению реакции определить количество вещества того вещества, которое выпало в осадок. Рассчитать массу осадка по формуле: m = M·n. Пример. К 80 г раствора с массовой долей гидроксида натрия 5% добавили избыток раствора сульфата меди (II). Определите массу выпавшего осадка. Решение. Составляем уравнение реакции: NaOH + CuSO4 → Na2SO4 + Cu(OH)2. По таблице растворимости определяем, что в осадок выпадает гидроксид меди(II), тогда уравнение реакции принимает вид: NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓. Рассчитаем массу NaOH по формуле m(вещества) = m(раствора)∙ω: m(NaOH)=80г · 0,05= 4г. Рассчитаем количество вещества NaOH по формуле m = M·n: n(NaOH)= 4г/40г/моль=0,1моль. По уравнению реакции определяем (по коэффициентам перед веществами), что n(Cu(OH)2)=1/2n(NaOH)→n(Cu(OH)2)=0,05моль. Рассчитаем массу Cu(OH)2 (осадок) по формуле m = M·n: m(Cu(OH)2)= 98г/моль∙0,05моль = 4,9г. Ответ: 4,9 г. Необходимые формулы: m = M·n; n = m/M. m(в-ва)=m(р-ра)·ω; m(р-ра)=m(в-ва)/ω. V=Vm·n; n=V/Vm. Скачано с www.znanio.ru | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
