История уксуса, химия. история уксуса. Реферативная работа по химии Дорогян Никита Викторович, ученик 8 К класса
 Скачать 137.26 Kb. Скачать 137.26 Kb.
|
|
Государственное бюджетное общеобразовательное учреждение города Москвы «Школа № 2057» Тема «ИСТОРИЯ УКСУСА» Реферативная работа по химии Выполнил: Дорогян Никита Викторович, ученик 8 «К» класса Проверил: Осокина Елена Олеговна, учитель химии Москва, 2022 Содержание Введение 3 Открытие уксусной кислоты 4 Свойства уксусной кислоты 6 Физические свойства уксусной кислоты………………………………....6 Химические свойства кислоты…………………………………………...7 Получение уксусной кислоты 9 Применение уксусной кислоты 12 Заключение 13 Список использованной литературы 14 ВВЕДЕНИЕ Уксусная кислота, CH3COOH, бесцветная горючая жидкость с резким запахом, хорошо растворимая в воде. Имеет характерный кислый вкус, проводит электрический ток. Уксусная кислота была единственной, которую знали древние греки. Отсюда и ее название: "оксос" - кислое, кислый вкус. Уксусная кислота - это простейший вид органических кислот, которые являются неотъемлемой частью растительных и животных жиров. В небольших концентрациях она присутствует в продуктах питания и напитках и участвует в метаболических процессах при созревании фруктов. Уксусная кислота часто встречается в растениях, в выделениях животных. Соли и эфиры уксусной кислоты называются ацетатами. Уксусная кислота - слабая (диссоциирует в водном растворе только частично). Тем не менее, поскольку кислотная среда подавляет жизнедеятельность микроорганизмов, уксусную кислоту используют при консервировании пищевых продуктов, например, в составе маринадов. Получают уксусную кислоту окислением ацетальдегида и другими методами, пищевую уксусную кислоту уксуснокислым брожением этанола. Применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетата целлюлозы), в виде столового уксуса при изготовлении приправ, маринадов, консервов. Уксусная кислота участвует во многих процессах обмена веществ в живых организмах. Это одна из летучих кислот, присутствующая почти во всех продуктах питания, кислая на вкус и главная составляющая уксуса. Целью реферативной работы является приобретение навыков работы с литературой, обобщения литературных источников и практического материала по теме «История уксуса», а так же изучить свойства, производство и применение уксусной кислоты. Открытие уксусной кислоты Уксус является продуктом брожения вина и известен человеку с незапамятных времен. Первое упоминание о практическом применении уксусной кислоты относится к третьему веку до н. э. Греческий ученый Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения «свинцовых белил», а также ярь-медянки (зелёной смеси солей меди, содержащей помимо всего ацетат меди). В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». «Сапа» содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют «свинцовым сахаром» или «сахаром Сатурна». Высокая популярность «сапы» была причиной хронического отравления свинцом, распространенного среди римской аристократии. В VIII веке арабский алхимик Джабир ибн Хайян впервые получил концентрированную уксусную кислоту путем перегонки. Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)). Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов на самом деле являются двумя разными веществами. Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреа Либавиусом (нем. Andreas Libavius) и французским химиком Пьером Августом Адэ (фр. Pierre Auguste Adet) В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту. В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тыс. тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго. Свойства уксусной кислоты Физические свойства уксусной кислоты. Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы органические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров[4]. Абсолютная уксусная кислота называется ледяной, ибо при замерзании образует льдовидную массу (см. изображение справа). Давление паров (в мм. рт. ст.): 10 (17,1 °C) 40 (42,4 °C) 100 (62,2 °C) 400 (98,1 °C) 560 (109 °C) 1520 (143,5 °C) 3800 (180,3 °C) Диэлектрическая проницаемость: 6,15 (20 °C) Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (25,2 °C); 0,79 (50 °C) Поверхностное натяжение: 27,8 мН/м (20 °C) Удельная теплоемкость при постоянном давлении: 2,01 Дж/г·K (17 °C) Стандартная энергия Гиббса образования ΔfG0 (298 К, кДж/моль): −392,5 (ж) Стандартная энтропия образования ΔfS0 (298 К, Дж/моль·K): 159,8 (ж) Энтальпия плавления ΔHпл: 11,53 кДж/моль Температура вспышки в воздухе: 38 °C Температура самовоспламенения на воздухе: 454 °C Теплота сгорания: 876,1 кДж/моль Уксусная кислота образует двойные азеотропные смеси со следующими веществами. 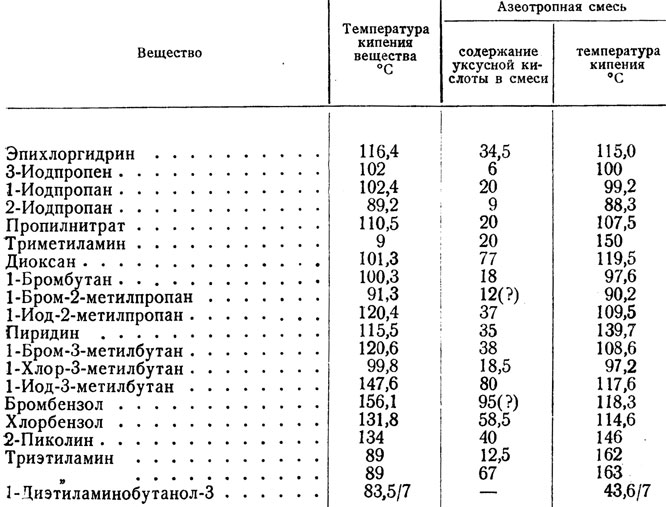 Рис. 1 Уксусная кислота образует тройные азеотропные смеси с водой и бензолом (tкип 88 °C); с водой и бутилацетатом (tкип 89 °C). Химические свойства уксусной кислоты Уксусная кислота обладает всеми свойствами карбоновых кислот. Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства. В результате диссоциации уксусной кислоты образуется ацетат-ион CH3COO− и протон H+. Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1.0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %.  Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями.[13] Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты. Mg(тв) + 2CH3COOH → (CH3COO)2Mg + H2 Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота. CH3COOH + Cl2 → CH2ClCOOH + HCl 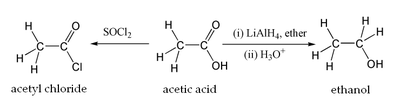 Этим путем могут быть получены также дихлоруксусная (CCl2COOH) и трихлоруксусная (CCl3COOH) кислоты. Уксусная кислота вступает во все реакции, характерные для карбоновых кислот. Она может быть восстановлена до этанола действием алюмогидрида лития. Уксусная кислота также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусный кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана. 3. Получение уксусной кислоты Уксусная кислота - важнейший химический продукт, который широко используется в промышленности для получения сложных эфиров, мономеров (винилацетат), в пищевой промышленности и т.д. Мировое производство ее достигает 5 млн т в год. Получение уксусной кислоты до недавнего времени базировалось на нефтехимическом сырье. В Уокер-процессе этилен в мягких условиях окисляют кислородом воздуха до ацетальдегида в присутствии каталитической системы PdCl2 и CuCl2. Далее ацетальдегид окисляется до уксусной кислоты: CH2=CH2 + 1/2 O2 CH3CHO CH3COOH По другому методу уксусную кислоту получают при окислении н-бутана при температуре 200 C и давлении 50 атм в присутствии кобальтового катализатора. Изящный Уокер-процесс - один из символов развития нефтехимии - постепенно замещается новыми методами, основанными на использовании угольного сырья. Разработаны способы получения уксусной кислоты из метанола: CH3OH + CO CH3COOH Эта реакция, имеющая большое промышленное значение, является прекрасным примером, иллюстрирующим успехи гомогенного катализа. Поскольку оба компонента реакции - СН3ОН и СО - могут быть получены из угля, процесс карбонилирования должен стать более экономичным по мере роста цен на нефть. Существуют два промышленных процесса карбонилирования метанола. В более старом методе, разработанном на фирме BASF, использовали кобальтовый катализатор, условия реакции были жесткими: температура 250?С и давление 500-700 атм. В другом процессе, освоенном фирмой "Monsanto", применяли родиевый катализатор, реакцию проводили при более низких температурах (150-200 С) и давлении (1-40 атм). Интересна история открытия этого процесса. Ученые компании исследовали гидроформилирование с использованием родийфосфиновых катализаторов. Технический директор нефтехимического отдела предложил использовать этот же катализатор для карбонилирования метанола. Результаты опытов оказались отрицательными, и это связали с трудностью образования связи металл-углерод. Однако, вспомнив лекцию консультанта компании о легком окислительном присоединении иодистого метила к металлокомплексам, исследователи решили добавить в реакционную смесь иодный промотор и получили блестящий результат, которому сперва не поверили. Подобное открытие было сделано также учеными конкурирующей компании "Union Carbide", те отстали всего на несколько месяцев. Команда по разработке технологии карбонилирования метанола всего через 5 месяцев интенсивной работы создала промышленный процесс Монсанто, с помощью которого в 1970 году было получено 150 тыс. т уксусной кислоты. Этот процесс стал предвестником той области науки, которая получила название С1-химии. Механизм карбонилирования был тщательно исследован. Иодистый метил, необходимый для осуществления реакции, получается по уравнению CH3OH + HI CH3I + H2O Каталитический цикл может быть представлен так: К плоскоквадратному комплексу [RhI2(CO)2]- (I) окислительно присоединяется иодистый метил с образованием шестикоординационного комплекса II, затем в результате внедрения СО по связи метил-родий образуется ацетилродиевый комплекс (III). Восстановительное элиминирование иодангидрида уксусной кислоты регенерирует катализатор, а гидролиз иодангидрида дает уксусную кислоту. Промышленный синтез уксусной кислоты: a) каталитическое окисление бутана 2CH3–CH2–CH2–CH3 + 5O2 t 4CH3COOH + 2H2O b) нагреванием смеси оксида углерода (II) и метанола на катализаторе под давлением  Производство уксусной кислоты брожением (уксуснокислое брожение). Сырье: этанолсожержащие жидкости (вино, забродившие соки), кислород. Вспомогательные вещества: ферменты уксуснокислых бактерий. Химическая реакция: этанол биокаталитически окисляется до уксусной кислоты.  СН 2 – СН – ОН + О 2 СН 2 – СООН + Н 2 О СН 2 – СН – ОН + О 2 СН 2 – СООН + Н 2 ООсновной продукт: уксусная кислота. 4. Применение уксусной кислоты Уксусную кислоту, концентрация которой близка к 100 %, называют ледяной. 70-80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3-6 % — уксусом. Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании. Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении. Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту. Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния. ЗАКЛЮЧЕНИЕ В данной работе были рассмотрены вопросы открытия уксусной кислоты, ее основные свойства, получение и применение. Итак, уксусная кислота (CH3COOH), бесцветная горючая жидкость с резким запахом, хорошо растворимая в воде. Имеет характерный кислый вкус, проводит электрический ток. Применение уксусной кислоты в промышленности весьма велико. Уксусная кислота, производимая в России, находится на уровне лучших мировых стандартов, пользуется высоким спросом на мировом рынке и экспортируется во многие страны мира. Производство уксусной кислоты имеет ряд своих специфических требований, поэтому необходимы специалисты, имеющие широкий опыт не только в области автоматизации производства и управления процессами, но и четко понимающие специальные требования этой отрасли промышленности. Список использованной литературы Артеменко, Александр Иванович. Справочное руководство по химии/ А.И. Артеменко, И.В. Тикунова, В.А. Малеванный. - 2-е изд., перераб. и доп. - М.: Высшая школа, 2012. - 367 с Зоммер К. Аккумулятор знаний по химии. Пер. с нем., 2-е изд. – М.: Мир, 2015. – 294 с. Катализ в С1-химии / Под ред. В. Кайма. М., 2015. 296 с. Интернет-ресурсы: https://wreferat.baza-referat.ru/Уксусная_кислота https://otherreferats.allbest.ru/chemistry/d00847177.html |
