ВПС. Министерство здравоохранения республики беларусь
 Скачать 0.69 Mb. Скачать 0.69 Mb.
|
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬУО «ВИТЕБСКИЙ ГОСУДАРСТВЕННЫЙ ОРДЕНА ДРУЖБЫ НАРОДОВ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ» КАФЕДРА ПЕДИАТРИИ ФПК И ПК Т.М. РябоваВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА У ДЕТЕЙУчебно-методическое пособие Витебск 2011 УДК 616.12-007-058.86 ББК 54.101,50я73+57.33я73 Р 98 Автор: кандидат медицинских наук Рябова Т.М. Рецензент: заведующая кафедрой педиатрии ВГМУ, доктор медицинских наук, профессор И.М. Лысенко Утверждено Центральным учебно-научно-методическим Советом Витебскогогосударственного медицинского университета в качестве учебно-методического пособия, протокол № 8 от 19.10. 2011 г. Рябова Т.М. Р 98 Врожденные пороки сердца у детей: Учеб.-метод. пособие / Т. М. Рябова – Витебск: ВГМУ, 2011. – 38 с. В пособии изложены современные представления о гемодинамических нарушениях, клинических проявлениях, диагностических критериях и вариантах лечения врожденных пороков сердца у детей. Учебно-методическое пособие предназначено для студентов высших медицинских учреждений образования, врачей-интернов, врачей-педиатров, врачей общей практики. УДК 616.12-007-058.86 ББК 54.101,50я73+57.33я73 © Рябова Т. М. 2011 © УО "Витебский государственный медицинский университет", 2011 Введение Врожденные пороки сердца (ВПС) являются одной из самых частых аномалий развития, встречаются с частотой 8-12 на 1000 живорожденных детей. Причины возникновения врождённых пороков сердца разнообразны. Наиболее уязвимый период – 3-9 недель беременности, это есть время, когда происходит закладка и формирование структур сердца. Большое значение имеют тератогенные факторы внешней среды, соматические заболевания матери и отца, инфекции, особенно вирусные (вирус краснухи, ЦМВ, ВПГ, вирус гриппа, энтеровирус, вирус Коксаки В и др.), а также алкоголизм родителей, приём наркотических веществ, курение матери, профессиональные вредности. Ассоциированы с врождёнными пороками сердца многие хромосомные заболевания (синдромы Дауна, Патау, Эдвардса, Шерешевского-Тернера и т.д.). Классификация врожденных пороков сердца Существует несколько классификаций врождённых пороков сердца. Создание единой классификации врождённых пороков сердца связано с определенными трудностями в связи с огромным количеством разновидностей пороков и принципов, которые могут быть положены в её основу. Классификация, в которой врождённые пороки сердца распределены с учётом анатомических особенностей и гемодинамических нарушений удобна для использования в практической деятельности врача. В данной классификации все пороки разделяют на три группы: 1. врождённые пороки сердца бледного типа с артериовенозным шунтом, т.е. со сбросом крови слева направо: ДМЖП, ДМПП, ОАП. 2. врождённые пороки сердца синего типа с веноартериальным сбросом, т.е. со сбросом крови справа налево: полная транспозиция магистральных сосудов, тетрада Фалло. 3. врождённые пороки сердца без сброса, но с препятствием к выбросу крови из желудочков (стенозы лёгочной артерии, стеноз аорты, коарктация аорты). Существуют еще врождённые пороки сердца, не входящие по своим гемодинамическим характеристикам ни в одну из трёх представленных групп. Это пороки без сброса крови и без стеноза: врождённая недостаточность клапанов сердца, аномалия развития трёхстворчатого клапана Эбштейна, корригированная транспозиция магистральных сосудов. К наиболее часто встречающимся ВПС относят пороки «большой пятерки»: дефект межжелудочковой перегородки (ДМЖП), коарктацию аорты (КА), транспозицию магистральных артерий (ТМА), открытый артериальный проток (ОАП) и тетраду Фалло (ТФ). В естественном течении ВПС выделяют следующие фазы: 1. Фаза адаптации Во внутриутробном периоде при большинстве ВПС не развивается декомпенсация. С рождением ребенка и первым вдохом начинает функционировать малый круг кровообращения с последующим постепенным закрытием фетальных коммуникаций: артериального протока, открытого овального окна и разобщение кругов кровообращения. В периоде адаптации происходит становление как общей, так и внутрисердечной гемодинамики. При неадекватной гемодинамике (резкое обеднение кровообращения в малом круге кровообращения (МКК), полное разобщение кругов кровообращения, выраженный застой в МКК) состояние ребенка прогрессивно и резко ухудшается, что заставляет проводить экстренные паллиативные вмешательства. 2. Фаза компенсации Для этого периода характерно подключение большого количества компенсаторных механизмов с целью обеспечения существования организма в условиях нарушенной гемодинамики. Выделяют кардиальные и экстракардиальные компенсаторные механизмы. К кардиальным относится: увеличение активности ферментов цикла аэробного окисления (сукцинатдегидрогеназы), вступление в действие анаэробного обмена, закон Франка-Старлинга, гипертрофия кардиомиоцитов. К экстракардиальным механизмам компенсации относится активация симпатического звена ВНС, что приводит к увеличению числа сердечных сокращений и централизации кровообращения, а также повышение активности ренин-ангиотензин-альдостероновой системы. Вследствие активации последней повышение артериального давления сохраняет адекватное кровоснабжение жизненно важных органов, а задержка жидкости приводит к увеличению объёма циркулирующей крови. Задержке излишней жидкости в организме и формированию отеков противостоит предсердный натрийуретический фактор. Стимуляция эритропоэтина приводит к увеличению количества эритроцитов и гемоглобина и, таким образом, повышению кислородной ёмкости крови. 3. Фаза мнимого благополучия – это период, который обеспечивается компенсаторными возможностями организма. Именно 2 и 3 фазы течения ВПС – оптимальное время для проведения радикальных оперативных вмешательств. 4. Фаза декомпенсации Для этого периода характерно истощение компенсаторных механизмов и развитие рефрактерной к лечению сердечной недостаточности, формирование необратимых изменений во внутренних органах. Клинические проявления ВПС в основном представлены двумя синдромами: артериальной гипоксемии и застойной сердечной недостаточности. Синдром артериальной гипоксемии может проявляться с рождения. В его генезе может участвовать целый ряд факторов, таких как асфиксия, респираторный дистресс-синдром, аспирация в родах, врожденная пневмония, ателектаз легкого, пневмоторакс, диафрагмальная грыжа, метгемоглобинемия, полицитемия, сепсис. Цианоз может иметь и центральное происхождение вследствие кровоизлияния в желудочки мозга. Снижается содержание кислорода и рН в капиллярной крови. В норме рО2 составляет 60-80 мм.рт.ст., а SO2 96-98%. Артериальная гипоксемия характеризуется снижением рО2 до 50 мм.рт.ст., а цианоз становится заметным при уровне насыщения гемоглобина менее 75-85%. У новорожденного с высоким уровнем фетального гемоглобина цианоз будет явным при относительно меньшей величине рО2. При длительной и резко выраженной гипоксемии в тканях включаются механизмы анаэробного гликолиза, происходит накопление кислых продуктов метаболизма и развивается метаболический ацидоз. В формировании артериальной гипоксемии при ВПС могут играть роль три основных механизма: 1) внутрисердечный сброс крови справа налево и её поступление в аорту; 2) сниженный легочный кровоток и уменьшенный легочный возврат артериальной крови к сердцу; 3) разобщение большого и малого кругов кровообращения. При большинстве ВПС цианотического типа артериальная гипоксемия связана с первыми двумя механизмами. Для дифференциальной диагностики происхождения цианоза применяется тест с дыханием 100% кислородом. Оценку результатов теста проводят через 10-15 минут дыхания 100% кислородом. У больных с «сердечным» цианозом рО2 возрастает не более чем на 10-15 мм.рт.ст., так как величина концентрации О2 в легких практически не влияет на величину примеси венозной крови к артериальной на уровне внутрисердечных сообщений. При характеристике артериальной гипоксемии необходимо оценивать её уровень (рО2, SO 2), тяжесть (степень ацидоза), а также наличие вторичной дисфункции жизненно важных органов, что и будет определять комплекс лечебных мероприятий. Сердечная недостаточность – это патологическое состояние, при котором сердце не способно обеспечить кровообращение, необходимое для обеспечения потребностей организма. Чаще всего развивается либо в связи с повышенной нагрузкой на сердце объёмом крови или давлением, либо вследствие снижения сократимости миокарда при гипоксии или воспалительном процессе в сердечной мышце. Основными симптомами сердечной недостаточности являются тахикардия, одышка, признаки застоя по малому или большому кругу кровообращения. У маленьких детей сердечная недостаточность почти всегда носит бивентрикулярный характер. Для оценки степени сердечной недостаточности применяется классификация Василенко-Стражеско. В классификации сердечной недостаточности, разработанной А.С. Шарыкиным (2000 г.) и адаптированной к новорожденным детям, выделяется: 1 степень – умеренные тахикардия и одышка (до 120% от нормы) в покое или при небольшой физической нагрузке (кормление); печень выступает из-под края реберной дуги по средне-ключичной линии на +3 см. Размеры сердца могут быть не увеличены. С помощью медикаментозной терапии удается добиться компенсации показателей. 2 степень – нарастание тахикардии и одышки до 125-150% от нормы; печень выступает из-под края реберной дуги более чем +3 см. Возможны отёки на стопах и на лице, беспокойство, затрудненное кормление, периодически прослушиваются непостоянные застойные хрипы в легких. Рентгенологически и при ЭхоКГ – заметная дилатация полостей желудочков. Медикаментозная терапия позволяет уменьшить симптомы до уровня 1 степени. 3 степень – тахикардия и одышка достигают 160% и более, плотная увеличенная печень (более +3 см), периферические отёки и асцит; постоянные застойные хрипы в лёгких. Ребёнок вял, заторможен. Размеры сердца значительно увеличены. Стандартная медикаментозная терапия малоэффективна. Нередко требуется проведение ИВЛ для стабилизации состояния. 4 степень (кардиогенный шок) – артериальная гипотония, декомпенсированный ацидоз, периферический спазм (снижено наполнение капилляров кровью, бледность, холодные конечности), резкое угнетение ЦНС, олигурия. Возможна брадикардия. Осложнения ВПС: Сердечная недостаточность. Бактериальный эндокардит (чаще отмечается при цианотических ВПС). Ранние затяжные пневмонии на фоне застоя в малом круге кровообращения. Высокая легочная гипертензия или синдром Эйзенменгера (характерна для ВПС с обогащением малого круга кровообращения). Синкопэ вследствие синдрома малого выброса вплоть до развития нарушения мозгового кровообращения (по ишемическому типу - при цианотических ВПС и стенозе аорты; по геморрагическому типу – при коарктации аорты). Стенокардитический синдром и инфаркты миокарда (наиболее характерны для стенозов аорты, аномального отхождения левой коронарной артерии). Одышечно-цианотические приступы (встречаются при тетраде Фалло с инфундибулярным стенозом легочной артерии, транспозиции магистральных артерий и др.). Релятивная анемия – при цианотических ВПС. Врожденные пороки сердца бледного типа Дефект межжелудочковой перегородки Врождённый порок развития межжелудочковой перегородки, в результате чего возникает сообщение между правым и левым желудочком. Дефект может располагаться в мембранозной или мышечной части межжелудочковой перегородки в виде овального, круглого и или конусовидного отверстия (рисунок 1 и 2). 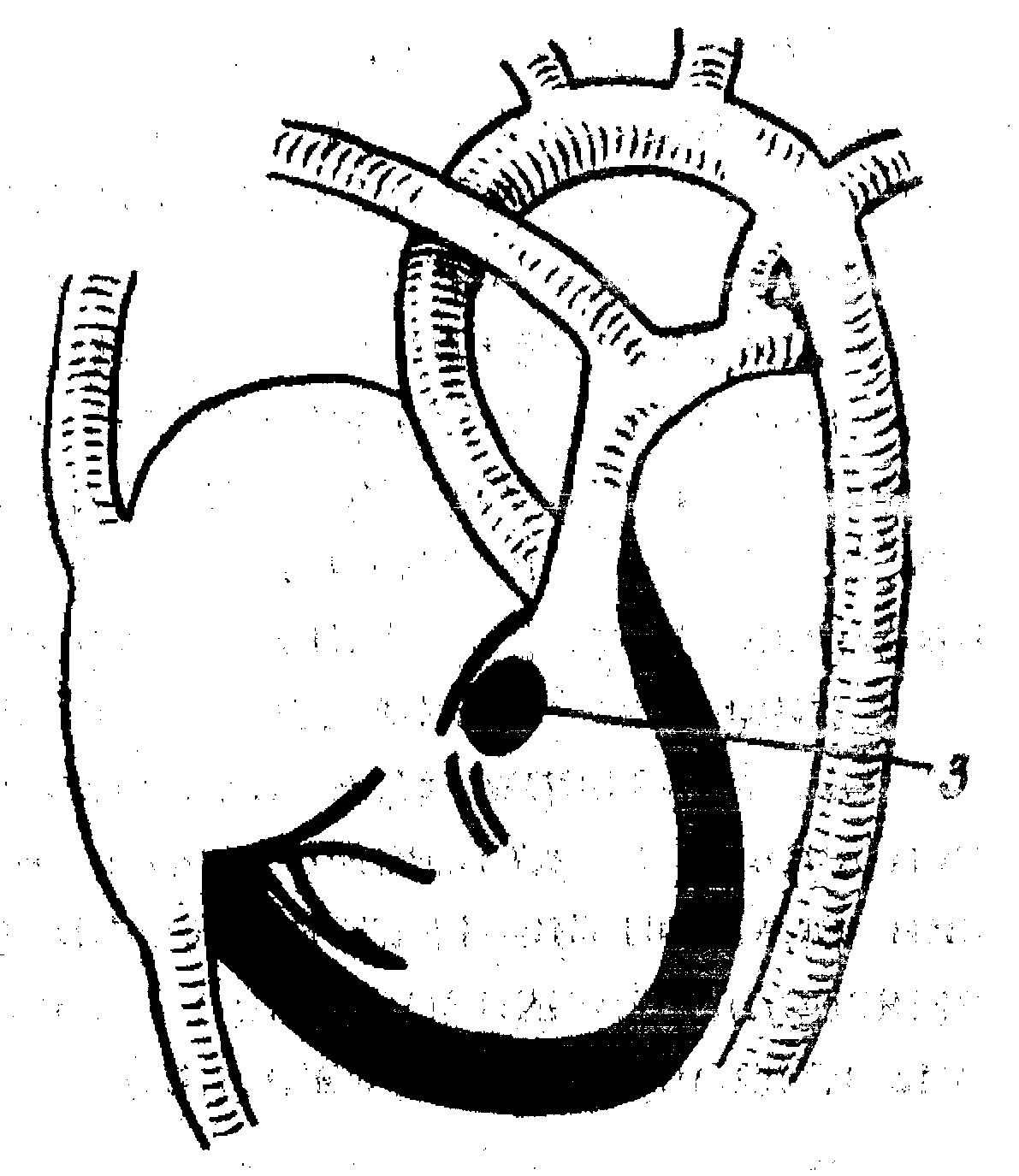 Рисунок 1. Высокий дефект межжелудочковой перегородки 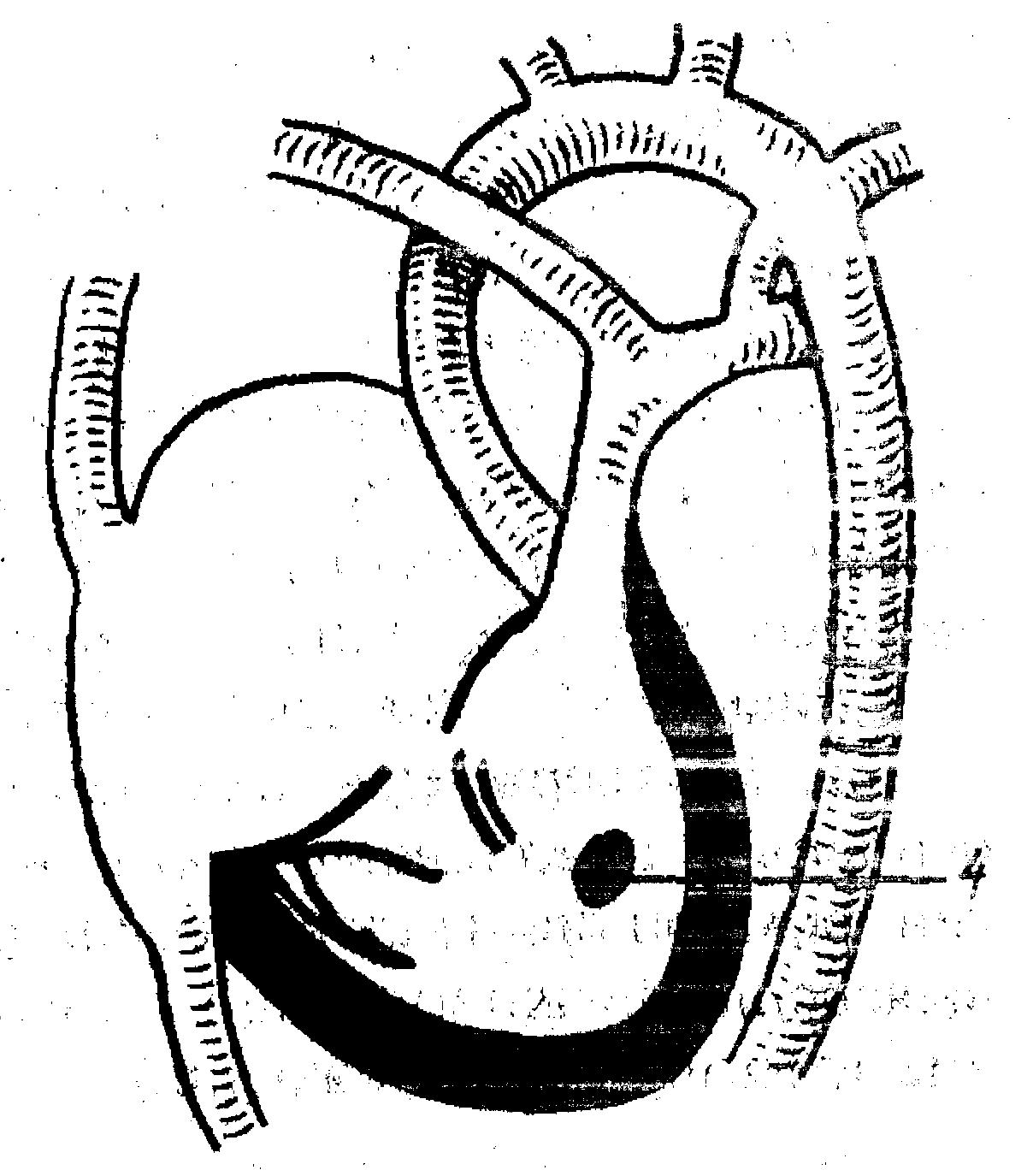 Рисунок 2. Низкий дефект межжелудочковой перегородки Диаметр отверстия бывает от 1 до 30 мм. Дефекты могут быть единичными или множественными. Большинство из них имеют перимембранозную локализацию (до 80%). На долю мышечных ДМЖП приходится около 20%. Мелкие дефекты размером 1-2 мм, расположенные в мышечной части МЖП, называются болезнью Толочинова–Роже. Вследствие хорошей аускультативной картины и отсутствия гемодинамических нарушений для их характеристики уместно выражение: «много шума из ничего». Отдельно выделяют множественные большие дефекты МЖП, по типу «швейцарского сыра», имеющие неблагоприятное прогностическое значение. 60% больных кроме ДМЖП обычно имеют сопутствующие аномалии сердца: дефект межпредсердной перегородки, ОАП, коарктация аорты, стеноз лёгочного или аортального клапана, аортальная недостаточность. Гемодинамика Гемодинамические нарушения при ДМЖП начинают формироваться спустя некоторое время после рождения, как правило, на 3-5 сутки жизни. В раннем неонатальном периоде шум в сердце может отсутствовать вследствие одинакового давления в правом и левом желудочках из-за так называемой неонатальной легочной гипертензии. Постепенное падение давления в системе легочной артерии и в правом желудочке создаёт разность (градиент) давлений между желудочками, вследствие чего появляется сброс крови слева-направо. Дополнительный объём крови, поступающий в правый желудочек и легочную артерию, приводит к переполнению сосудов малого круга кровообращения, где развивается легочная гипертензия. В связи с повышенным возвратом крови в левые отделы развивается объёмная перегрузка левого предсердия и левого желудочка. Размеры сердца увеличиваются. Клиническая симптоматика при ДМЖП заключается в симптомокомплексе сердечной недостаточности. Дефекты с большим сбросом слева направо обычно проявляются клинически с 4-8 недель жизни, сопровождаются задержкой роста и развития, повторными респираторными инфекциями, снижением толерантности к физической нагрузке, сердечной недостаточностью со всеми классическими симптомами (повышенная потливость, тахипноэ, застойные хрипы в лёгких, тахикардия, гепатомегалия, отёчный синдром). ДМЖП может манифестировать ранними и тяжелыми пневмониями. Кожные покровы бледные с небольшим периферическим цианозом. При физикальном исследовании сердечно-сосудистой системы обнаруживают бистернальный килевидный сердечный «горб», образуемый счёт увеличения правого желудочка («грудь Дэвиса»). Верхушечный толчок разлитой, усиленный; определяется патологический сердечный толчок. Можно обнаружить систолическое дрожание в третьем-четвёртом межреберье слева, свидетельствующее о сбросе крови в правый желудочек. Границы относительной сердечной тупости расширены в обе стороны, особенно влево. В течение первых недель жизни шум может полностью отсутствовать в связи с высокой резистентностью лёгочных сосудов и отсутствием сброса крови через дефект. Характерный аускультативный признак порока – постепенное появление и нарастание скребущего систолического шума с максимальной точкой выслушивания в третьем-четвёртом межреберье слева от грудины. По мере развития большого сброса II тон на лёгочной артерии становится усиленным и расщеплённым. При ДМЖП в мышечной части (болезнь Толочинова-Роже) жалобы, клинические проявления порока отсутствуют, за исключением скребущего систолического шума средней интенсивности, выслушиваемого в четвёртом-пятом межреберье слева от грудины. Лёгочная гипертензия не развивается, возможно спонтанное закрытие дефекта. ЭКГ имеет свои закономерности, тесно связанные с фазой течения ВПС и степенью лёгочной гипертензии. Сначала выявляются признаки перегрузки левого желудочка – повышение его активности, затем развитие его гипертрофии. С течением времени присоединяются признаки перегрузки и гипертрофии правых отделов сердца – как предсердия, так и желудочка, - это свидетельствует о высокой лёгочной гипертензии. Электрическая ось сердца всегда отклонена вправо. Могут встречаться нарушения проводимости – от признаков неполной блокады правой ножки пучка Гиса до полной атрио-вентрикулярной блокады. Рентгенография органов грудной клетки позволяет выявить гиперволемию малого круга кровообращения. Увеличение тени сердца связано, в основном, с левым желудочком и левым предсердием, в меньшей степени — с правым желудочком. При Допплер-ЭхоКГ уточняется место расположения дефекта, его размер, определяется давление в правом желудочке и лёгочной артерии. Лечение Тактику лечения определяет гемодинамическая значимость порока и известный для него прогноз. Лечение данного порока подразумевает консервативную терапию сердечной недостаточности и хирургическую коррекцию порока сердца. Консервативное лечение складывается из препаратов инотропной поддержки (симпатомиметики, сердечные гликозиды), мочегонных препаратов, кардиотрофиков. В случаях высокой легочной гипертензии назначаются ингибиторы ангиотензинпревращающего фермента – капотен или каптоприл. Оперативные вмешательства подразделяются на паллиативные операции (в случае ДМЖП – операция суживания лёгочной артерии по Мюллеру) и радикальную коррекцию порока – пластика дефекта межжелудочковой перегородки в условиях искусственного кровообращения. Осложнения Осложнение дефекта межжелудочковой перегородки – синдром Эйзенменгера, характеризующийся значительным повышением давления в лёгочной артерии, когда оно становится равным или превышает давление в аорте. Самым характерным признаком синдрома Эйзенменгера является постепенное нарастание цианоза, – сначала периферического, а в дальнейшем и диффузного. В этой гемодинамической ситуации шум основного порока может ослабевать или полностью исчезать, нарастает акцент II тона на лёгочной артерии, часто приобретая «металлический» оттенок звучания. На этом фоне можно зафиксировать появление нового диастолического шума, обусловленного недостаточностью клапанов лёгочной артерии (шум Грехема-Стилла). Сосуды малого круга кровообращения могут претерпевать морфологические изменения, склерозироваться – наступает склеротическая стадия лёгочной гипертензии. Направление сброса крови может измениться: кровь начинает сбрасываться справа налево, и порок бледного типа трансформируется в порок синего типа. Чаще всего подобная ситуация возникает при позднем выявлении порока, при отсутствии своевременной кардиохирургической помощи. При развитии синдрома Эйзенменгера больные с врождённым пороком сердца становятся неоперабельными. |
