изомерия номенклатура органических соединений. Номенклатура, изомерия, гомология органических соединений. Номенклатура, изомерия, гомология органических соединений
 Скачать 303.5 Kb. Скачать 303.5 Kb.
|
|
номенклатура, изомерия, гомология органических соединений Органическая химия представляет собой обширный и самостоятельный раздел химической науки. Она изучает органические соединения, их строение и закономерности протекания реакций с участием органических веществ. К органическим соединениям относят соединения углерода с другими элементами за исключением простейших (оксидов углерода, карбидов, угольной кислоты и ее солей). Атомы углерода обладают уникальной способностью соединяться друг с другом в длинные цепи и циклы. Кроме того, они могут образовывать между собой и с другими атомами двойные и тройные связи. Эти свойства (изомерия, гомология) обуславливают существование в природе большого числа соединений углерода, точное количество которых посчитать невозможно. Ученым известно более 18 млн. органических веществ, в то время как неорганических около 100 тыс. В органической химии есть свои закономерности и правила. К примеру, в одном из средневековых алхимических трактатов можно прочитать такое описание химического опыта: «…С запада продвигайся сквозь сумерки на север; преврати воду в черную землю; поднимись через разные цвета к востоку, где показывается полная луна…» Подобные красочные, но, увы, непонятные строки часто встречаются в рукописях алхимиков. Это и не удивительно: можно ли выдавать непосвященным способы получения золота и эликсира, обещающего вечную молодость! Превращение химии в науку требовало прежде всего создания общепонятной терминологии и важнейшей ее части – номенклатуры, т.е. системы названий химических соединений. Важные шаги в этом направлении сделал А.Лавуазье в конце XVIII века. Но в номенклатуре органических соединений задача более сложная, чем в неорганической: здесь недостаточно указать состав вещества, надо в названии отразить и его строение, чтобы отличить от других, изомерных органических веществ. Эту задачу химики решают, используя сложные слова-названия, построенные из обозначений отдельных составных частей и цифр или букв, указывающих порядок взаимосвязи отдельных частей молекулы. Используются три основных подхода к составлению названий: Тривиальная номенклатура – сложилась исторически, часто – по названию источника получения вещества. Необходимо знать тривиальные названия веществ, наиболее широко применяемых в быту и органическом синтезе: этилен, ацетилен, формальдегид (муравьиный альдегид), ацетальдегид (уксусный альдегид), этиленгликоль, глицерин, муравьиная, уксусная, масляная кислоты, аллилен (пропин), кротонилен (бутин-1), валерилен (пентин-1) и др. По рациональной (радикало-функциональной) номенклатуре основой названия служит простой представитель гомологического ряда с указанием усложняющих заместителей. Например: СН3-СН2-СН-СН2-СН2-СН3 метил-этил-пропилметан СН3 СН3 - С - СН2Сl хлорацетон О СН3 –СН - СН-СООН β-амино-α-пропилмасляная кислота NН2 С3Н7 Последний пример показывает, что основой рационального названия может служить не обязательно первый представитель гомологического ряда. Для построения заместительного названия по современным правилам ИЮПАК (существенно отличным от Женевских правил 1892 года, в которых были заложены основы заместительной номенклатуры) прежде всего, находят главную функцию и главную цепь, которые вместе образовывают родоначальную структуру; все остальные части молекулы рассматриваются как заместители в родоначальной структуре. При определении главной функции руководствуются следующей таблицей, в которой функции перечислены в порядке падающего старшинства. таблица 1 - Функциональные группы и их обозначения
Итак, общая схема заместительного (систематического) названия имеет следующий вид: Корень названия показывает, сколько атомов углерода содержится в главной цепи (мет -1, эт – 2, проп – 3, бут – 4, далее по греческим числительным). Суффикс говорит о кратности связи (ен – двойная, ин – тройная) или наличии функциональной группы (ил – углеводородный радикал, ол – спирт, он – кетон, аль – альдегид) Приставка характеризует форму углеродной цепи (цикло – замкнутая цепь) или указывает на количество однотипных радикалов, кратных связей, функциональных групп. Во втором случае приставка называется «умножающей», она записывается перед названием радикала или перед суффиксом: ди-два, три-три и т.д. Цифра указывает на место нахождения (для радикалов - перед названием, для остальных – после). Порядок составления названия: А) выбор главной цепи регулируется следующими правилами: - должна быть самой длинной, - включать кратные связи и/или функциональные группы; Б) нумерация цепи начинается с того конца, к которому ближе: - функциональная группа; - кратная связь; - наименьший углеводородный радикал. Если вещество содержит цикл, то именно он будет главной цепью, которая нумеруется в порядке старшинства в сторону ближайшего заместителя. В) далее перечисляются: - место, количество и названия радикалов; Корень (с приставкой или без нее); - название функции и ее место. Таблица 2 – основы номенклатуры органических соединений
Так, приведенное выше соединение имеет современное заместительное название – 3-амино-2-пропилбутановая кислота. Более сложный пример: С6Н5 –СН - СН = СН – С – СН - СН3 СН3 СН3 О Сl Например, СН3 – СН2 - СН = СН – СН (СН3) – СН = СН - СОН 4-метилоктадиен-2,5-аль Названия радикалов
Упражнения: 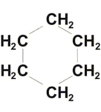 Циклогексан 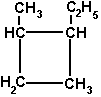 1-метил-2-этилциклобутан 6 5 4 3 2 1 СН3–СН–СН2–СН=СН–СН3 5-метилгексен-2 СН3 6 5 4 3 2 1 СН3–СН–СН2–СС–СН3 5-метилгексин-2 СН3 1 2 3 4 СН2=СН–СН=СН2 бутадиен-1,3 (дивинил) Название "дивинил" происходит от названия радикала –СН=СН2"винил". 1 2 3 4 СН2=С–СН=СН2 2-метилбутадиен-1,3 СН3 (изопрен) 6 5 4 3 2 1 СН3–СН=СН–СН–СН=СН2 3-метилгексадиен-1,4 СН3 С6Н5СH3 С6Н5С2H5 С6Н5С3H7 метилбензол этилбензол пропилбензол (толуол) CH3–CO–CH3 - диметилкетон (ацетон) CH3CH2CH2–CO–CH3 - метилпропилкетон CH3CH2CH2–CO–CH3 - пентанон-2 CH2=CH–CH2–CO–CH3 - пентен-4-он-2 C2H5 NH2 этиламин, CH3NHC2H5 метилэтиламин, (CH3)3N триметиламин, C6H5NH2 фениламин C6H5-NH-CH3 метилфениламин (C6H5)2NH дифениламин (C6H5)3N трифениламин Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы NH2. Аминогруппа при этом рассматривается как заместитель и обозначается приставкой амино, а ее местоположение указывается цифрой в начале названия. Наличие нескольких аминогрупп отражается умножительными приставками ди-, три-, тетра-, пента- и т.д. H2N–CH2-CH2-CH2-CH2–NH2 1,4-диаминобутан Анилин (фениламин) C6H5NH2 в соответствии с этим способом называется аминобензолом. По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино и указанием места расположения аминогруппы по отношению к карбоксильной группе. Например: CH3 CH2 CH COOH CH3 CHCH2 COOH NH2 NH2 2-аминобутановая кислота 3-аминобутановая кислота Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино с указанием положения аминогруппы буквой греческого алфавита. CH3 CH2 CH COOH CH3 CHCH2 COOH NH2 NH2 -аминомасляная кислота -аминомасляная кислота Если в молекуле аминокислоты содержится две аминогруппы, то в ее названии используется приставка диамино, три группы NH2 – триамино и т.д. H2N CH2 CH COOH NH2 2,3-диаминопропановая кислота Наличие двух или трех карбоксильных групп отражается в названии суффиксом –диовая или -триовая кислота: HOOC CH2 CH COOH NH2 2-аминобутандиовая кислота Ведущими понятиями органической химии являются гомология (гомологи- вещества сходного химического строения, но отличающиеся по составу на одну или несколько групп – СН2-(гомологическая разность) представители каждого класса органических веществ образуют гомологический ряд и являются гомологами) и изомерия. Изомерия (Й.Берцелиус, 1830) (от др.-греч. — «равный», «доля, часть») — явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам (Ю.Либих, Ф.Велер, 1824 год – циановая и фульмитиновая кислоты). Различают следующие виды изомерии: Структурная изомерия — результат различий в химическом строении (Изомерия углеводородной цепи (углеродного скелета); и. положения (кратной связи, функциональной группы); и. межклассовая) Пространственная изомерия (стереоизомерия) - возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение (геометрическая и. (для соединений, имеющих плоскостное строение молекул: для веществ с двойной углерод-углеродной связью. Если простейшие заместители у атомов углерода при двойной связи находятся по одну сторону плоскости молекулы (С=С связи), молекула является цис-изомером, если по разные стороны – транс-изомером); оптическая изомерия характерна для молекул с асимметрическим центром – атом углерода, связанный с четырьмя различными заместителями. Оптические изомеры являются зеркальным изображением друг друга, подобно двум ладоням, и не совместимы. Например, в виде двух оптических изомеров существует 2-оксипропановая кислота (молочная), содержащая один асимметричный центр: 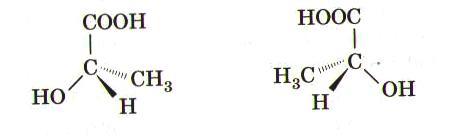 Изомерия углеводородов видна в таблице 3. 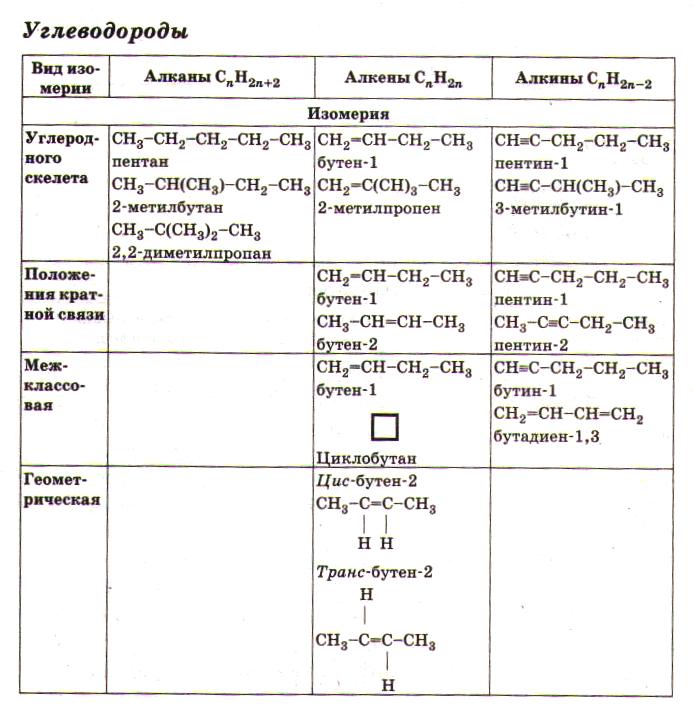 Изомерия циклоалканов Для циклоалканов характерны как структурная, так и пространственная изомерия. Структурная изомерия 1. Изомерия углеродного скелета: а) кольца б) боковых цепей 2. Изомерия положения заместителей в кольце 3. Межклассовая изомерия с алкенами Пространственная изомерия 1. Цис-транс-изомерия, обусловленная различным взаимным расположением в пространстве заместителей относительно плоскости цикла. В цис-изомерах заместители находятся по одну сторону от плоскости кольца, в транс-изомерах – по разные 2. Оптическая (зеркальная) изомерия некоторых ди- (и более) замещенных циклов. Например, транс-1,2-диметилциклопропан может существовать в виде двух оптических изомеров, относящихся друг к другу как предмет и его зеркальное изображение 3. Поворотная изомерия Изомерия алкенов Структурная изомерия1. Изомерия углеродного скелета (начиная с С4Н8): СН2=СНСН2СН3 СН2=ССН3 СН3 бутен-1 2-метилпропен 2. Изомерия положения двойной связи (начиная с С4Н8): СН2=СНСН2СН3 СН3СН=СНСН3 бутен-1 бутен-2 3. Межклассовая изомерия с циклоалканами, начиная с С3Н6 . Пространственная изомерияВращение атомов вокруг двойной связи невозможно без ее разрыва. Это обусловлено особенностями строения -связи (-электронное облако сосредоточено над и под плоскостью молекулы). Вследствие жесткой закрепленности атомов поворотная изомерия относительно двойной связи не проявляется. Но становится возможной цис-транс-изомерия. Алкены, имеющие у каждого из двух атомов углерода при двойной связи различные заместители, могут существовать в виде двух пространственных изомеров, отличающихся расположением заместителей относительно плоскости -связи. Так, в молекуле бутена-2 СН3СН=СНСН3 группы СН3 могут находиться либо по одну сторону от двойной связи в цис-изомере, либо по разные стороны в транс-изомере. Цис-транс-изомерия не проявляется, если хотя бы один из атомов С при двойной связи имеет 2 одинаковых заместителя. Например, бутен-1 СН2=СНСН2СН3 не имеет цис- и транс-изомеров, т.к. 1-й атом С связан с двумя атомами Н. Иногда цис-транс-изомерию не совсем точно называют геометрической изомерией. Неточность состоит в том, что все пространственные изомеры различаются своей геометрией, а не только цис- и транс-. Изомерия алкинов Структурная изомерия 1. Изомерия положения тройной связи (начиная с С4Н6): СНССН2СН3 СН3СССН3 бутин-1 бутин-2 2. Изомерия углеродного скелета (начиная с С5Н8): СНССН2СН2СН3 СНССНСН3 СН3 пентин-1 3-метилбутин-1 3. Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н8: СН = СН СНС–СН2–СН3 СН2=СН–СН=СН2 СН2 –СН2 бутин-1 бутадин-1,3 циклобутен Пространственная изомерия относительно тройной связи в алкинах не проявляется, т.к. заместители могут располагаться только одним способом вдоль линии связи. Изомерия сопряженных диенов Структурная изомерия 1. Изомерия положения сопряженных двойных связей: СН2=СН–СН=СН–СН2–СН3 СН3–СН2=СН–СН=СН–СН3 гексадиен-1,3 гексадиен-2,4 2. Изомерия углеродного скелета: СН2=СН–СН=СН–СН3 СН2=С–СН=СН2 пентадиен-1,3 СН3 2-метилбутадиен-1,3 (изопрен) 3. Межклассовая изомерия с алкинами и циклоалкенами. Например, формуле С4Н6 соответствуют следующие соединения: СН = СН СН2=СН–СН=СН2 СНС–СН2–СН3 СН2 –СН2 бутадиен-1,3 бутин-1 циклобутен Пространственная изомерия Диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис-транс-изомерию. Изомерия Аренов орто- (о-) заместители у соседних атомов углерода кольца, т.е. 1,2; мета- (м-) заместители через один атом углерода (1,3); пара- (п-) заместители на противоположных сторонах кольца (1,4). Изомерия (структурная): 1) положения заместителей для ди-, три- и тетра-замещенных бензолов (например, о-, м- и п-ксилолы,; 2) углеродного скелета в боковой цепи, содержащей не менее 3-х атомов углерода; 3) изомерия заместителей, начиная с С2Н5. Например, молекулярной формуле С8Н10 соответствует 4 изомера: три ксилола СH3С6Н4СH3 (о-, м-, п-) и этилбензол С6Н5С2H5. Пространственная изомерия относительно бензольного кольца в алкилбензолах отсутствует. Изомерия спиртов Для спиртов характерна структурная изомерия: изомерия положения ОН-группы, начиная с С3 ; углеродного скелета, начиная с С4 ; межклассовая изомерия с простыми эфирами. Например, одну и ту же молекулярную формулу С2H6O имеют: СН3CH2–OH и CH3–O–CH3 этиловый спирт диметиловый эфир Возможна также пространственная (оптическая) изомерия. Например, бутанол-2 H | СH3CСH2CH3, | OH в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя различными заместителями, существует в форме двух зеркальных изомеров . Изомерия альдегидов и кетонов Для альдегидов и кетонов характерна структурная изомерия. Изомерия альдегидов: изомерия углеродного скелета, начиная с С4 . межклассовая изомерия: - с кетонами, начиная с С3 ; - циклическими оксидами (с С2); - непредельными спиртами и простыми эфирами (с С3). Изомерия кетонов: углеродного скелета (c C5); положения карбонильной группы (c C5); межклассовая изомерия (аналогично альдегидам). Карбоновые кислотыCтруктурная изомерияизомерия скелета в углеводородном радикале, начиная с C4 межклассовая изомерия, начиная с C2. Например, формуле C2H4O2 соответствуют 3 изомера, относящиеся к различным классам органических соединений. Пространственная изомерия Возможна цис-транс изомерия в случае непредельных карбоновых кислот Оптическая изомерия проявляется кислотами, в молекулах которых карбоксильная группа связана с асимметрическим атомом углерода (С*). Углеводы Циклические - и -формы глюкозы представляют собой пространственные изомеры, отличающиеся положением полуацетального гидроксила относительно плоскости кольца. Полуацетальную группу ОН в углеводах называют также гликозидным гидроксилом. В -глюкозе этот гидроксил находится в транс-положении к гидроксиметильной группе -СН2ОН, а в -глюкозе – в цис-положении. Иногда рассматривают положение полуацетального гидроксила по отношению к соседнему гидроксилу при С2. В этом случае -глюкоза является цис-изомером, а -глюкоза - транс-изомером. Однако этот способ менее универсален. Изомерия аминов Структурная изомерия - углеродного скелета, начиная с С4H9NH2 - положения аминогруппы, начиная с С3H7NH2 - изомерия аминогруппы, связанная с изменением степени замещенности атомов водорода при азоте Пространственная изомерия Возможна оптическая изомерия, начиная с С4H9NH2 Изомерия аминокислот 1. Изомерия углеродного скелета, например: CH3 CH3 CH2 CH COOH CH3 C COOH NH2 NH2 2-аминобутановая кислота 2-амино-2-метилпропановая кислота 2. Изомерия положения функциональных групп: CH3 CH2 CH COOH CH3 CH CH2 COOH NH2 NH2 2-аминобутановая кислота 3-аминобутановая кислота 3. Оптическая изомерия Все -аминокислоты, кроме глицина H2N-CH2-COOH, содержат асимметрический атом углерода (-атом) и могут существовать в виде зеркальных антиподов. таблица 1 - Функциональные группы и их обозначения
Таблица 2 – основы номенклатуры органических соединений
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
