коллоквиум по химии. Вопрос 2 Изомерия органических соединений
 Скачать 241.39 Kb. Скачать 241.39 Kb.
|
Вопрос №2 Изомерия органических соединенийИзомерия – существование разных веществ с одинаковой молекулярной формулой. Данное явление обусловлено тем, что одни и те же атомы могут по-разному соединяться друг с другом. Все изомеры делят на два больших класса – структурные изомеры и пространственные изомеры (стереоизомеры). Структурными называют изомеры, отвечающие различным структурным формулам органических соединений (с разным порядком соединения атомов). Стереоизомерами называют соединения, имеющие одинаковый состав и одинаковый порядок соединения атомов, но отличающиеся расположением атомов в пространстве. 1) соединения, содержащие различные функциональные группы и относящиеся к различным классам органических соединений, например: 2) соединения, отличающиеся углеродными скелетами:  3) соединения, отличающиеся положением заместителя или кратной связи в молекуле:  Пространственные изомеры (стереоизомеры).Стереоизомеры можно разделить на два типа: геометрические изомеры и оптические изомеры. Геометрическая изомерия характерна для соединений, содержащих двойную связь или цикл. В таких молекулах часто возможно провести условную плоскость таким образом, что заместители у различных атомов углерода могут оказаться по одну сторону (цис-) или по разные стороны (транс-) от этой плоскости. Если изменение ориентации этих заместителей относительно плоскости возможно только за счет разрыва одной из химических связей, то говорят о наличии геометрических изомеров.  Геометрические изомеры могут существенно отличаться своими физическими и химическими свойствами. Оптическими изомерами называют молекулы, зеркальные изображения которых не совместимы друг с другом. Их можно разделить на два типа: энантиомеры и диастереомеры. Стереоизомеры, имеющие зеркальную конфигурацию асимметрических (хиральных) центров, называютэнантиомерами илиоптическими антиподами. Энантиомерия характерна для молекул, имеющих один асимметрический (хиральный) атом углерода, т.е. атом, связанный с четырьмя различными атомами или группами атомов. Молекулы энантиомеров относятся друг к другу как предмет и несовместимое с ним зеркальное отображение. Энантиомеры имеют одинаковые физические и химические свойства, но отличаются знаком вращения поляризованного света. В виде энантиомеров существует, например, молочная кислота СН3-СН(ОН)-СООН:  Вопрос 3 Асимметрический атом углерода как центр хиральности. Стереоизомерия молекул с одним центром хиральности (энантиомерия). Оптическая активность. Энантиомеры- стереоизомеры, относящиеся друг к другу, как предмет и несовместимое с ним зеркальное отображение. В виде энантиомеров могут существовать только хиральныемолекулы. Хиральность - это свойство объекта быть несовместимым со своим зеркальным отражением. Хиральными (от греч. cheir - рука), или асимметричными, объектами являются левая и правая рука, а также перчатки, ботинки и др. Эти парные предметы представляют собой объект и его зеркальное отражение (рис. 8, а). Такие предметы не могут быть полностью совмещены друг с другом. В то же время существует множество окружающих нас предметов, которые совместимы со своим зеркальным отражением, т. е. они являются ахиральными(симметричными), например тарелки, ложки, стаканы и т. д. Ахиральные предметы обладают, по крайней мере одной плоскостью симметрии, которая делит объект на две зеркально-идентичные части (см. рис. 8, б). Подобные взаимоотношения наблюдаются также в мире молекул, т. е. молекулы делятся на хиральные и ахиральные. У ахиральных молекул есть плоскости симметрии, у хиральных их нет. В хиральных молекулах имеется один или несколько центров хиральности. В органических соединениях в качестве центра хиральности чаще всего выступает асимметрический атом углерода. Асимметрическим является атом углерода, связанный с четырьмя различными атомами или группами. При изображении стереохимической формулы молекулы символ «С» асимметрического атома углерода обычно опускается.  Чтобы определить, является молекула хиральной или ахиральной, нет необходимости изображать ее стереохимической формулой, достаточно внимательно рассмотреть все атомы углерода в ней. Если находится хотя бы один атом углерода с четырьмя разными заместителями, то этот атом углерода асимметричен и молекула за редкими исключениями хиральна. Так, из двух спиртов - пропанола-2 и бутанола-2 - первый ахирален (две группы СН3 у атома С-2), а второй - хирален, так как в его молекуле у атома С-2 все четыре заместителя разные (Н, ОН, СН3 и С2Н5). Асимметрический атом углерода иногда помечают звездочкой (С*).
 Следовательно, молекула бутанола-2 способна существовать в виде пары энантиомеров, которые не совмещаются в пространстве (рис. 9).  Рис. 9.Энантиомеры хиральных молекул бутанола-2 не совмещаются Свойства энантиомеров.Энантиомеры обладают одинаковыми химическими и физическими свойствами (температуры плавления и кипения, плотность, растворимость и т. д.), но проявляют различную оптическую активность,т. е. способность отклонять плоскость поляризованного света. При прохождении такого света через раствор одного из энантиомеров происходит отклонение плоскости поляризации влево, другого - вправо на один тот же по величине угол α. Значение угла α, приведенное к стандартным условиям, является константой оптически активного вещества и называется удельным вращением[α]. Левое вращение обозначается знаком «минус» (-), правое - знаком «плюс» (+), а энантиомеры называют соответственно лево- и правовращающими. Вопрос№ 4 Проекционные формулы Фишера. Относительная D- и L – система стереохимической номенклатуры. Абсолютная конфигурация стереоизомеров.Проекционные формулы Фишера.Рассмотрим их построение на примере молочной (2-гидроксипропановой) кислоты. Тетраэдрическую модель одного из энантиомеров (рис. 10) располагают в пространстве так, чтобы цепь атомов углерода оказалась в вертикальном положении, а карбоксильная группа - сверху. Связи с неуглеродными заместителями (Н и ОН) у хирального центра должны быть направлены к наблюдателю. 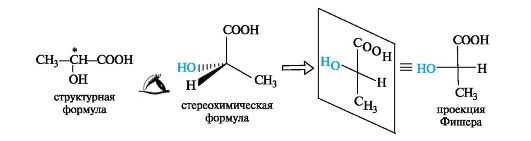 Рис. 10.Построение проекционной формулы Фишера (+)-молочной кислоты После этого модель проецируют на плоскость. Символ асимметрического атома при этом опускается, под ним понимают точку пересечения вертикальной и горизонтальной линий. Тетраэдрическую модель хиральной молекулы перед проецированием можно располагать в пространстве по-разному, не только так, как показано на рис. 7. Необходимо только, чтобы связи, образующие на проекции горизонтальную линию, были направлены к наблюдателю, а вертикальные связи - за плоскость рисунка. Полученные таким образом проекции можно с помощью несложных преобразований привести к стандартному виду, в котором углеродная цепь расположена вертикально, а старшая группа (в молочной кислоте это СООН) - сверху. Преобразования разрешают две операции: • в проекционной формуле разрешается менять местами два любых заместителя у одного и того же хирального центра четное число раз (двух перестановок бывает достаточно); • проекционную формулу разрешается поворачивать в плоскости рисунка на 180° (что эквивалентно двум перестановкам), но не на 90°. Тетраэдрическую модель строения органических соединений предложили Я.Г.Вант-Гофф и Ж.А.Ле-Бель в 1874 г. Они пришли к выводу, что если две молекулы являются стереоизомерами, то их можно описать зеркальными формулами, и если один изомер вращает плоскость поляризации влево, то второй должен вращать вправо. По знаку вращения можно определить относительную конфигурацию стереоизомеров. Однако между абсолютной конфигурацией, т.е. истинным расположением групп вокруг данного хирального центра, и знаком вращения прямого соответствия нет. Определить абсолютную конфигурацию химическими методами, если не известна абсолютная конфигурация хотя бы одного хирального реагента (а так и было вначале), невозможно. Спектральные методы могут дать информацию только об относительной конфигурации. В настоящее время существуют лишь два метода независимого определения абсолютной конфигурации: теоретический расчет и исследование аномальной дифракции рентгеновских лучей на ядрах тяжелых элементов. Но в конце XIX - начале XX века этих методов не существовало и поэтому химики придумали следующий выход. Решили взять в качестве стандарта какое-нибудь одно соединение и произвольно приписать ему одну из возможных абсолютных конфигураций. Выбор пал на глицериновый альдегид по той причине, что он структурно связан с сахарами, которые в то время изучал Эмиль Фишер. (+) - Изомеру была приписана абсолютная конфигурация и он был обозначен буквой D (dextriogyrus - правый), а соответствующий (-) - изомер - буквой L (laevogyrus - левый). Как только был выбран стандарт, стало возможным соотносить с ним конфигурацию других соединений. Например, при окислении с помощью HgO (+)-глицериновый альдегид дает (-)-глицериновую кислоту. Данная реакция не затрагивает асимметричский атом, поэтому очень мало вероятно, чтобы его конфигурация изменилась, и следовательно (-)-глицериновая кислота относится к D - ряду.  Отнесение к D- или L-ряду других родственных по структуре оптически активных соединений производится путем сравнения конфигурации их асимметрического атома с конфигурацией D- или L-глицеринового альдегида. Например, у одного из энантиомеров молочной кислоты (I) в проекционной формуле группа ОН находится слева, как у L-глицеринового альдегида, поэтому энантиомер (I) относят к L-ряду. Из тех же соображений энантиомер (II) относят к D-ряду. Так из сравнения проекций Фишера определяют относительнуюконфигурацию.  Следует отметить, что L-глицериновый альдегид имеет левое вращение, а L-молочная кислота - правое (и это не единичный случай). Более того, одно и то же вещество может быть как лево-, так и правовращающим в зависимости от условий определения (разные растворители, температура). Вопрос №5 Сопряжение. Сопряженные системы с открытой (на примере бутадиена-1,3) и замкнутой цепью (на примере бензола), ароматичность, критерии ароматичности, правило Хюккеля Существуют два типа сопряжения: π,π– и р,π– сопряжение. В π,π– сопряженной системе в сопряжении участвует две или более π – связи. π,π– сопряженная система может включать гетероатом (О, N). Бутадиен – 1,3, пропеналь – это π,π – сопряженная системы. CH2=CH–CH=CH2 CH2=CH–CH=O бутадиен–1,3 пропеналь В р,π– сопряженной системе π – связь должна быть отделена одной одинарной от р-негибридной орбитали гетероатомом (О,N). г  Р-орбиталь гетероатома сопряжена с орбиталями π-связи. Представители р, π – сопряженных систем: в в  инилхлорид инилхлоридамид к  арбоксилат – ион арбоксилат – ионС радикал анион Сопряжение – энергетически выгодный процесс, поэтому делокализация электронной плотности сопровождается выделением энергии. Система переходит на более низкий энергетический уровень и становится более устойчивой. Энергия, которая выделяется за счет сопряжения, называется энергией сопряжения (ΔЕ). Чем длиннее цепь сопряжения, тем больше ΔЕ, тем устойчивее система. Вещества, содержащие большую цепь сопряжения, называются полиены. Они очень устойчивы. К полиенам, например, относится витамин А. Е Е ΔЕ Ес – энергия с.с. Е З К замкнутым сопряженным системам относится бензол, его производные, гетероциклические и конденсированные соединения. Рассмотрим бензол, С6Н6.
Каждая р-орбиталь в равной степени перекрывается с р-орбиталями соседних атомов. Наблюдается сопряжение, возникает единое замкнутое π – электронное облако, которое охватывает все шесть атомов С. Такая замкнутая с. система называется ароматической. Вследствие выравнивания электронной плотности происходит выравнивание длин связей, в бензоле все связи С–С имеют длину 0,140 нм. Энергия сопряжения замкнутых сопряженных систем намного больше, чем энергия сопряжения открытых сопряженных систем с тем же числом π-связей, поэтому бензол очень устойчивая система. ΔЕбутадиена = 15 кДж/моль ΔЕс6н6 = 228 кДж/моль Критерии ароматичности. Система будет ароматической, если она обладает следующими признаками: Молекула имеет циклическое строение. Все атомы углерода находятся в sp2 –гибридизированном состоянии, из этого следует, что молекула имеет плоское строение. Единое замкнутое π-электронное облако содержит (4n+2) π-электронов (правило Хюккеля), где n=1,2,3,4,…… Например: n=    1 Число π-электронов = 6, к таким ароматическим соединениям относятся: 1 Число π-электронов = 6, к таким ароматическим соединениям относятся:б  ензол пиридин пиррол фенол ензол пиридин пиррол фенолn  =2 число π-электронов =10 =2 число π-электронов =10н  афталин n=3 число π-электронов = 14 афталин n=3 число π-электронов = 14В 1931 году Хюккель на основании квантовой теории определил в качестве критерия ароматичности количество π-электронов в плоской циклической сопряженной системе. Согласно правилу Хюккеля, ароматическими являются те соединения, в молекулах которых число π-электронов соответствует формуле 4n+2. Например, для бензола n = 1 (6 π-электронов), для нафталина 2 (10 π-электронов), для фенантрена и антрацена – 3 (14 π-электронов). Структуры, содержащие в цикле хотя бы один sp3-гибридный атом, ароматическими не являются, т.к. циклическое сопряжение отсутствует (исключением являются так называемые гомоароматические катионы, в которых два атома соединены формально только π-связью, а σ-связь между ними заменяется мостиком. Если сопряженная циклическая система содержит количество π-электронов, подчиняющееся формуле 4n, ее называют антиароматической. Отличительной особенностью антиароматических соединений является их относительная неустойчивость.
Вопрос №7 Ароматичность гетероциклических соединений: пиридина, пиррола, пиримидина, имидазола, пурина. Циклические сопряженные системы представляют большой интерес как группа соединений с повышенной термодинамической устойчивостью по сравнению с сопряженными открытыми системами. Эти соединения обладают и другими особыми свойствами, совокупность которых объединяют общим понятием ароматичность. К ним относятся способность таких формально ненасыщенных соединений вступать в реакции замещения, а не присоединения, устойчивость к действию окислителей и температуры. Типичными представителями ароматических систем являются арены и их производные. Особенности электронного строения ароматических углеводородов наглядно проявляются в атомно-орбитальной модели молекулы бензола. Каркас бензола образуют шесть sp2-гибридизованных атомов углерода. Все σ-связи (C-C и C-H) лежат в одной плоскости. Шесть негибридизованных р-АО расположены перпендикулярно плоскости молекулы и параллельно друг другу (рис. 3, а). Каждая р-АО в равной степени может перекрываться с двумя соседними р-АО. В результате такого перекрывания возникает единая делокализованная π-система, наибольшая электронная плотность в которой находится над и под плоскостью σ-скелета и охватывает все атомы углерода цикла (см. рис. 3, б). π-Электронная плотность равномерно распределена по всей циклической системе, что обозначается кружком или пунктиром внутри цикла (см. рис. 3, в). Все связи между атомами углерода в бензольном кольце имеют одинаковую длину (0,139 нм), промежуточную между длинами одинарной и двойной связей. На основании квантовомеханических расчетов установлено, что для образования таких стабильных молекул плоская циклическая система должна содержать (4n + 2) π-электронов, где n = 1, 2, 3 и т. д. (правило Хюккеля, 1931). С учетом этих данных можно конкретизировать понятие «ароматичность». Ароматические системы (молекулы) – системы, отвечающие критериям ароматичности: наличие плоского σ-скелета, состоящего из sp2-гибридизованных атомов; делокализация электронов, приводящая к образованию единого π-электрон-ного облака, охватывающего все атомы цикла (циклов); соответствие правилу Э. Хюккеля, т.е. электронное облако должно насчитывать 4n+2 π-электронов, где n=1,2,3,4… (обычно цифра указывает на количество циклов в молекуле); высокая степень термодинамической устойчивости (высокая энергия сопряжения).
 Рис. 3. Атомно-орбитальная модель молекулы бензола (атомы водорода опущены; объяснение в тексте)  Устойчивость сопряженных систем. Образование сопряженной и особенно ароматической системы - энергетически выгодный процесс, так как при этом увеличивается степень перекрывания орбиталей и происходит делокализация (рассредоточение) р-электронов. В связи с этим сопряженные и ароматические системы обладают повышенной термодинамической устойчивостью. Они содержат меньший запас внутренней энергии и в основном состоянии занимают более низкий энергетический уровень по сравнению с несопряженными системами. По разнице этих уровней можно количественно оценить термодинамическую устойчивость сопряженного соединения, т. е. его энергию сопряжения(энергию делокализации). Для бутадиена-1,3 она невелика и составляет около 15 кДж/моль. С увеличением длины сопряженной цепи энергия сопряжения и соответственно термодинамическая устойчивость соединений возрастают. Энергия сопряжения для бензола гораздо больше и составляет 150 кДж/моль. Примеры небензоидных ароматических соединений:  Пиридин по электронному строению напоминает бензол. Все атомы углерода и атом азота находятся в состоянии sp2-гибридизации, и все σ-связи (C-C, C-N и C-H) лежат в одной плоскости (рис. 4, а). Из трех гибридных орбиталей атома азота две участвуют в образовании
 Рис. 4. Пиридиновый атом азота (а), распределение электронов по орбиталям (б) и сопряженная система в молекуле пиридина (в) (связи С-Н для упрощения рисунка опущены) σ-связей с атомами углерода (показаны только оси этих орбиталей), а третья орбиталь содержит неподеленную пару электронов и в образовании связи не участвует. Атом азота с такой электронной конфигурацией называют пиридиновым. За счет электрона, находящегося на негибридизованной р-орбитали (см. рис. 4, б), атом азота участвует в образовании единого электронного облака ср-электронами пяти атомов углерода (см. рис. 4, в). Таким образом, пиридин является π,π-сопряженной системой и удовлетворяет критериям ароматичности. В результате большей электроотрицательности по сравнению с атомом углерода пиридиновый атом азота понижает электронную плотность на атомах углерода ароматического кольца, поэтому системы с пиридиновым атомом азота называют π-недостаточными. Кроме пиридина, примером таких систем служит пиримидин, содержащий два пиридиновых атома азота. Пиррол также относится к ароматическим соединениям. Атомы углерода и азота в нем, как и в пиридине, находятся в состоянии sp2-гибридизации. Однако в отличие от пиридина атом азота в пирроле имеет иную электронную конфигурацию (рис. 5, а, б).  Рис. 5. Пиррольный атом азота (а), распределение электронов по орбиталям (б) и сопряженная система в молекуле пиррола (в) (связи С-Н для упрощения рисунка опущены) На негибридизованной р-орбитали атома азота находится неподеленная пара электронов. Она участвует в сопряжении с р-электрона- ми четырех атомов углерода с образованием единого шестиэлектронного облака (см. рис. 5, в). Три sp2-гибридные орбитали образуют три σ-связи - две с атомами углерода, одну с атомом водорода. Атом азота в таком электронном состоянии получил название пиррольного.
Шестиэлектронное облако в пирроле благодаря р,п-сопряжению делокализовано на пяти атомах цикла, поэтому пиррол представляет собой π-избыточную систему. В фуране и тиофене ароматический секстет также включает неподеленную пару электронов негибридизованной p-АО кислорода или серы соответственно. В имидазоле и пиразоле два атома азота вносят разный вклад в образование делокализованного электронного облака: пиррольный атом азота поставляет пару π-электронов, а пиридиновый - один p-электрон. 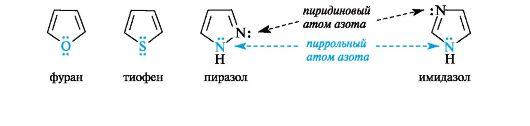 Ароматичностью обладает также пурин, представляющий собой конденсированную систему двух гетероциклов - пиримидина и имидазола.  Делокализованное электронное облако в пурине включает 8 π-электронов двойных связей и неподеленную пару электронов атома N=9. Общее число электронов в сопряжении, равное десяти, соответствует формуле Хюккеля (4n + 2, где п = 2). Гетероциклические ароматические соединения обладают высокой термодинамической устойчивостью. Неудивительно, что именно они служат структурными единицами важнейших биополимеров - нуклеиновых кислот. |

 σ σ
σ σ