Методичка по ЗНотЧС. Памятка для студентов по подготовке к лабораторной работе, её выполнению и оформлению
 Скачать 5.43 Mb. Скачать 5.43 Mb.
|
|
ПАМЯТКА для студентов по подготовке к лабораторной работе, её выполнению и оформлению Запрещается в лаборатории находиться в верхней одежде, пользоваться сотовым телефоном, курить в здании. Обязательно ознакомьтесь с правилами безопасности и распишитесь в специальном лабораторном журнале. Выполняйте лабораторную работу под руководством и наблюдением преподавателя или учебно-вспомогательного персонала. Студент допускается к выполнению работы с приборами лишь после ознакомления с методическими указаниями по выполнению лабораторной работы и особенностями работы с прибором. Перед каждым включением прибора необходимо убедиться в его исправности и в том, что пуск прибора безопасен. Выполняйте только ту лабораторную работу, к которой допускает преподаватель. Аккуратно обращайтесь с исследуемыми пробами, не вскрывайте их упаковку. Следите за порядком на лабораторном столе. После окончания работы выключите прибор, приведите в порядок рабочее место, исследованные пробы аккуратно поставьте рядом с прибором, стул придвиньте к столу. Доложите преподавателю об окончании работы с прибором и замеченных неисправностях. Оформление работы и все расчёты лучше производить на рабочем месте вдали от радиоактивных проб и прибора. В конце занятия учащийся должен сдать педагогу выполненную работу, о чём последний делает отметку в своём журнале и подписывает работу. Лабораторная работа № 1 ИОНИЗИРУЮЩИЕ ИЗЛУЧЕНИЯ И ДОЗЫ ИХ ИЗМЕРЕНИЯ 1. Цель работы — ознакомиться с основными понятиями радиационной безопасности: явление радиоактивности, физические единицы измерения радиоактивных излучений, дозы и мощность дозы облучения, виды излучения и их природа, дозовые нагрузками на человека. 2. Порядок выполнения работы: 2.1. Изучить настоящие методические материалы. 2.2. Законспектировать в рабочую тетрадь ответы на вопросы к зачёту. 3. ОСНОВНЫЕ ПОНЯТИЯ РАДИАЦИОННОЙ БЕЗОПАСНОСТИ
В 1898 г. этим явлением заинтересовались ученица Беккереля Мария Складовская-Кюри и ее муж Пьер Кюри. Они обнаружили, что торий также испускает лучи Беккереля, и переименовала их в радиоактивность. После тщательных исследований они открыли
В 1911 г. английский ученый Эрнест Резерфорд, исследуя рассеяние α-частиц тонкой металлической фольгой, предположил, что внутри атома имеется ядро шарообразной формы размером около 10-12 см. Позже (1919 г.), исследуя реакцию 714N+24He®817O+11H (протон) он высказал гипотеза о существовании нейтрона 01n. Используя эту модель, великий датский физик-теоретик Нильс Бор в 1913 г. разработал первую теорию строения атома: атом имеет положительно заряженное ядро и окружающие его электроны (рис.
В 1932 г. английский физик Дж. Чедвик открыл нейтрон в реакции 49Be+24He® 126C+ 01n. В этом же году немецкий ученый В. Гейзенберг и независимо от него отечественный физик Д.Д. Иваненко предложили протонно-нейтронную модель строения атомного ядра. Согласно этой модели ядра атомов включают в себя два вида элементарных частиц протоны (р) и нейтроны (n). Связанное состояние в n-р –системе называется дейтроном. Сколько в ядре протонов, столько и электронов вращается вокруг ядра (рис. 1.1). Количеству протонов в ядре соответствует номеру элемента в таблице Д.И. Менделеева. Ядро любого элемента называется нуклид 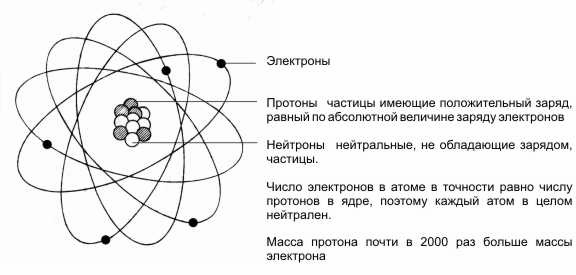 ом. Нуклид обозначается символом химического элемента с указанием атомного номера и массового числа в качестве нижнего и Рис. 1.1. Схематическое изображение атома. верхнего индекса соответственно (например, 24Не). В дальнейшем в ряде случаев для краткости изложения будет указываться только массовое число химического элемента. Ядра с одним и тем же зарядом, но с разными массовыми числами (одинаковым количеством протонов и разным – нейтронов) называют изотопами. Изотопы имеют одинаковое строение электронных оболочек и, следовательно, близкие химические свойства. Они занимают одно и то же место в периодической системе химических элементов. Например, у первого элемента таблицы Менделеева - водорода существуют следующие изотопы:
У цезия имеются 20, у йода – 19, у стронция – 12, у плутония – 7 изотопов и т.д. В таблице Менделеева (см. приложение) более 100 химических элементов. Почти каждый из них представлен смесью стабильных и радиоактивных атомов - изотопами данного элемента. Известно почти 2000 изотопов, из которых почти 300 – природные, т. е. естественные (столько же и стабильных изотопов), остальные – получены искусственным путём. Продукты ядерного взрыва содержат более 100 нестабильных изотопов. Большое количество радиоактивных изотопов содержится в продуктах деления ядерного горючего в ядерных реакторах АЭС и др. Но среди них количество изотопов, имеющих практическое значение и играющих заметную роль в природе невелико - не более десятка. Радиоактивность - свойство некоторых нестабильных атомов к самопроизвольным превращениям (распаду) и к изменению своего нуклонного состава (количество протонов и нейтронов в ядре) и (или) энергетического состояния с образованием новых атомов (стабильные или радиоактивные) и испусканием ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ с большей или меньшей ПРОНИКАЮЩЕЙ СПОСОБНОСТЬЮ. Эти излучения и называются в обиходе радиацией («Radiation» в переводе с английского - "излучение"). Термин «радиоактивность» предложен Марией Склодовской Кюри в 1898 г. Позже был предложен знак: «Радиоактивность» для предупреждения работающих об опасности облучения.
Число ядер радионуклидов постоянно уменьшается во времени благодаря распаду. Скорость распада этих ядер принято характеризовать периодом полураспада (Т½) - временем, за которое число радиоактивных ядер уменьшается в 2 раза. У каждого радионуклида свой период полураспада, он может составлять как доли секунды, так и миллиарды лет. Период полураспада любого радионуклида постоянен, и изменить его невозможно. Чем больше период полураспада и массовое число радиоактивного элемента, тем большее его количество соответствует одному кюри (1 Ки). Например, 1 Ки соответствует: 1 мг 60Со (Т½ = 5 лет), 1 г 226Rа (Т½ = 1590 лет), 16 г 239Рu (Т½ = 2400 лет), 570 кг 235U (Т½ = 880 млн. лет). 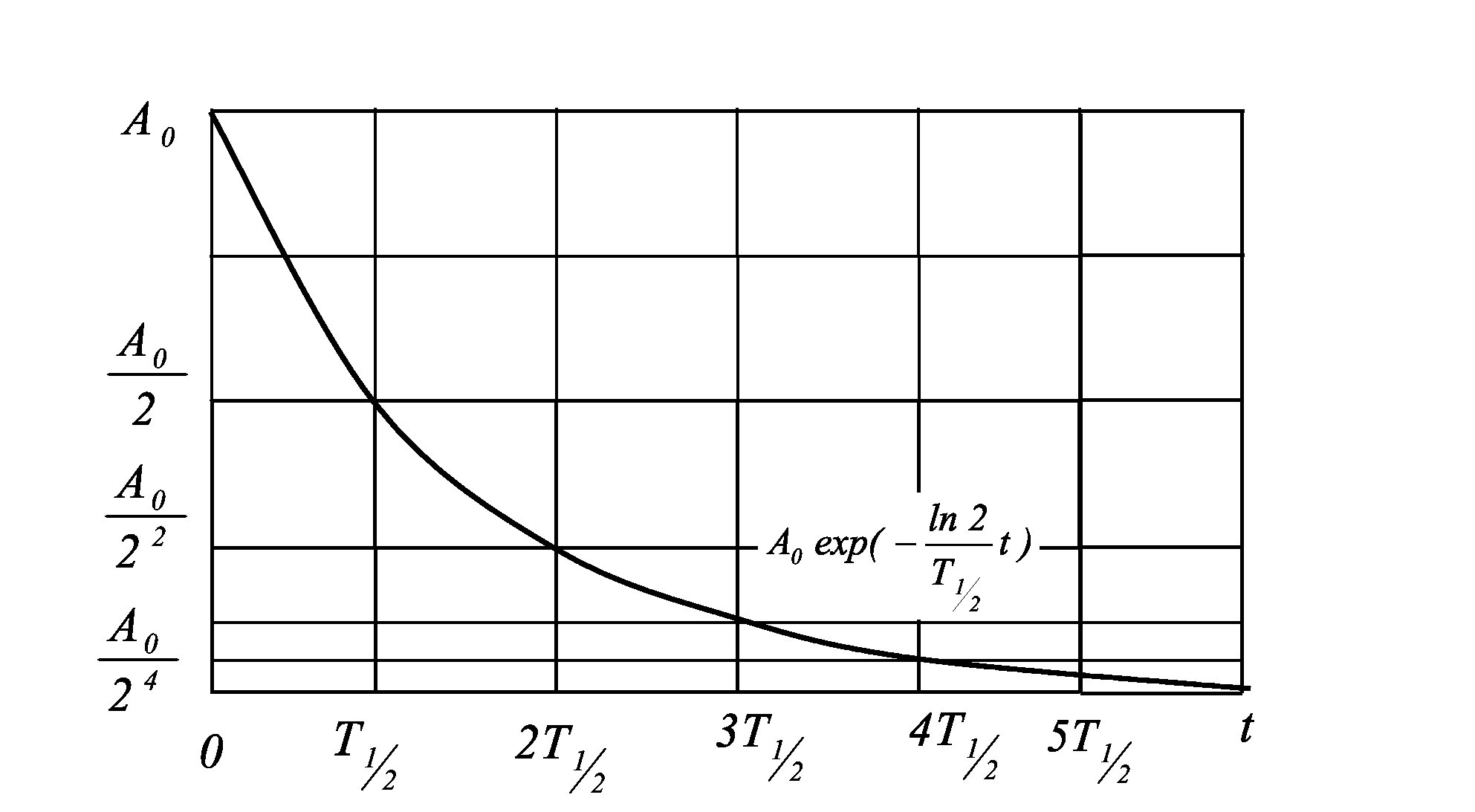 Рис. 1.2. Распад радионуклидов. Убывание количества распадающихся ядер радионуклида происходит по экспоненте (рис. 1.2). Поэтому полностью радионуклид не исчезнет никогда. Так, например, для радионуклида с периодом полураспада 1 час количество его станет меньше первоначального в 2 раза через 1 ч, через 2 ч - в 4, через 3 ч - в 8 раз и т.д. Динамика распада описывается законом радиоактивного распада, устанавливающим, что за единицу времени распадается всегда одна и та же доля ядер данного радионуклида. Эта доля атомов, распадающихся в 1 секунду, называется радиоактивной постоянной распада (постоянная или константа распада) и обозначается λ. Величины λ и T1/2 связаны между собой обратно пропорциональной зависимостью: λ = ln 2 / T1/2. Учитывая, что ln 2 = 0,693, данная формула может приобрести следующий вид: λ = 0,693 / Т1/2 (сек-1). Из закона радиоактивного распада следует, что Nt = N0•e-λt, где N0 - число радиоактивных атомов в начальный (нулевой) момент времени, Nt число атомов, оставшихся к моменту t (время в секундах), e – основание натурального логарифма (е - 2,718). Так как за время, равное одному периоду полураспада, число радиоактивных атомов уменьшается в два раза, то при t = T1/2 имеем: Nt = N0/2: e-λt = 1/2; e-λt = 2 (где t = T1/2) и, в итоге, ln 2 = λ•Т1/2. Из указанного закона следует, что количество ядер, распадающихся за промежуток времени dt, прямо пропорционально количеству нераспавшихся ядер: dN/dt = λN. При этом N = N0 e-λt, или
где N0 – количество ядер радионуклида в момент начала отсчёта времени (t = 0); λ – постоянная распада; N – количество ядер радионуклида спустя время t; e – основание натурального логарифма = 2,718. Следует различать радиоактивность и радиацию. Радиоактивность – способность некоторых нестабильных атомов к самопроизвольному распаду или изменению своего нуклонного состава с испускание ионизирующих излучений. Источники ионизирующих излучений - радиоактивные вещества или ядерно-технические установки (реакторы, ускорители, рентгеновское оборудование и т.п.). Они могут существовать долгое время, а радиация существует лишь до момента своего поглощения в каком-либо веществе. Радиацию нельзя вызвать с помощью химических реакций. 3.2. Ионизирующее излучение – любое излучение, взаимодействие которого со средой приводит к образованию электрических зарядов разных знаков. Это частицы или γ-кванты, энергия которых достаточно велика, чтобы при воздействии на вещество создавать ионы разных знаков. Энергии ионизирующей радиации вполне хватает, чтобы выбить хотя бы один электрон из встречного атома По- Р 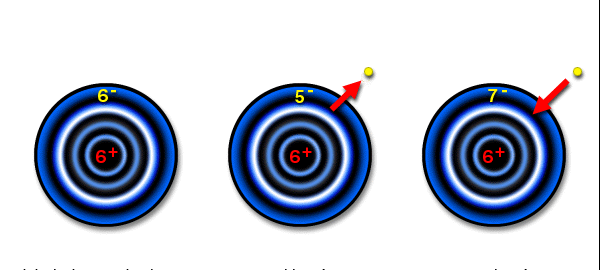 ис. 1.3. Образование ионов, заряжённых положительно и отрицательно. добные атомы без электрона называются ионами (рис. 1.3).
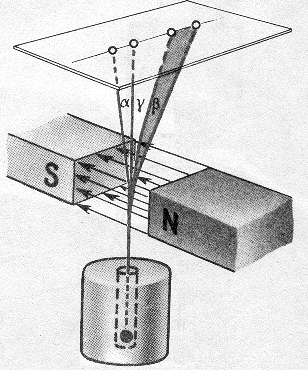
На рис. 1.4 представлен классический опыт, позволивший обнаружить сложный состав радиоактивного излучения. Препарат радия помещали на дно узкого канала в куске свинца. Против канала находилась фотопластинка. На выходившее из канала излучение действовало сильное магнитное поле, линии индукции которого перпендикулярны лучу ионизирующего излучения. Вся установка размещалась в вакууме. Под действием магнитного поля пучок распадался на три потока. Две составляющие потока отклонялись в противоположные стороны. Это указывало на наличие у излучений электрических зарядов противоположных знаков. При этом отрицательный компонент излучения отклонялся магнитным полем гораздо сильнее, чем положительный. Э. Резерфорд, обнаруживший в 1899 г. эти две составляющие излучения, назвал менее проникающую α-излучением и более проникающую - β-излучением. Третья составляющая урановой радиации, не отклонявшаяся магнитным полем и самая проникающая из всех, была открыта через год (1900 г.) Полем Виллардом и названа по аналогии с резерфордовским рядом (α и β) третьей буквой греческого алфавита - γ-излучением. Следовательно, положительно заряженный компонент получил название α-лучей, отрицательно заряженный – β-лучей и нейтральный – γ-лучей. Каждому виду излучения присущи свои ионизирующая и проникающая способности. Именно эти свойства лежат в основе повреждающего действия ионизирующих излучений на живые клетки человека или животного, что приводит к развитию заболевания, различной степени тяжести, а в некоторых случаях и к смерти. Рассмотрим эти две способности для различных излучений. Альфа-излучение (α-излучение) представляет собой поток α-частиц, испускаемых при радиоактивном распаде элементов тяжелее свинца, элементов с № > 83 (например, урана, тория, радия, плутония, табл. 1.1), или образующихся в ходе ядерных реакций. α-частица фактически являются ядрами гелия (24Не), состоящими из двух протонов и двух нейтронов (статический электрический заряд равен +2, массовое число - 4). q = 2е. Скорость α-частицы при вылете из ядра - от 12 до 20 тыс. км/сек. В вакууме α-частица могла бы обогнуть земной шар по экватору за 2 с. Ионизирующая способность α-излучения в воздухе характеризуется образованием в сред- Таблица 1.1. Альфа-излучатели
нем 30 тыс. пар ионов на 1 см пробега. Это очень много. Ионизирующая способность представляет главную опасность данного излучения. Проникающая способность, наоборот, невелика. Например, у α-частицы с энергией 4 МэВ длина пробега в воздухе примерно 2,5 см, в воде или в мягких тканях животных и человека — сотые доли миллиметра. α-частицы задерживает обычный лист бумаги (0, 1 мм), магнитным полем они отклоняются слабо. Бета-излучение (β-излучение) представляет собой поток электронов или позитронов с массой, равной 1/1837 массы протона, образующихся при β-распаде различных элементов от самых легких (нейтрон) до самых тяжелых (радий-228) - см. табл. 1.2. β-распад – это процесс превращения в ядре атома протона в нейтрон или нейтрона в протон с выбросом β-частиц (позитрона или электрона). β-распад объединяет три самостоятельных вида радиоактивных превращений: электронный, позитронный распад и К-захват. Отрицательно заряженные β-частицы – электроны или положительно заряженные – позитроны движутся со скоростью, близкой к скорости света (0, 999 скорости света, v = 108м/с). Ионизирующая Таблица 1.2. |

 . Беккерель
. Беккерель




 нак: «Радиоактивность»
нак: «Радиоактивность»