Эссе. Планконспект урока по химии тема урока Аммиак 9 класс
 Скачать 0.77 Mb. Скачать 0.77 Mb.
|
|
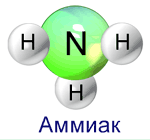
ПЛАН-КОНСПЕКТ УРОКА ПО ХИМИИ Тема урока: «Аммиак» 9 класс Цель урока: изучение строения молекулы аммиака, его физических и химических свойств, роли аммиака в жизни человека и его применение Задачи урока: обучающие: изучить состав и строение молекулы аммиака, его физические и химические свойства, способы получения в лаборатории и промышленности, применение; познакомить с водородной связью и донорно-акцепторным механизмом образования ковалентной связи. развивающие: развитие логического и аналитического мышления, развитие критического мышления, самостоятельности и способности к рефлексии, обеспечение системности учения, а так же развитие терминологического мышления; умения ставить и разрешать проблемы, анализировать, сравнивать, обобщать и систематизировать, бережного отношения к здоровью человека воспитательные: воспитание положительной мотивации учения, правильной самооценки, чувства ответственности, уверенности и требовательности к себе, продолжить воспитание толерантности при работе в группе. Тип урока: Изучение нового материала с элементами повторения и закрепления ранее изученного. Методы работы: Диалогические, экспериментально – исследовательские. План урока: Организационный момент (2 мин) Опрос-повторение (5 мин.) Мотивационно-ориентировочный этап (5 мин.) Операционно – исполнительский этап.(23 мин.) по плану (записывается на доске по мере объяснения). Проверка усвоения знаний (7 мин.). Подведение итогов урока. Рефлексия. Домашнее задание.(3 мин.) Оборудование: Таблица растворимости веществ. Периодическая система Д.И.Менделеева. Раствор аммиака. Соляная кислота. Индикатор фенолфталеин. Серная кислота. Лабораторная посуда. Этапы урока.I. Организационный момент (2 мин.)Учитель проверяет готовность учащихся к уроку, организует начало урока. Отмечает отсутствующих. Объявление темы урока, задач, беседа с целью выявления знаний учащихся об аммиаке (Что они уже знают об аммиаке) (слайд 1-2) II.Опрос-повторение (5 мин.) Проведение проверки знаний: 3 ученика идут к доске; 5 учеников получают письменные задания на месте по карточкам. Остальные учащиеся отвечают на вопросы устно, со своих рабочих мест. Вопросы - и задания для фронтальной проверки. 1. Характеристика азота по положению в Периодической системе элементов Д. И. Менделеева 2. Модель атома азота 3. Простое вещество азот 4. Почему молекулярный азот химически инертен, а атомарный – химически активен? 5. Азот в природе.6. Какова схема круговорота азота в природе?7. Расскажите о двойственном названии элемента №7.8. Кто и в каком году открыл азот?III. Мотивационно - ориентировочный этап (5 мин.)Создание проблемной ситуацииВводное слово учителяЭта история произошла во время I мировой войны. Английский крейсер вел преследование поврежденного в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось плотное белое облако дыма. Экипаж крейсера почувствовал удушливый запах, раздражающий горло и легкие. Крейсер был вынужден дать задний ход и выйти из дымового облака. Уже после обнаружили, что пострадали не только люди, но и металлические части корабля. Сегодня я хочу познакомить вас с этим удивительным веществом, имеющим необыкновенные свойства. Запах этого газа знаком каждому - даже тем, кто совсем далёк от химии. Кое – что о его свойствах тоже всем известно.Итак, вещество, о котором пойдёт речь на нашем уроке – аммиак.Давайте попробуем частично воспроизвести картину давних лет.Это вещество имеет древнюю историю. Арабские алхимики получали из оазиса Амон, находившегося около храма, бесцветные кристаллы. Они звали вещество «нушадир», его растирали в ступках, нагревали – и всякий раз получался едкий газ. Сначала его именовали аммониак, а потом сократили название до «аммиак». В средние века этот газ называли почему-то «щелочной воздух», а его раствор и поныне называется «нашатырный спирт». Давайте, ребята, проведем небольшое исследование и решим, откуда у этого газа столь необычные свойства и названия. IV. Операционно – исполнительский этап(23 мин.) Формула аммиака – NH3, т.е. это водородное соединение азота. Объяснение: Атом азота образует с атомами водорода 3 ковалентные полярные связи (т.к. электроотрицательность азота больше, чем у водорода) за счет своих трех неспареных электронов; Неподеленная электронная пара атома азота способна участвовать в образовании четвертой ковалентной связи по донорно-акцепторному механизму с атомами, имеющими вакантную орбиталь; Механизм донорно-акцепторной связи:H  3N: + H+ = [NH4]+ образуется ион аммония 3N: + H+ = [NH4]+ образуется ион аммония Для молекул аммиака характерно связывание их между собой в ассоциации за счет водородных связей |
| № | Этап урока | Деятельность учителя | Деятельность ученика | Время (в мин.) |
| 1 | 2 | 3 | 4 | 5 |
| 1 | Организационный этап | Объявление темы урока, задач, беседа с целью выявления знаний учащихся об аммиаке (Что они уже знают об аммиаке) | Отвечают на вопросы учителя Запись в тетради темы урока | 2 мин |
| 2 | Опрос-повторение | Учитель задает вопросы. | Учащиеся отвечают. | 5 мин |
| 3 | Мотивационно - ориентировочный этап | Создание проблемной ситуацииВводное слово учителя | Учащиеся слушают, пытаются объяснить явление. | 5 мин |
| 4 | Операционно – исполнительский этап. | | | 23 мин |
| 4-1.Состав и строение молекулы аммиака | Организует работу учащихся в группах | Записывают формулу аммиака, собирают шаро-стержневую модель, зарисовывают молекулу | 3 мин | |
| 4-2. Физические свойства аммиака | Организует групповую работу учащихся. | Изучают физические свойства аммиака и записывают в конспект | 5 мин | |
| 4-3. Водородная связь | Постановка проблемы. Почему аммиак очень хорошо растворяется в воде? | Выписывают из учебника определение водородной связи и примеры веществ | 5 мин | |
| 4-4. Химические свойства аммиака. | Учитель объясняет новый материал. | Учащиеся слушают и оформляют конспект. | 7 мин | |
| 4-5. Применение аммиака. | Учитель организовывает работу учащихся с учебником и презентацией. | Выписывают из учебника основные направления применения аммиака | 3 мин. | |
| 5 | Проверка усвоения знаний | Организует фронтальный опрос по подготовленным вопросам. | Учащиеся выполняют задания у доски и в тетради. | 7 мин |
| 6 | Подведение итогов урока. Рефлексия. Домашнее задание. | Организует фронтальную беседу по рефлексии итогов урока. Объясняет домашнее задание. | Записывают домашнее задание: §25,упр. 1-5. Получение аммиака выучить самостоятельно. | 3мин |
Литература:
О.С. Габриелян Химия 9 класс: Москва:. "Дрофа" - 2007г
Аликберова Л. Ю. Занимательная химия: Книга для учащихся, учителей и родителей. – М.: АСТ-ПРЕСС, 1999.
Алексинский В.Н. Занимательные опыты по химии: Книга для учителя. – М.: Просвещение, 1995.
Ахметов Н.С. Химия. 9 кл. – М.: Просвещение, 2002.
Иванова Р.Г. Химия. 8-9 кл. – М.: Просвещение, 2002-2003.
Книга для чтения по химии. Часть первая. Составили Парменов К.Я. и Сморгонский Л.М. – М.: Просвещение, 1955.
6Лисичкин Г.В., Бетанели В.И. Химики изобратают: Кн. для учащихся. М.: Просвещение, 1990.
В.В. Рюмин. Занимательная химия: Опыты и развлечения из области химии. – Ленинград: Издательство «Время», 1927.
Сорокин В.В., Злотников Э.Г. Проверь свои знания: Тесты по химии: Книга для учащихся. – М.: Просвещение: Учеб. лит., 1997.
Что мы знаем о химии? Вопросы и ответы: Справ. пособие / Ю.Н. Кукушкин, В.Ф. Буданова, Р.А. Власова и др.: Под ред. Ю.Н. Кукушкина. – М.: Высш. школа, 1993.


 .О. «Фонтан»
.О. «Фонтан» NН3 +НСI NН4 СI (образование солей аммония, удобрения)
NН3 +НСI NН4 СI (образование солей аммония, удобрения) Н3 + Н2 SО4 N Н4 НSО4 Недостаток гидросульфат аммония
Н3 + Н2 SО4 N Н4 НSО4 Недостаток гидросульфат аммония NН3 + 3О2 2N2 + 6Н2О
NН3 + 3О2 2N2 + 6Н2О