биох445. После воздействия соляной кислоты и протеолитических ферментов желудка нуклеопротеины распадаются до нуклеиновых кислот и белковой части
 Скачать 136.25 Kb. Скачать 136.25 Kb.
|
|
8. После воздействия соляной кислоты и протеолитических ферментов желудка нуклеопротеины распадаются до нуклеиновых кислот и белковой части. Белки перевариваются обычным образом, нуклеиновые кислоты – с помощью дополнительных ферментов. Панкреатический сок содержит рибонуклеазы и дезоксирибонуклеазы, гидролизующие все нуклеиновые кислоты до полинуклеотидов. 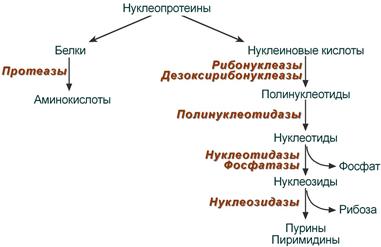 После действия панкреатических ферментов полинуклеотидазы (фосфодиэстеразы) кишечника гидролизуют нуклеиновые кислоты до мононуклеотидов. Далее, под действием нуклеотидаз и фосфатаз происходит гидролиз нуклеотидов до нуклеозидов, которые либо всасываются, либо под действием нуклеозидаз слизистой кишечника деградируют до пуриновых и пиримидиновых оснований.В просвете кишечника пуриновые основания могут подвергаться окислению до мочевой кислоты, которая всасывается и затем выделяется с мочой. Большая часть тех пуринов, что всосались, в энтероцитах также окисляется в мочевую кислоту, при этом не происходит их перехода в кровь, в другие клетки и включения во вновь образующиеся молекулы нуклеотидов и нуклеиновых кислот.Свободные пиримидиновые основания, подобно пуринам, в основном катаболизируют и выделяются без их использования в организме. 3. Дезаниминирование в организме челочка протекает в 2ариантах 1 В виде прямого дезаминирования 2 В виде непрямого дезаминирования (трансдезаминирование) Прямое дезаминировакие аминокислот в свою очередь на разных уровнях организации живых объектов встречается в 4 основных вариантах а) окислительное дезаминирование б) внутримолекулярное дезаминирование в) гидролитическое дезаминирование г) восстановительное дезаминирование В клетках человека работают только 2 из перечисленных окислительное и внутримолекулярное дезаминирование Прямое окислительное дезаминирование аминокислот. При прямом окислительном дезаминирование аминокислот образуются а-кетокислоты и аммиак Процесс идет в 2 этапа На первом зтапе при участии фермента оксидазы от аминокислоты отщепляется 2 атома водорода и аминокислота превращается в аминокислоту На втором этапе образованная аминокислота спонтанно присоединяет воду без участия фермента с образованием кетокислоты и аммиака Дегидрирование, происходящее на первом этапе сопровождается переносом водорода на ФАД или ФМН т е на простетические группы ферментов оксидаз т е вначале образуется восстановленный ФАД или ФМН и эти же восстановленные формы переносят затем водород на кислород (аэробные ) и образуется токсическая перекись водорода. В организме человека присутствует оксидаза L-аминокислот в качестве кофермента ФМН Эта оксидаза обладает низкой активностью, в то же время в тканях обнаружена оксидаза D-аминокислот, в качестве кофермента она содержит ФАД. Считают, что оксидаза D-аминокислот обеспечивает превращение D-аминокислот, которые образуются в кишечнике. Образуется аминокислота, водород переноситься на ФМН и этот кофермент переносит водород на кислород с, образованием перекиси водорода Перекись водорода немедленно разрушается каталазой. Аминокислота спонтанно присоединяет воду с образованием кетокислоты и отщеплением аминогруппы в виде аммиака Принято считать, что прямое дезаминирование аминокислот L ряда не вносит существенного вклада в метаболизм этих соединений человека В то же время практически во всех тканях организма человека обнаружены высоко активная дегидрогеназа Lглютаминовой кислоты Наибольшая активность этого фермента обнаружена в почках и печени Этот фермент обладает высокой специфичностью и катализирует прямое окислительное дезаминирование L-глютамата по схеме В качестве кофермента дегидрогназа содержит НАД На первом этапе водород с участием фермента переноситься на НАД с образованием восстановленного НАД, окисление которого несомненно сопровождается с образованием 3 молекул АТФ Образуется иминоглютамат Далее спонтанное присоединение воды обеспечивает образование 2 оксопиотарата (сс-кетоглютаровая кислота) и отщепляется аммиак. 11. Синтез молекул РНК начинается в определенных местах ДНК, называемых промоторами и завершается в терминаторах. Участок ДНК, ограниченный промотором и терминатором, представляет собой единицу транскрипции - транскриптон (оперон у прокариот). В пределах каждого транскриптона копируется только одна из двух нитей ДНК, которая называется значащей или матричной. Во всех транскриптонах, считываемых в одном направлении, значащей является одна нить ДНК, в транскриптонах, считываемых в противоположном направлении, значащей является другая нить ДНК. 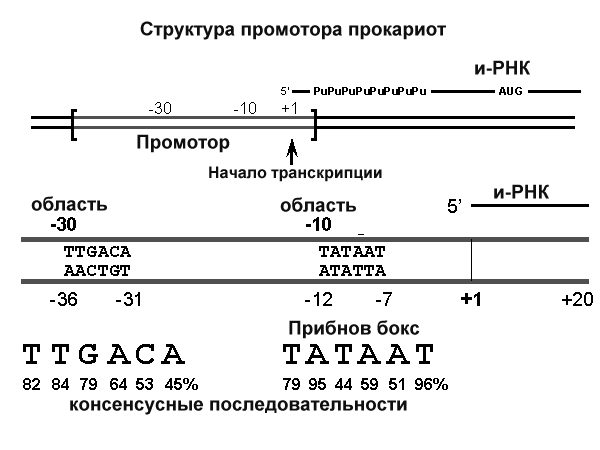 Соседние транскриптоны могут быть отделены друг от друга нетранскрибируемыми участками ДНК, а могут и перекрываться, в частности так, что в пределах участка перекрывания матричными оказываются обе нити. Разбиение ДНК на множество транскриптонов обеспечивает возможность независимого считывания разных генов, их индивидуального включения и выключения. У эукариот в состав транскриптона, как правило, входит только один ген, у прокариот транскриптон может содержать несколько структурных генов. 10. Начинается цикл с конденсации ацетил-КоА с оксалоацетатом и образования лимонной кислоты. (Как будет видно ниже, в цикле окислению подвергается собственно не ацетил-КоА, а более сложное соединение - лимонная кислота (трикарбоновая кислота).Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и дскарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса появляется оксалоацетат (четырехуглеродное соединение), т. е. в результате полного оборота цикла молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула оксалоацетата регенерируется. Ниже приводятся все восемь последовательных реакций (этапов) цикла Кребса.В первой реакции, катализируемой ферментом цитратсинтазой, ацетил-КоА конденсируется с оксалоацетатом. В результате образуется лимонная кислота: 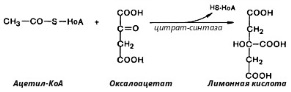 По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментом цитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и HS-KoA. 13. Конъюгация с глюкуроновой кислотой. Глюкуроновая кислота СбН10О7 относится к уроновым кислотам (продуктам окисления альдоз). Она представляет собой альдегидкарбоновую кислоту. При образовании уроновых кислот (в том числе и глюкуроновой) первичная спиртовая группа альдоз окисляется до карбоксильной группы, а альдегидная - остается неизменной. Образование глюкуроновой кислоты из глюкозы происходит по схеме. 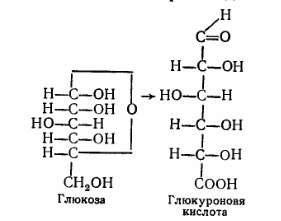 При образовании глюкуронидов переносчиком (коферментом) остатка глюкуроновой кислоты является УДФ-глюкуроновая кислота. Процесс образования глюкуронидов происходит при помощи фермента глюкуронилтрансферазы. Под влиянием указанного фермента глюкуроновая кислота с фенолами и спиртами образует О-глюкурониды: 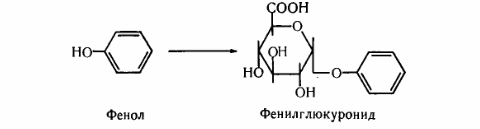 4. 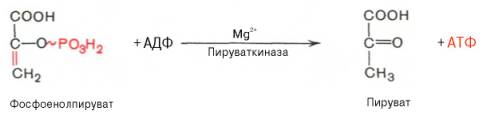  Например, Na-K канал выкачивает 3 молекулы натрия из клетки и вкачивает 2 молекулы калия в клетку. Такой ток ионов нужен для поддержания положительного заряда на наружной поверхности мембраны, и только с помощью аденозинтрифосфата канал может функционировать. То же касается протонных и кальциевых каналов. АТФ является предшественником вторичного мессенжера цАМФ (циклический аденозинмонофосфат) - цАМФ не только передает сигнал, полученный рецепторами мембраны клетки, но и является аллостерическим эффектором. Аллостерические эффекторы – это вещества, которые ускоряют или замедляют ферментативные реакции. Так, циклический аденозинтрифосфат ингибирует синтез фермента, который катализирует расщепление лактозы в клетках бактерии. Сама молекула аденозинтрифосфата также может быть аллостерическим эффектором. Причем в подобных процессах антагонистом АТФ выступает АДФ: если трифосфат ускоряет реакцию, то дифосфат затормаживает, и наоборот. Таковы функции и строение АТФ. В каждой клетке содержится аденозинтрифосфорная кислота(АТФ). По химической структуре АТФ относится к нуклеотидам. В ней как в каждом нуклеотиде, содержатся остатки азотистого основания (аденина), углевода (рибозы) и фосфорной кислоты. Вместе с тем АТФ существенно отличается от обычных нуклеотидов: вместо одного остатка фосфорной кислоты в ней содержатся 3 остатка.Одна из важнейших функций клетки – функция обмена веществ – обеспечение клетки энергией. Совокупность реакций, обеспечивающих клетки энергией, называется энергетическим обменом. Концевой фосфатный остаток дает при этом фосфорную кислоту, а АТФ превращается в АДФ, т.е. аденозиндифосфорную кислоту. Эта реакция сопровождается освобождением энергии (порядка 40 кДж/моль).АТФ служит энергетической «валютой» клетки и используется во всех реакциях обмена, требующих затраты энергии. Богатые энергией молекулы не перемещаются свободно из одной клетки в другую, а образуются в том месте, где они должны быть использованы. АТФ играет центральную роль в энергетическом обмене клетки. Она является непосредственным источником энергообеспечения любой клеточной функции. Движение, биосинтез, генерация электричества, света и т.д. - любые виды клеточной активности совершаются за счет энергии, освобождаемой в результате указанной выше реакции гидролиза АТФ.Но распад АТФ чередуется с непрерывным ее синтезом. Для восполнения израсходованной АТФ используется энергия, освобождаемая в результате расщепления углеводов, липидов и других веществ.Запас АТФ в клетке невелик. Так, в мышце запаса АТФ хватает на 20 – 30 сокращений. Но ведь мышца может работать часами и производит тысячи сокращений. Вот почему наряду с распадом АТФ необходим непрерывный её синтез. Для восполнения израсходованной АТФ и используется энергия, освобождаемая в результате расщепления углеводов, липидов и других веществ. При усиленной, но, кратковременной работе, например при беге на короткие дистанции, мышцы работают исключительно за счёт содержащихся в них АТФ. После окончания бега человек усиленно дышит – в этот период происходит расщепление углеводов и других веществ, и запас АТФ в клетках восстанавливается. Таким образом АТФ – единый и универсальный источник энергообеспечения клетки. 7. Первичной структурой ДНК называют линейную полинуклеотидную цепь, в которой мононуклеотиды соединены 3', 5'-фосфодиэфирными связями. Исходным материалом при сборке цепи нуклеиновой кислоты в клетке является нуклеозид 5'-трифосфат, который в результате удаления β и γ остатков фосфорной кислоты способен присоединить 3'-атом углерода другого нуклеозида. Таким образом, 3'-атом углерода одной дезоксирибозы ковалентно связывается с 5'-атомом углерода другой дезоксирибозы посредством одного остатка фосфорной кислоты и образует линейную полинуклеотидную цепь нуклеиновой кислоты. Отсюда и название: 3', 5'-фосфодиэфирные связи. Азотистые основания не принимают участия в соединении нуклеотидов одной цепи . Такое соединение, между остатком молекулы фосфорной кислоты одного нуклеотида и углеводом другого, приводит к образованию пентозо-фосфатного скелета молекулы полинуклеотида, на котором сбоку один за другим присоединяются азотистые основания. Их последовательность расположения в цепях молекул нуклеиновых кислот строго специфична для клеток разных организмов, т.е. носит видовой характер (правило Чаргаффа).Линейная цепь ДНК, длина которой зависит от числа входящих в цепь нуклеотидов, имеет два конца: один называется 3'-концом и содержит свободный гидроксил, а другой - 5'-концом, содержит остаток фосфорной кислоты. Цепь полярна и может иметь напрвление 5'->3' и 3'->5'. Исключением являются кольцевые ДНК.Генетический "текст" ДНК составлен с помощью кодовых "слов" - триплетов нуклеотидов, называемых кодонами. Участки ДНК, содержащие информацию о первичной структуре всех типов РНК, называют структурными генами.Полинуклеодитные цепочки ДНК достигают гигантских размеров, поэтому в клетке они упакованы определенным образом.Вторичная структура ДНК - это двойная спираль, модель которой была предложена Д.Уотсоном и Ф.Криком в 1953 году.Еще одним важным косвенным указанием на возможную структуру ДНК послужили данные Л. Полинга о строении белковых молекул. Полинг показал, что возможно несколько различных устойчивых конфигураций аминокислотной цепи в белковой молекуле. Одна из распространенных конфигураций пептидной цепи - α-спираль - представляет собой правильную винтообразную структуру. При такой структуре возможно образование водородных связей между аминокислотами, находящимися на смежных витках цепи. Полинг описал α-спиральную конфигурацию полипептидной цепи в 1950 году и высказал предположение, что и молекулы ДНК, вероятно, имеют спиральную структуру, закрепленную водородными связями.Однако наиболее ценные сведения о строении молекулы ДНК дали результаты рентгеноструктурного анализа. Рентгеновские лучи, проходя сквозь кристалл ДНК, претерпевают дифракцию, т. е. отклоняются в определенных направлениях. Степень и характер отклонения лучей зависят от структуры самих молекул. Дифракционная рентгенограмма дает опытному глазу ряд косвенных указаний относительно строения молекул исследуемого вещества. Анализ дифракционных рентгенограмм ДНК привел к заключению, что азотистые основания (имеющие плоскую форму) уложены наподобие стопки тарелок. Рентгенограммы позволили выявить в структуре кристаллической ДНК три главных периода: 0,34, 2 и 3,4 нм. Исходя из аналитических данных Чаргаффа, рентгенограмм, полученных Уилкинсом и исследований химиков, предоставивших сведения о точных расстояниях между атомами в молекуле, об углах между связями данного атома и о величине атомов, Уотсон и Крик начали строить физические модели отдельных составных частей молекулы ДНК в определенном масштабе и "подгонять" их друг к другу с таким расчетом, чтобы полученная система соответствовала различным экспериментальным данным . В результате своих исследований, в 1953 году Уотсон и Крик предложили модель строения молекулы ДНК , которая остается актуальной по настоящее время. Согласно модели молекула ДНК состоит из двух комплементарных полинуклеотидных цепей. Каждая цепь ДНК представляет полинуклеотид, состоящий из нескольких десятков тысяч нуклеотидов. В ней соседние нуклеотиды образуют регулярный пентозо-фосфатный остов за счет соединения остатка фосфорной кислоты и дезоксирибозы прочной ковалентной связью. Азотистые основания одной полинуклеотидной цепи при этом располагаются в строго определенном порядке против азотистых оснований другой. Чередование азотистых оснований в полинуклеотидной цепи нерегулярно.Расположение азотистых оснований в цепи ДНК является комплементарным (от греч. "комплемент" - дополнение), т.е. против аденина (А) всегда оказывается тимин (Т), а против гуанина (Г) - только цитозин (Ц). Это объясняется тем, что А и Т, а также Г и Ц строго соответствуют друг другу, т.е. дополняют друг другу. Такое соответствие задается химической структурой оснований, позволяющей образовать водородные связи в паре пурина и пиримидина. Между А и Т возникают две связи, между Г и Ц - три. Эти связи обеспечивают частичную стабилизацию молекулы ДНК в пространстве. Устойчивость двойной спирали при этом прямо пропорциональна числу связей G≡С, являющихся более стабильными по сравнению со связями А=Т.Известная последовательность расположения нуклеотидов в одной цепи ДНК позволяет по принципу комплементарности установить нуклеотиды другой цепи.Кроме того, установлено, что азотистые основания, имеющие ароматическую структуру, в водном растворе располагаются один над другим, формируя как бы стопку монет. Такой процесс формирования стопок из органических молекул называется стекинг. Полинуклеотидные цепи молекулы ДНК рассматриваемой модели Уотсона-Крика имеют аналогичное физико-химическое состояние, их азотистые основания располагаются в виде стопки монет, между плоскостями которых возникают ван-дер-ваальсовы взаимодействия (стекинг-взаимодействия).Водородные связи между комплементарными основаниями (по горизонтали) и стекинг-взаимодействие между плоскостями оснований в полинуклеотидной цепи за счет ван-дер-ваальсовых сил (по вертикали) обеспечивает молекуле ДНК дополнительную стабилизацию в пространстве.Сахарофосфатные остовы обеих цепей обращены наружу, а основания внутрь, навстречу друг другу. Направление цепей в ДНК антипараллельно (одна из них имеет направление 5'->3', другая - 3'->5', т.е. 3'-конец одной цепи расположен напротив 5'-конца другой.). Цепи образуют правые спирали с общей осью. Один виток спирали составляет 10 нуклеотидов, размер витка 3,4 нм, высота каждого нуклеотида 0,34 нм, диаметр спирали – 2,0 нм. В результате вращения одной цепи вокруг другой, образуется большая борозда (диаметром около 20 Å ) и малая борозда (около 12 Å) двойной спирали ДНК. Такая форма двойной спирали Уотсона-Крика в дальнейшем получила название В-формы. В клетках ДНК обычно существует в В-форме, которая является самой стабильной. 13. 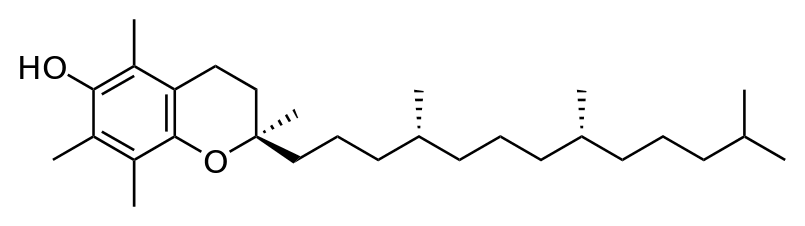 Русское название. Витамин E. Латинское название вещества Витамин E. Vitaminum E (род. Vitamini E). Химическое название. 3,4-Дигидро-2,5,7,8-тетраметил-2-(4,8,12-триметилтридецил)-2Н-1-бензопиран-6-ола ацетат. Брутто-формула. C31H52O3 Фармакологическая группа вещества Витамин E. Витамин Е также улучшает циркуляцию крови, необходим для регенерации тканей, полезен при предменструальном синдроме и лечении фиброзных заболевания груди. Он обеспечивает нормальную свертываемость крови и заживление; снижает возможность образования шрамов от некоторых ран; снижает кровяное давление; способствует предупреждению катаракт; улучшает атлетические достижения; снимает судороги ног; поддерживает здоровье нервов и мускулов; укрепляя стенки капилляров; предотвращает анемию.В качестве антиоксиданта витамин Е защищает клетки от повреждения, замедляя окисление липидов (жиров) и формирование свободных радикалов. Он защищает другие растворимые жирами витамины от разрушения кислородом, способствует усвоению витамина А и защищает его от кислорода. Витамин Е замедляет старение, может предотвращать появление старческой пигментации.Витамин Е участвует также в формировании коллагеновых и эластичных волокон межклеточного вещества. Токоферол предотвращает повышенную свертываемость крови, благоприятно влияет на периферическое кровообращение, участвует в биосинтезе гема и белков, пролиферации клеток, образовании гонадотропинов, развитии плаценты. 12. Нарушение липидного обмена – это расстройство процесса выработки и расщепления жиров в организме, что происходит в печени и жировой ткани. Подобное расстройство может быть у любого человека. Наиболее частой причиной развития такой болезни выступает генетическая предрасположенность и неправильное питание. Помимо этого, не последнюю роль в формировании играют гастроэнтерологические заболевания. Подобное расстройство имеет довольно специфическую симптоматику, а именно увеличение печени и селезёнки, быстрый набор массы тела и образование ксантом на поверхности кожного покрова. Поставить правильный диагноз можно на основании данных лабораторных исследований, которые покажут изменение состава крови, а также при помощи информации, полученной в ходе объективного физикального осмотра. Подобное заболевание очень часто развивается при протекании различных патологических процессов. Липиды – это жиры, которые синтезирует печень или поступают в человеческий организм вместе с пищей. Подобный процесс выполняет большое количество важных функций, а любые сбои в нём могут привести к развитию довольно большого количества недугов. Причины нарушения могут быть как первичными, так и вторичными. Первая категория предрасполагающих факторов заключается в наследственно-генетических источниках, при которых происходят единичные или множественные аномалии тех или иных генов, отвечающих за продуцирование и утилизацию липидов. Провокаторы вторичной природы обуславливаются нерациональным образом жизни и протеканием ряда патологий. Таким образом, вторая группа причин может быть представлена: атеросклерозом, который также может возникать на фоне отягощённой наследственности; Атеросклероз сосудов нерациональным питанием, а именно чрезмерным употребление в пищу блюд и продуктов, обогащённых холестеринами и насыщенными жирными кислотами. Именно из-за этого, одним из направлений лечения болезни выступает диета; злоупотреблением вредными привычками, а именно регулярное распитие большого количества спиртных напитков и выкуривание сигарет; дисфункцией органов эндокринной системы – наиболее часто развивается нарушение липидного обмена при сахарном диабете; хронической печёночной недостаточностью; гипертиреоидизмом и панкреатитом; синдромом Уиппла и лучевой болезнью; протеканием билиарного цирроза печени первичной формы; неправильной работой щитовидной железы, а именно её гиперфункция; бесконтрольным приёмом некоторых лекарственных препаратов, среди побочных эффектов которых наблюдаются сбои во всасывании жиров. Помимо этого, клиницисты выделяют несколько групп факторов риска, наиболее подверженных разладам жирового обмена. К ним стоит отнести: половую принадлежность – в подавляющем большинстве случаев подобная патология диагностируется у представителей мужского пола; возрастную категорию – сюда стоит отнести женщин постменопаузального возраста; период вынашивания ребёнка; ведение малоподвижного и нездорового образа жизни; неправильное питание; артериальная гипертензия; наличие лишней массы тела; диагностированные ранее у человека патологии печени или почек; протекание болезни Кушинга или эндокринных недугов; наследственные факторы. |
