 
  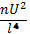 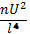 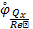 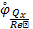 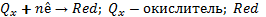 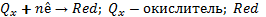           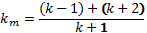 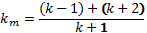 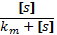 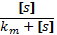 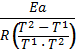 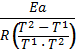 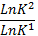 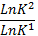   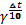  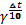 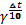 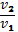 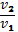 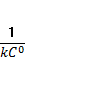 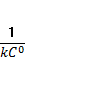 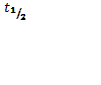 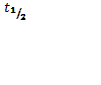 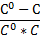 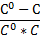   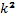  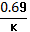 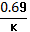 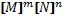 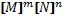 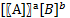 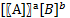 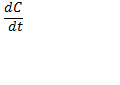 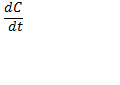 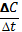 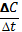 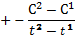 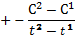     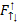 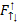 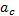 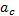 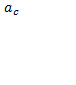 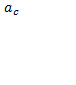 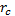 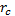 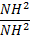 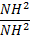 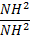 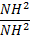 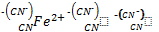 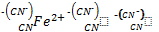 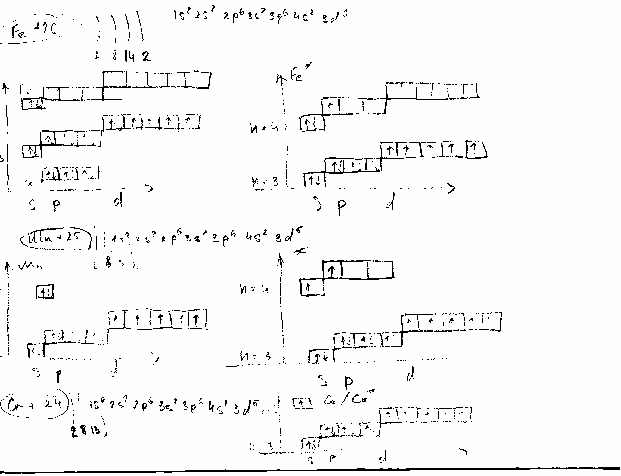 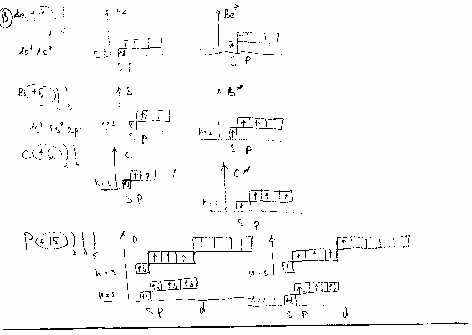 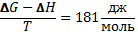   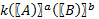     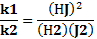 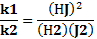 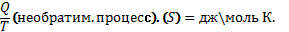 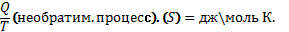 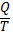 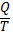 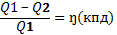 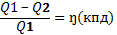 Предмет и задачи химии. Химия – наука о превращении в-в. Она изучает состав и строение в-в, зависимости св-в в-в от их состава и строения, условия и пути превращения одних в-в в другие. Движение – свойство материи, присущее материи в целом и каждой ее частице. Химия изучает в-во, которое обладает определенными свойствами и своей формулой- химическими реакциями – вещ-во является предметом химии. Все жизненные процессы – изменение движения ( формы). Формы движения – нагревание и охлаждение тел, излучение света, эл. Ток. Одни формы могут переходить в другие. Важная задача – получение заранее предусмотренного в-ва, получение энергии хим. Превращений. В медицине – понимание хим.процессов , лежащих в основе болезни помогает направленному поиску способов ее лечения. Создают препараты, синтезируют в-ва. Препараты обладающие антимикробным. Противовоспалительным, противоожоговые и др. Искуств. органы, сосуды, суставы. Различные химические анализы. Термодинамика-наука о взаимопревращении теплоты и энергии. Термодинамика определяет возможно ли протекание р-ции, в каком направлении. Термодинамич. Система – любой объект природы, состоящий из достаточно большого числа молекул(структурных единиц) и отделенный от других объектов природы реальной или воображаемой границей. Объекты природы не входящие в систему называются средой. Изолированная сист. – не обменивается с окружающей средой ни в-вом, ни энергией ∆м= 0, ∆Е=0.Закрытая сист. - не обменивается в-вом и энергией ∆м=0, ∆Е≠0. Открытая система- обменивается и в-вом и энергией ∆м≠0,∆Е≠0. Обмен энергией может осуществляться передачей теплоты или совершением работы. Гомогенная система- однородная структура (плазма). Гетерогенная – сост. Из 2 гомогенных (кровь). Предмет и задачи химии. Химия – наука о превращении в-в. Она изучает состав и строение в-в, зависимости св-в в-в от их состава и строения, условия и пути превращения одних в-в в другие. Движение – свойство материи, присущее материи в целом и каждой ее частице. Химия изучает в-во, которое обладает определенными свойствами и своей формулой- химическими реакциями – вещ-во является предметом химии. Все жизненные процессы – изменение движения ( формы). Формы движения – нагревание и охлаждение тел, излучение света, эл. Ток. Одни формы могут переходить в другие. Важная задача – получение заранее предусмотренного в-ва, получение энергии хим. Превращений. В медицине – понимание хим.процессов , лежащих в основе болезни помогает направленному поиску способов ее лечения. Создают препараты, синтезируют в-ва. Препараты обладающие антимикробным. Противовоспалительным, противоожоговые и др. Искуств. органы, сосуды, суставы. Различные химические анализы. Термодинамика-наука о взаимопревращении теплоты и энергии. Термодинамика определяет возможно ли протекание р-ции, в каком направлении. Термодинамич. Система – любой объект природы, состоящий из достаточно большого числа молекул(структурных единиц) и отделенный от других объектов природы реальной или воображаемой границей. Объекты природы не входящие в систему называются средой. Изолированная сист. – не обменивается с окружающей средой ни в-вом, ни энергией ∆м= 0, ∆Е=0.Закрытая сист. - не обменивается в-вом и энергией ∆м=0, ∆Е≠0. Открытая система- обменивается и в-вом и энергией ∆м≠0,∆Е≠0. Обмен энергией может осуществляться передачей теплоты или совершением работы. Гомогенная система- однородная структура (плазма). Гетерогенная – сост. Из 2 гомогенных (кровь).
Первое начало термодинамики – приращение внутренней энергии системы ∆Е в некотором процессе = Q (теплоте) , полученной системы плюс работа W, совершенная над системой в этом процессе. Внутренняя энергия – функция состояния, приращение которой равно теплоте Qv, полученной системой в изохорном процессе (V = const) . Процессы протекающие при (p=const) – изобарные. При (t= const) – изотермические. Система равновесная – если все св-ва остаются постоянными в течении времени ( нет потоков в-ва и энергии. Если свойства постоянны но есть потоки то система стационарная. Энтальпия – функция состояния, приращение которой равно теплоте, полученной системой в изобарном процессе (p=const) энтальпия- H=E+ pV . Математическое выражение 1 го закона ТД. - ∆U=Q-A . Более удобная запись Q=∆U-A.
Закон Гесса: Если при постоянной V или P из одинаковых исходных в-в можно получить конечное в-во различными путями, то тепловой эффект не зависит от способа проведения процесса. С6Н12О6+6О2 →6СО2+6Н2О (∆Н=2810 кдж/моль) (1) С(т) +1/2 О2→СО(г) +110 кдж/моль. (2) СО (г)+ 1/2 О2→СО2(г) + 238 кдж/моль. (3) С (т) + О2 → СО2(г) +393кдж/моль. Свойства: 1)дробные коэф.;2)Q и ∆Н ;3)указ. Агрегатные сотояния;4)можно проводить простые арифметические действия. ∆Н⁰обр. : 1)вещ-во должно образов. Из простых в-в Н2(г)+ ½ О2(г)→Н2О; 2)ведется при Т 25⁰С= 298К;3)расчет ведется на 1 моль в-ва;4)P=1 атм.. 1 Следствие зак. Гесса: 1) тепловой эф. Реакции –сумма теплот образования конечных продуктов минус сумма теплот образ. Исходных ∆Н=∑n∆Н⁰обр.кон.-∑n∆Н⁰обр.исх. (n- число в-ва уч-щего в реакции).2 следствие2) тепловой эф. Реакции = сумма теплот сгорания исходных в-в минус сумма сгорания конечных в-в. ∆Н=∑n∆Н⁰сгор.исх.-∑n∆Н⁰сгор.кон. 3) если из одинаковых исходных получаются хим. Различные агрегатные состояния, то их тепловой эффект будут отличаться на теплоту фазовых переходов; 4) теплоты образования простых в-в = 0 : ∆Н⁰обр(Н2) =0. Термохимические реакции: 6С+6Н2+3О2=С6Н12О6, ∆Н⁰=-1270кдж. С+О2= СО2, ∆Н⁰=-390кдж., Н2+1/2 О2=Н2О, ∆Н⁰= -285 кдж.
Обратимые и необратимые процессы. Процесс называется термодинамически обратимым, если при переходе из начального состояния1 в конечное состояние 2 все промежуточные состояния оказываются равновесными. Процесс называется термодинамически необратимым, если хоть одно из промежуточных состояний неравновесное. Процессы жизнедеятельности можно считать примером необратимых процессов; Т.к. для обратимости необходимо медленное изменение параметров системы- температуры, давления. концентрации в-в, что в живом организме не возможно; растворение сахара в стакане чая -процесс теплообмена при конечной разности температур. Обратимый: (Т=const). При расширении газа Q→ при сжатии Q←
Второе начало термодинамики: в изобарно изотермических условиях (р,Т = const) в сист. Самопроизвольно могут осуществляться только такие процессы. В результате которых энергия Гиббса системы уменьшается (G<0). В состоянии равновесия энергия гиббса не меняется (G= констТ,∆G=0). ∆G<0; р,т = конст.. Планк и Кельвин: 2 закон Т.Д.: невозможно построить тепловую машину, вся деятельность которой сводиться к совершению работы и охлаждению теплового резервуара. Клаузиус : 2 зак. Т.Д. : самопроизвольный переход тепла от менее нагретого к более – невозможно. Теплодатчик(Q1)→раб.А→теплоприемник(Q2). Вечный двигатель второго порядка невозможен.. Клаузиус : S- энтропия (энергия ушедшая в теплоприемник)- это энергия рассеянная в системе, является мерой хаотичности системы, т.е. энергия обесцененная – невозможная ни во что превращаться .S=(обратим. Процесс). S>Самопроизвольные процессы протекают самопроизвольно только с увеличением энтропии→она явл. Направленностью процесса. ∆S>0 – идет процесс ∆S=0 – в равновесии. Больцман связал энтропию с вероятностью(W) - S=k lnW (k – константа Больцмана, k= R/Na.
Энергия Гиббса: определяется через энтальпию Н и энтропию S с помощь соотношения : G=Н- ТS ; ∆G=∆Н-Т∆S - такой процесс называется изобарно-изотермическим. Энергия Гиббса реакции = сумма энергий Гиббса образования стехиометрического количества продуктов за вычетом алгебраической суммы энергий Гиббса образования стехиометрического количества реагентов. ∆G= (nс∆Gс+nd∆Gd)-(na∆Ga+nb∆Gb). В состоянии равновесия энергия Гиббса не изменяется (G=конст,∆G=0).
Самопроизвольные процессы. Процесс называется самопроизвольным, сли он осуществляется без каких либо воздействий, когда система предоставлена самой себе. Химические реакции при которых происходит уменьшение энергии Гиббса системы (∆G<0) и совершается работа, называются экзергоническими. Реакции, в результате которых эн. G возрастает ∆G>0 и над системой совершается работа, называются эндергоническими.
При ∆G=0 термодин равновесие, ∆G меньше 0 –процесс самопроизвольно протекает в прямом нарпавлении, при ∆G больше 0- прямой процесс самопроизвольно протекать не может, только обратный.
Обратимыми по направлению химическими реакциями называются такие реакции, которые при данных внешних условиях могут самопроизвольно протекать как в прямом, так и в обратном направлении. когда скорости прямой и обратной реакции становятся одинаковыми наступает химическое равновесие. Необратимые реакции протекают до конца -до полного израсходования одного из реагирующих в-в, когда скорости прямой и обратной р-ции становятся одинаковыми, наступает хим.равновесие. Химическое равновесие называют динамическим. Эти подчеркивается, что при равновесии протекают и прямая и обратная реакции, но их скорости одинаковы, вследствие чего изменений в системе не заметно. Количественной характеристикой химического равновесия служит величина. Называемая константой химического равновесия. Рассмотрим ее на примере реакции синтеза иодоводорода: Н2+J2↔2НJ согласно зак. Дейст. Масс. Скорости прямой(v1 ) и обратной (v2 )реакции выражаются уравнениями v1=k1(Н2)(J2) v2=k2(НJ)² при равновесии скорости прямой и обратной реакции равны друг другу : k1(Н2)(J2) =k2(НJ)² или отношение констант скорости прямой и обратной реакции представляет собой константу. Она называется константой равновесия данной реакции (К): отсюда окончательно : . Закон действующих масс (гульдберг и вааге) :при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, причем каждая концентрация входит в произведение степени, равной коэффициенту ,стоящему перед формулой данного вещества в уравнении реакции. В общем виде для уравнения aA+bB+…=… тогда З.Д.М. можно записать v=… В случае гетерогенных реакций в уравнение здм входит концентрации только тех в-в ,которые находятся в газовой фазе или в растворе. Концентрация твердого в- ва представляет собой постоянную величину и поэтому входит в константу скорости. например для горения угля: С=О2=СО2 здм запишется так : U=k’∙ конст ∙ (О2)= k(О2) где k=k’∙конст.
Теорема Пригожина. Применяемость основных закономерностей ТД к живым организмам. Организмы как открытые системы. Живые орг. Находятся в состоянии не равновесном, т.к. для них равновесие – это смерть. В живых организмах все процессы идут только в прямом направлении, с постоянно скоростью. В организме реакции начин-ся с 1 го порядка, а заканчиваются 0 порядком. Свойства живых организмов: 1) Организмы постоянно удаляются от состояния равновесия; 2)структура системы находиться в взаимодействии с окружающей средой. 1945г Пригожин получил нобелевскую. Он предложил : 1) рассматривать организмы и окружающую среду как часть одной системы и все расчеты вести совместно – одновременно; 2) для живого организма характерно «стационарное состояние» все реакции нулевого порядка, т.е. протекают с одинаковой скоростью только в прямом направлении; 3) «потки» ввел (термин); ( организмы способны понижать свою энтропию); 4) элементы кинетики: ∆S=∆iS (интро внутр) +∆eS(экстра внешняя) ∆S↗;↙∆iS;↗∆eS ∆H=-2816кдж/моль,∆G=-2860; ∆G=∆H-T∆S→∆S= ∆t=∆t(производство энтропии)+ ∆t (скорость потока) . Теорема Пригожина : в стационарном состоянии все производные энтропии стремятся к минимуму.
?значение термохимии для биологии и медицины.Тепловой эфф. Реакции нейтр.Тепловой эффект реакции зависит только от начального и конечного состояния в-в, и не зависит от промежуточных стадий процесса. Тепловой эф. Хим. Реакции = ∑теплот образования получающихся в-в за вычетом ∑теплот образования исходных в-в. Реакциями нейтрализации называются обменные реакции взаимодействия кислот и оснований, в результате которых образуется соль о вода и выделяется тнплота. 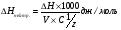 1)2NaOH+H₂SO₄→Na₂SO₄+2H₂O+61,7 кдж ;2)NaHSO₄+NaOH→Na₂SO₄+H₂O=69.7 кдж. В химической индустрии термоэффекты необходимы для расчета количества теплоты для нагревания реакторов, в которых идут эндотермические реакции. В энергетике с помощью теплот сгорания топлива рассчитывают выработку тепловой энергии. 1)2NaOH+H₂SO₄→Na₂SO₄+2H₂O+61,7 кдж ;2)NaHSO₄+NaOH→Na₂SO₄+H₂O=69.7 кдж. В химической индустрии термоэффекты необходимы для расчета количества теплоты для нагревания реакторов, в которых идут эндотермические реакции. В энергетике с помощью теплот сгорания топлива рассчитывают выработку тепловой энергии.
Врачи-диетологи употребляют термоэффекты окисления пищевых товаров в организме для составления правильных рационов питания не лишь для больных, но и для здоровых людей - спортсменов, работников разных профессий. По традиции для расчетов тут употребляют не джоули, а остальные энергоединицы - калории (1 кал = 4,1868 Дж). Энергетическое содержание пищи относят к какой-нибудь массе пищевых товаров: к 1 г, к 100 г либо даже к обычной упаковке продукта
Современные представления о строении атома: изучение атомных орбиталей, показало, что характер движения электрона в атоме определяется четырьмя числами n,l,m,s, получившими общее название квантовых. Электронная оболочка атома – это совокупность всех электронов в данном атоме. Электрон имеет двойственную природу, он одновременно является и частицей и волной→квантово механическая теория структуры атома. Часть атомного пространства, в которой вероятность нахождения электрона наибольшая (≈90z) называется атомной орбиталью. Энергия и размер орбитали и электронного облака характеризуется главным квантовым числом – n. Совокупность орбиталей, которые имеют одинаковое значении главного квантового числа – это энергетический уровень. Совокупность электронов , которые находятся на одном энергетическом уровне . эл. Слой. Форма орбиталей и облаков характеризуется побочным (орбитальным) квантовым числом l. Энергетический подуровень – совокупность орбиталей .которые находятся на одном энергетическом уровне и имеют одинаковую форму. Орбитали одного подуровня имеют одинаковые значения главного квантового числа (n) и одинаковые значения побочного квантового числа. Число подуровней на уровне тоже равно главному квантовому числу. Магнитное квантовое число m характеризует направление орбиталей (электронных облаков) в пространстве. Электрон характеризуется спиновым квантовым числом. Принцип Паули : в системе не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Принципы заполнения эл. Оболочек Fe +26 (k-2;l-8;m-14;n-2) 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Основное и возбужденное состоянии атома Be,B,C,P,S.
Основное и возб.состояни, железа,марганца,хрома
Периодический закон и периодическая система Менделеева в свете квантовой теории строения атома: свойства элементов и их однотипных соединений находятся в периодической зависимости от заряда атомных ядер элементов. В основе теории строения атома лежит понятие о двойственности природы микрообъектов (в том числе и электронов) – они могут проявлять себя как частицы и как волны. Как частица- электрон обладает массой и зарядом, как волна – способен к интерференции и дифракции.
Структура периодической системы Менделеева: 1) строение внешней оболочки атома является периодической функцией зарядового числа атома Z ; 2) химические свойства электрона находится в периодической зависимости от заряда ядра; 3) номер периода = главному квантовому числу n энергетического уровня внешнего n - орбиталей, заполняемых в этом периоде; 4) число элементов в периоде ,т.е. его длина, равна удвоенному числу внешних квантовых ячеек (орбиталей), заполняемых в этом периоде; 5) в одну группу периодической системы входят элементы с однотипной электронной конфигурацией внешней оболочки атома. S-блок. Объединяет 2 группы. 1А-щелочных и 2А щелочноземельных металлов. В качестве валентных выступают электроны s-орбиталей. Поэтому элементы этих групп называют s-элементами. D-блок объединяет 8 групп 3Б-8Б, 1Б, 2Б комплексообразующих переходных элементов. Валентными, как правило, являются электроны s- и d-орбиталей. Элементы этих групп наз. D-элементами. P-блок объединяет 6 групп: 3А-8А неметаллов, Амфотерных и благородных элементов. Поскольку валентным являются электроны p-орбиталей, элементы этих групп-p-элементы. Элементы, атомы которых завершают заполнение электронной оболочки на f-подгруппы, называют f-элементами. Это свойство лантаноидов и актиноидов.
Периодические свойства элементов(радиус атомов, энергия ионизации, сродство к электрону, ЭО) их изменение в группах и периодах. Пр движении по периоду таблицы слева направо радиус атомов уменьшается, а энергия ионизации увеличивается. С увеличением номера элемента (заряда ядра) в группе атомный радиус увеличивается, а энергия ионизации падает. В периоде с увеличением заряда ядра ЭО возрастает, в группе ЭО уменьшается. Энергия, выделяющаяся при присоединении êк свободному атому назыв. сродством атома. Сродство к электрону атомов металлов как правило близко к 0 или отрицательно, для атомов металлов присоединение ê энергетически невыгодно. Сродство к ê атомов неметаллов всегда положительно, это свидетельствует об усилении неметаллических свойств по мере приближения к концу периода.
Комплексные соединения (Кс) координационная теория Вернера. В 1893 г А.Вернер предложил координационную теорию, объединяющую наиболее точное строение и свойства: 1)согласно теории : в молекуле любого комплексного соединения центральное место занимает комплексообразователь, обычно Ме+ (Сu,Fe,Co,Ni,Ag,Pt,Cr и т.д.) обычно это d элементы. 2)вокруг комплексообразов. Располаг. Противоположного знака ионы или эл. Нейтральные молекулы – лиганды – адденды; количество их показывает координационное число; 3) комплексообразователь и адденозы составляют внутреннее координационную схему КС. В сумме + катион или – анионный комплекс или нейтральный. К₃((Комплексообр)Fe(CN лиганд)₆коорд.ч). По Вернеру лиганды в Кс присоед. За счет главного валентного (прост. Соед) и побочной (кс). В структурных формулах главная валентность штрихом , а побочная пунктиром()3К⁺ ион. Свойства 1К⁺донорно акцеп. Ковалентные св.
Классификация и номенклатура Кс: 1) по характеру электрического заряда: а) катионные комплексы (вокруг нейтральные молекулы: Н₂О – акво, NH₃ – амин) пример (AL(H₂O)₆) CL₃ трихлор гексоаква алюминия; (Zn(NH₃)₄)Cl₂ хлорид тетроамин цинка (2); б) анионные комплексы – когда вокруг корд. Лиганды «-« анионы. – заряд отражается в названии добавлением суффикса –ат.: K₃[Fe(CN)₆] гексоцианоферрат (3) калия; K₂[Zn(Cl)₄] тетрахлорцинкат (2) калия. в) сильный к. – соединения в которых йон комплексообразователя – сильнополяризованный атом, сильно ЭО элемент (F,O,N и др.), а + поляриз. Атомы Н в качестве лигандов: NH₃⁺ , H₃O⁺(оксоний), FH₂⁺(фтороний); г)нейтральные комплексы- образуются когда вокруг корд. 1) молекулы,2) одновременно и – ионы и молекулы ( без внешней координационной сферы): примеры: [Ni(Co)₄] – тетракарбонил никеля; [Cr(C₆H₆)₂] – дибензол хром, [Pt(NH₃)₂Co₂] – дихлор диамин платина (2). 2) По природе лигандов: а) аммиакаты – кс, когда вокруг амин комплексы (аммиак) : [Cu(NH₃)₄]Cl₂ - дихлор тетроамин меди (хлорид тетроамин меди); б)аквакомплексы – координируется вода [Cr(H₂O)₆]Cl₃ - трихлорид гексааква хрома (хлорид гесааква хрома); в) ацидокомплексы – вокруг анионы кислотных остатков(хлора, циано, гидроксо и т.д.).
Хелатные кс, природа их лигандов, природные и внутрикомплексные соединения (гемоглобин крови, хлорофилл, витамин В12). Хелатные соединения отличаются особой прочностью. Т.к. центральный атом в них как бы блокирован циклическим лигандом. Наибольшей устойчивостью обладают хелаты с пяти и шестичленными циклами. Например комплексный катион пишется так : Cu²⁺ . По внешнему сродству подобные соединения называются хелатные. Биоорганические молекулы могут содержать большое число донорных атомов. Такие молекулы являются полидентантными лигандами. К ним относят в первую очередь белки и нуклеиновые кислоты. Если в комплексном соединении используются активные центры Fe²⁺ или Cu⁺образуются активные центры гемоглобина и гемоцианина. Независимо от дентантности лиганда природа химической связи и строение комплекса определяются донорными атомами. Комплексы жира и кобальта входят в состав бионеорганических соединений гемоглобина, каталазы, цитохромов, витамина В12. Дефицит этих веществ в организме человека приводит к серьезным заболеваниям.
Природа химической связи в КС. Образование химической связи в кс может быть рассмотрен как с позиции метода ВС, так и на основе метода МО. Согласно методу ВС, при взаимодействии с лигандом происходит возбуждение центрального атома или иона и гибридизации его орбиталей.
Устойчивость комплексных соединений в растворах. Константы нестойкости и устойчивости. Из природы хим.связей известно, что частицы связаны ионогенно. А комплексообразователь с лигандами связан электростатическими силами. Для определения устойчивости или прочности комплексов MLn изучают обратимую по направлению реакцию образования этого комплекса. M+nL↔MLn . Определяемая на основе ЗДМ константа этого равновесия называется константой устойчивости
?
Пероксид водорода (Н₂О₂) - бесцветная жидкость , в чистом виде взрывоопасен. Применяется 30% (пергидраль) и 3%. Н₂О₂↔Н⁺+НО₂⁻; НО₂⁻↔Н⁺+О₂²⁻. Т.к. у О степень окисления -1, то выступает как окислитель и восстановитель, но лучше окислительные свойства: H₂O₂+2H⁺+2e→2H₂O; восстановительные свойства : O₂+2H⁺+2e→H₂O₂. В кислой среде : 2KMnO₄+5H₂O₂+3H₂SO₄→2MnSO₄+5O₂+K₂SO₄+8H₂O ; 2FeSO₄+H₂SO₄+H₂O₂→Fe₂(SO₄)₃+2H₂O; в щелочной среде :MnCL₂+2NaOH+H₂O₂→MnO(OH)₂+H₂O+2NaCL ,H₂O₂+2e→2OH⁻; 2NaCrO₂+3H₂O₂+2NaOH→2Na₂CrO₄+2H₂O.
Химическая связь, длина связи валентный угол. Молекулы – наименьшие частицы в-ва, которые состоят из 2 и более атомов и определяют химические свойства вещества. Валентность – способность атома присоединять определенное число других атомов с образованием молекулы. Химическая связь – совокупность взаимодействий между электронами и ядрами, приводящих к соединению атомов в молекулу. Длина химической связи – величина, измеряемая расстоянием между ядрами связываемых атомов. Ориентация химических свойств- величина, измеряемая углом между направлениями связей данного атома с соседними атомами молекулы. Угол - валентный.
Механизм образования ковалентной связи: химическая связь между 2 атомами возникает в результате перекрывания внешних атомных орбиталей путем обобщения (обмена) двух электронов, находящихся на этих орбиталях. Химическую связь между атомами, возникающую согласно методу валентных связей (Вс), путем перекрывания атомных орбиталей и обобщения электронной пары. Называют ковалентной. ↑↓+↑↓ → ↑↓ ; ОFO + OFO →OFOFO.
Донорно – акцепторный механизм – механизм образования ковалентной связи за счет электронной пары одного атома(донора) и свободной орбитали др.атома(акцептора) (NH₃,H₂): Н·+·Н→Н:Н; Н₃N:+ Н+→NН₄⁺ ; H2O+ Н+→H3O+
?химическая кинетика применение медицине и фармации. Химическая кинетика – наука о скорости реакции, механизмы протекания, условии. Средняя скорость реакции: Vср==+- (+ Прямой ; - обратный) ; Истинная скорость реакции: V= +- ; на скорость реакции влияет : концентрация, Т, катализатор.
Кинетическая классификация химических реакций: Молекулярность определяется числом молекул участвующих в элементарном акте реакции и зависит от механизма реакции.1)молекулярность: а)мономолекулярные У₂→2У⁻; б)бимолекулярные У₂+Н₂→2НУ; в)тримолекулярные 2Н₂+О₂→2Н₂О . (в природе более 3 молекул одновременно не реагируют). 2) Порядок реакции определяется кинетическим уравнением и равен сумме показателей степеней при концентрациях в этом уравнении. Если скорость реакции не зависит от концентрации реагирующих веществ, то такие реакции называются реакциями нулевого порядка. Для реакции первого порядка скорость зависит от концентрации только одного вещества. К реакциям второго порядка относятся реакции соединения типа А+В↔С и реакции обмена А+В↔С+Д. Скорость таких реакций зависит от концентрации двух веществ, и сумма показателей степеней концентрации равна двум.
Влияние концентраций на скорость реакции. Закон Гульдберга и Вааге.- количественно связь между скоростью реакции и молярными концентрациями реагирующих в-в определяется ЗДМ, установлено гульдб. И вааге: при пост. Т скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, взятых в степенях их стехиометрических коэффициентов.. aA+bB↔mM+nN : v₁=K₁ ; v₂=K₂
Кинетические уравнения 1 и 2 порядка: 1)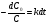 ; ; 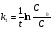 ; Т1\2=. Реакции первого порядка: все реакции распада и разложения;. 2) =* ;= зависит от исходной концентрации, во всех пробирках будет разный результат, т.к. чем больше С→ тем больше (ск.)U , т.к. молекулы вступают в химические связи при соударении молекул, а при большей С больше и столкновений. С⇧t⇾U⇧ из за броуновского движения. Порядок реакции определяется кинетическим уравнением и равен сумме показателей степеней при концентрациях в этом уравнении. Порядок реакции можно определить различными способами. По первому способу экспериментально определяют концентрации исходных веществ или продуктов реакции в разные моменты времени. Подставляя эти величины в кинетические уравнения разных порядков, находят, какое из них дает постоянное значение константы скорости. ; Т1\2=. Реакции первого порядка: все реакции распада и разложения;. 2) =* ;= зависит от исходной концентрации, во всех пробирках будет разный результат, т.к. чем больше С→ тем больше (ск.)U , т.к. молекулы вступают в химические связи при соударении молекул, а при большей С больше и столкновений. С⇧t⇾U⇧ из за броуновского движения. Порядок реакции определяется кинетическим уравнением и равен сумме показателей степеней при концентрациях в этом уравнении. Порядок реакции можно определить различными способами. По первому способу экспериментально определяют концентрации исходных веществ или продуктов реакции в разные моменты времени. Подставляя эти величины в кинетические уравнения разных порядков, находят, какое из них дает постоянное значение константы скорости.
Влияние Т на скорость реакции уравнения вант Гоффа и Аррениуса: ⇧t→⇧v из за ускорения броуновского движения. правило Вант Гоффа: с повышением температуры на каждые 10 градусов скорость хим.реакции ув. в 2-4 раза. =; v₂=·v₁ ; Уравнение Аррениуса: k=; ; = ; А=р·z (р – общее число ударений в молекуле; z- эффективное число ударений в молекуле). К- константа; А – преэкспонента; L-осн. Натур. Логарифм;Ea-энергия активации;K=8.91дж/моль К; T-темпер. К. Молекула должна обладать запасом энергии чтобы преодолеть барьер. Еа – избыточная энергия, которую нужно придать 1 молю смеси чтобы все ударения стали результативны. 10 -100 кдж/моль.
Энергия активации- избыточная эн. которой должны обладать молекулы для того чтобы их столкновение могло привести к обр.нового в-ва. Реакции требующие для своего протекания заметной эн. активации начинаются с разрыва или с ослабления связи между атомами между молекулами исходных в-в. При этом в-ва переходят в неустойчивое промежуточное состояние характеризующееся большим запасом эн. Это состояние наз.активированным комплексом. Механизм протекания реакции реакция протекает с выделением или поглощением эн. Эта эн. выделяется или поглощается в виде теплоты. При хим.превращениях освобождается часть содерж.в в-вах эн. Измеряя кол-во теплоты выделяющееся при реакции(тепловой эффект)мы можем судить о изменении этого запаса.
Катализ – ускорение или замедление реакции под воздействием катализатора. Катализ положительный- ускоряет хим.реакцию, отрицательный-замедляет. Катализатор способен понижать энергию активации (Еа). : 1)А+В→АВ (U) 2)А+ кат→Акат (V₁) 3)В+Акат→АВ+кат. (V₂) V₁+V₂→U. Виды: гомогенный – однородный, все в одном агрегатном состоянии; гетерогенный – неоднородный. Теория гетероген.: на катализаторе есть активные участки – каталитические ядра, создаваемые удачное пространство строения реагирующих в-в : CO+2H₂→Cu→CH₃OH;CO+H₂→Ni→CH₄.
Ферментативный катализ; ур-е михаэлиса. Большинство хим.реакций протекающих в пищеварительной системе, в крови и клетках животных и человека является каталитическими реакциями. Катализаторы в этом случае явл.- ферменты(простые и сложные белки)– энзимы(каталаза способная понижать энергию распада H2O2 от70кдж/моль до 7 кдж/моль.) : S –субстрат; Е – энзим; Р – продукт: [s]+[E]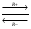  (R+-1)[sE] (R+-1)[sE]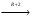 [P]+[E]. v=v max· - уравнение михаелиса ментена; - константа михиэлиса. [P]+[E]. v=v max· - уравнение михаелиса ментена; - константа михиэлиса.
Обратимые процессы. Условия смещения равновесия. Ле шателье: Внешние воздействия на систему находящейся в состоянии равновесия приводит к смещению того равновесия в направлении, при котором эффект приобретенного воздействия ослабляется. 1) измерение концентрации: при увеличении концентрации одного из реагирующих вещ-в, равновесие смещается в сторону прямой реакции, а при уменьшении концентрации реагирующих вещ-в будет идти обратная реакция. 2) изменение температуры. При повышении Т равновесие смещается в сторону эндоермич. реакции, а при понижении т в сторону экзотермич. реакции. 3) Изменение давления. При повыш. давления равновесие смещается в сторону газообразных вещ-в,( т.е. уменьшение объема) , А при уменьшении давл. равн. Смещается в сторону увеличения газообр. В-в.
?Окислители и восст. Прост. И сложные в-ва. Процессы окисления и восстановления. Окислитель- принимает Е, понижает СО(галогены О2 О3 KMnO4 K2Cr2O7 H2SO4 HNO3). Восстановитель – отдает Е, повышает с.о.(Me CO H2S H2SO3 HCl FeS4) окисление – процесс отдачи Е. Восстановление – процесс принятия Е. Простые из атомов 1 хим.элем. сложные из атомов разных хим.элем.
Типы ок- вост. Реакций. 4 типа О-В реакций: 1) межмолекулярные – О. и В. Входят в состав разных веществ: Н₂+CuO→Cu+H₂O . 2) внутримолекулярные – О. и В. Разные но входят в состав одного вещества: 2NaNO₃→2NaNO₂+O₂. 3)диспропорционирования – один и тот же элемент является и О. и В.: Cl₂+H₂O→Cl+HClO. 4) конмутация- из разных веществ в одно. S+2H₂SO₄→3SO₂+2H₂O
Сильные окислительные свойства KMnO₄ объясняются эо его атома. Окислители могут быть те соединения металлов в которых со велика (+7). KMnO₄ (в кислой Mn+2 )KMnO₄ (в щелочной K2 MnO4) KMnO₄ (в нейтральной MnO2 ).Раствор KMnO₄ в медицине применяется в качестве антисептика, при обработке ран.
Окислительно восстановительная двойственность - способность вещества вступать в реакции как с окислителем, так и с восстановителем.1)H₂O₂+2H⁺+2ê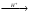 2H₂O; 2)H₂O₂+2ê 2H₂O; 2)H₂O₂+2ê 2OHˉ 3) H₂O₂ - 2e→ O₂+2H+-вос-ль в реакциях с более сильными ок-лями (KMnO₄ (NH4)2S2O8). H₂O₂ в медицине применяется как антисептик,при обработке ран. H₂O₂ в организме расщепляется под действием фермента пероксидазы. 2OHˉ 3) H₂O₂ - 2e→ O₂+2H+-вос-ль в реакциях с более сильными ок-лями (KMnO₄ (NH4)2S2O8). H₂O₂ в медицине применяется как антисептик,при обработке ран. H₂O₂ в организме расщепляется под действием фермента пероксидазы.
Метод полуреакций. KMnO₄ в разных средах. Реакции с K₂Cr₂O₇. 1.1)2KMnO₄+5KNO₂+3H₂SO₄→2MnSO₄+K₂SO₄+5KNO₃+3H₂O 1.2) MnO₄⁻+8H⁺+5e→Mn⁺²+4H₂O (*2) 1.3)NO₂⁻+H₂O-2e→NO₃⁻+2H⁺ (*5) 1.4) 2MnO₄⁻+16H⁺+5NO₂⁻+5H₂O→2Mn⁺²+8H₂O+5NO₃⁻+10H⁺ 2.1)2KMnO₄+KN0₂+2KOH→2K₂Mn0₄+KN0₃+H₂0 2.2)K⁺+Mn0₄⁻+K⁺+OH⁻→2K⁺+Mn0₄²⁻+K⁺+N0₃⁻+H₂O 2.3)Mn0₄⁻+1e→Mn0₄²⁻ (*2) 2.4)NO₂⁻+2OH⁻-2e→N0₃⁻+H₂O (*1) 2.5)2MnO₄+N0₂⁻+2OH⁻→2MnO₄⁻+NO₃⁻+H₂O 3.1) 2KMnO₄+3KN0₂+H₂O→2MnO₂+3KN0₃+2KOH 3.2)MnO₄⁻+2H₂O+3e→MnO₂⁰+4OH⁻ (*2) 3.3) NO₂⁻+H₂O-2e→NO₃⁻+2H⁺ (*3) 3.3) 2MnO₄+4H₂O+3NO₂⁻+3H₂O→2MnO₂⁰+2OH⁻+33NO₃⁻+6H⁺ 4.1)K₂Cr₂O₇+6KJ+7H₂SO₄→3J₂+Cr₂(SO₄)₃+4K₂SO₄+7H₂O 4.2)2J⁻-2e→J₂⁰ (*3) 4.3)Cr₂O₇²⁻+14H⁺+6e→2Cr₂³⁺+7H₂O (*1) 4.4)6J⁻+ Cr₂O₇+14 Н⁺→3J₂⁰+2Cr³⁺+7H₂O 5) K₂Cr₂O₇+ K₂S+H₂O→S+Cr(OH)₃+KOH 6) K₂Cr₂O₇+10 KOH+3SO₂+H₂O→2K³[Cr(OH)₆]+3K₂SO₄
ОВ потенциалы. Определение направления протекания реакции. ОВП – мера способности вещества присоединять электроны. Направление овп можно определить: 1) по величине овп (реакция идет в сторону более слабого окислителя.2) по изменению энергии Гибса : ∆G≠O - самопроизвольное протекание; ∆G>O – самопрот. Невозможно; ∆G=O – химическое равновесие. 3) степ. Протекания можно определить с помощью ∆G=-RTInk.
?При составлении ОВР необходимо учитывать , что характер (кислотность) среды может оказывать сильное влияние на течение ОВР и на ее продукты. Например перманганат ион в кислой среде восстанавливается до Mn²⁺, а в нейтральной среде он восстанавливается до MnO₂, а в щелочной восстановление идет до иона MnO₄²¯, т.е. в щелочной среде Mn способен принять только один электрон, восстанавливаясь от +7 до +6. Очень важно учитывать, в какой среде проводится ОВР, если в ней участвует H₂O₂, который может проявлять как окислительные, так и восстановительные свойства. В некоторых случаях изменение характера среды может привести к изменению направления реакции на противоположное: 3I₂+3H₂О щелочная среда→←кислая среда HIO₃+5HI.
?Определение эквивалентов окислителей и вост. Влияние среды. - молярная масса эквивалента (гр/моль). – фактор эквивалентности. = для ОВР Z=е (электронов) отданных /принятых. Э = ; - восстанов. стандарт ОВП. Чем больше потенциал, тем сильнее окислитель.Чем меньше потенциал, тем сильней восстановитель.Разность потенциалов о. и в. Называется электродвижущей силой. (ЭДС). E̊=φ̊ок-φ̊вост.
ОВП в биологии и медицине. В организме человека 5гр. Железа. Большая его часть содержится в гемоглобине крови (70%). В связанной форме оно содержится в некоторых белках, которые выполняют в организме роль переносчиков железа.В митохондриях окисление происходит в результате переноса электронов от органических субстратов – интермедиатов на элементарный кислород который при этом восстанавливается до воды.1/2 О2+2Н⁺+2ê→H₂O. В дыхательную сеть митохондрий входят различные белки содержащие разнообразные функциональные группы, которые предназначены для переноса электронов.
См 19
См 18
Основные положения координационной теории Вернера. Согласно коорд.теор. в молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, занимает центральное место и называется комплексообразователем или центральным ионом. Вокруг него в непосредственной близости расположено(координировано) некоторое число противоположно заряженных ионов или электронейтральных молекул, называемых лигандами (аддендами) и образующих внутреннюю координационную сферу соединения. Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешнюю координационную сферу. Число лигандов, окружающих центральный ион. Называется координационным числом.
Спектрохимический ряд лигандов. По величине энергии расщепления лиганды располагаются в следующем порядке: СО,CN¯ (сильное поле)>этилендиамин(Еn)>NH₃>SCN¯(среднее поле)>H₂O>OH¯>F¯>CL¯>Br¯>I¯(слабое поле) . В начале этого поля находятся лиганды создающие сильное поле, в конце – создающие слабое поле. Электроны центрального иона распределяются по d орбиталям так, чтобы образовалась система с минимальной энергией. Это может быть достигнуто двумя способами: размещением электронов на dе орбиталях, отвечающих более низкой энергии, или равномерным распределением их по всем d орбиталям в соответствии с правилом Хунда.
? Устойчивость комплексных соединений. Частицы , находящиеся во внешней сфере, Связаны с комплексным ионом преимущественно электростатическими силами и легко отщепляются в водном растворе. Эта диссоциация называется первичной , она протекает почти нацело, по типу диссоциации сильных электролитов. Лиганды, находящиеся по внутренней сфере, связаны с центральным атомом значительно прочнее и отщепляются лишь в незначительной степени. Обратимый распад внутренней сферы к.с. носит название вторичной диссоциации. Она характеризуется наличием равновесия между комплексной частицей, центральным ионом и лигандами.
?
Адсорбцией называется изменение концентрации вещества на границе раздела фаз. На поверхности жидкости создается пленка которая обладает аномальными свойствами. Поверхностное натяжение растворов зависит от природы растворителя и растворенного вещества, от концентрации последнего и от температуры. Зависимость пов. Нат. Растворов при постоянной температуре от концентрации растворенного вещества называется изотермой поверхностного натяжения. Растворенные вещества понижают поверхностное натяжение растворителя, в таком случае их называют поверхностно активными веществами, если понижают поверхностное натяжение – поверхностно неактивными веществами. ПАВ- активные полярные органические соединения ( спирты, амины. Кислоты, фенолы). Пов.Неак.Вещ. большинство сильных электролитов.
Адсорбционное равновесие, т.е. равномерное распределение вещества между пограничным слоем и граничащими фазами, является динамическим равновесием и быстро устанавливается. Адсорбция уменьшается с повышением температуры.
Хемосорбция – химическая реакция, поглощение одного вещества другим.(адсорбат вступает в химическую связь с адсорбентом). Адсорбция – изотермический процесс. При физическое адсорбции выделяется энергия от 4 до 40. Адсорбция жидкости имеет свои особенности: на некотором активном центре адсорбируется сам растворитель, но могут адсорбироваться и ионы. Адсорбцию в случае . когда требуется подчеркнуть природу сил взаимодействия, называют физической адсорбцией.
Адсорбция газов на твердых телах. Отличия : У жидкости поверхность однородна, а у твердых тел неоднородна. Уравнение Ленгмюра является одной из форм уравнения изотермы адсорбции. Под уравнением изотермы адсорбции ( чаще говорят – изотерма адсорбции) понимают зависимость равновесной величины адсорбции от концентрации адсорбтива а=f(С) при при постоянной температуре. Концентрация адсорбтива для случая адсорбции жидкости выражается , как правило, в мольных либо в массовых долях. Часто, особенно в случае адсорбции из растворов, пользуются относительной величиной: С\Сs, где С концентрация, Сs – предельная концентрация (конц. Насыщения) адсорбтива при данной температуре. В случае адсорбции из газовой фазы концентрация может быть выражена в единицах абсолютного давления, либо, что особенно типично для адсорбции паров, в относительных единицах: Р\Рs, где Р давление пара, Рs – давление насыщенных паров этого вещества. Саму величину адсорбции можно выразить также в единицах концентрации ( отношение числа молекул адсорбата к общему числу молекул на границе раздела фаз). Для адсорбции на твердых адсорбентах, особенно при рассмотрении практических задач, используют отношение массы или количества поглощенного вещества к массе адсорбента, например мг\г или моль\г. В изотерме наблюдается точное совпадение расчета данных только в области среднего значения концентрации. Высокое и низкое С-отклонение. Адсорбция газов и паров на поверхности твердых тел также происходит в результате уменьшения свободной поверхностной энергии. Ввиду трудности измерения поверхностного натяжения твердых тел, об абсорбции на них судят, непосредственно определяя количество адсорбированного вещества. Последнее тем больше. Чем больше поверхность адсорбента. Поэтому для осуществления адсорбционных процессов весьма важно создание высокопористых адсорбентов с развитой внутренней поверхностью, т.е. поверхностью, приходящейся на 1 г сорбента. Важнейшим пористым сорбентом является активный уголь и силикагель. Ленгмюр в своем уравнении выводил предпосылки: 1) на поверхности твердого адсорбента имеется какое то определенное конечное количество активных центров 2) на каждом центре можно менять только одну молекулу 3) молекулы, находящиеся в неактивных центрах, между собой не взаимодействуют 4) время удержания молекулы на активном центре - невечно.
Быстро развивающаяся область применения адсорбционной техники – медицина, где она служит для извлечения вредных веществ из крови (метод гемосорбции) и др. физиол. Жидкостей. Высокие требования к стерильности ставят очень трудную задачу подбора подходящих адсорбентов. К ним относятся специально приготовленные активные угли. Правило Дюно – траута. С увеличением УВ радикала на группу СН2 способность понижать поверхностное натяжение увеличивается в 3 раза.
Строение коллоидной мицеллы. АgNO₃+KJ(изб)>АgJ⤓+KNO₃ {m[АgJ]·nJ¯·(n-x)k⁺·XK⁺ ([АgJ]- агрегат; nJ¯ - потенциал определяющий ионы; k⁺ -адсорбционный слой противоиона; XK⁺ -диффузионный слой противоиона; {m[АgJ]·nJ¯·(n-x)k⁺ -гранула). Правило Пенета-Фаянса – на твердом агрегате адсорбируется тот ион, который входит уже в его состав. Свойства КС: прозрачные, фильтруются, не проходят через пергамент, гетерогенные, дают конус Тендаля, относительно устойчивы, со временем стареют. Частицы различных тканей животных и растительных организмов обуславливают разнообразие их свойств. Коллоидные вещества могут связывать большие количества Н2О, а также соединятся с самыми разнообразными веществами. Адсорбция имеет важное значение при обмене веществ, процессе пищеварения, и воздействия лекарственных веществ. Оптические свойства коллоидных систем. Закон рассеивания света, согласно которому интенсивность рассеянного света прямо пропорционально квадрату объема частиц и обратно пропорционально четвертой степени длины волны падающего света. I=I₀K . Окраска золей. Рассеяние света в коллоидных системах и наблюдающиеся при этом изменение окраски коллоида называются опалесценцией. Коллоидные частицы имеющие диаметр меньше половины длины световой волны, не могут быть видимы в обычные микроскоп – создали утрамикроскопию. Электронный микроскоп позволяет видеть микробы, фаги, вирусы, структурные элементы клеток.
Устойчивость дисперсных систем. Соединения, коагуляция, порог коагуляции. Правило шульц-гарди. Коагуляция – слияние или слипание частиц дисперсной фазы. Факторы коагуляции: свет, температура, мех. воздействие, действие электронов – основной фактор. Порог коагуляции – такая концентрация электронов которая вызывает явную коагуляцию. = . Процесс оседания коллоидных частиц в растворе называется седиментацией. Высокодисперсные системы обладают большой кинетической устойчивостью и, наоборот, грубодисперсные неустойчивы ,т.к частицы практически не могут осуществить тепловое движение.
Коллоидные ПАВ. Биолог. Важные кол. ПАВ. Коллоидные ПАВ – вещества, которые с одним и тем же растворителем в зависимости от условий образуют истинный и коллоидный раствор. Процесс образования мицелл в растворах коллоидных ПАВ термодинамически выгоден. Константы между одинаковыми неполярными группами приводят к уменьшению энергии Гиббса приблизительно на 2 кдж\моль по сравнению с константами полярных и неполярных групп. Ядро образовавшихся мицелл составляют неполярные радикалы, а внешнюю обкладку – полярные группы, что обеспечивает наименьший контакт гидрофобных групп с водой. Форма образовавшихся мицелл зависит от концентрации раствора при небольших концентрациях коллоидного ПАВ образуются сферические мицеллы. При более высокой концентрации сферических мицелл образуются цилиндрические и пластинчатые.
Классификация дисперсных систем. По степени дисперсности различают две группы систем: грубодисперс. и коллоидно - дисперсные. Системы со слабым взаимодействием между фазой и средой лиофальными коллоидами (золи). С сильным взаимодействием лиофильными. Таблица- среда –фаза - система(назв): газ газ не сущ; газ жид. туман; газ тв. дым (пыль); жидкость газ пена; жидкость жид. эмульсоид; жидкость тв.тело суспензоид; тв. тело газ пемза; тв. тело жидкость тв. эмульсоид; тв. +тв. сплав.
Получение и свойства дисперсных систем. Для получения коллоидных растворов необходимо: 1) достичь коллоидной степени дисперсности; 2) подобрать дисперсионную среду, в которой нерастворимо в-во, дисперсионной фазы; 3) подобрать третий компонент – стабилизатор сообщающий коллоидной системе устойчивость. Образовать коллоидные растворы в воде могут металлы, малорастворимые в ней оксиды, гидроксиды, кислота, соли. В качестве стабилизатора используют вещества, препятствующие агрегации коллоидных частиц в более крупные и выпадение их в осадок. По способу достижения коллоидной степени дисперсности различают методы : диспергационные – получение частиц дисперсионной фазы путем дробления более крупных частиц, и конденсационные – получение частиц дисперсной фазы путем объединения атомов, молекул, ионов.
Свойства растворов ВМС. Системы термодинамически устойчивые, не имеют четко выраженной поверхности раздела с растворителем. Устойчивость растворов в большей степени связана с наличием сольватной оболочки. Вязкость растворов значительна и резко возрастает с увеличением концентрации. Сухое вещество набухает и может переходить в растворенное состояние. Значительная часть водной оболочки удерживается за счет полярных групп соприкасается в изоэлектрической точке. Значение Рн, при котором белок находится в изоэлектрическом состоянии. Т.е. в состоянии, при котором число разноименных зарядов в белковой частицы одинаково и ее общий заряд равен нулю, называется изоэлектрической точкой данного белка.
Хроматография. 1) Хр. Представляет собой динамический метод анализа, основанный на многократно повторяющихся процессах сорбции и десорбции. Обязательным условием для проведения хроматографии является наличие двух фаз: неподвижной и подвижной. В результате того, что различные вещества перемещаются вдоль стационарной фазы с разной скоростью, происходит их разделение. 2) хроматографией называют группу методов разделения газов. Жидкостей или растворенных веществ. Основанных на процессах сорбции в динамических условиях. В простейших видах эти условия осуществляются при прохождении потока смеси через колонну, наполненную сорбентом. В следствии различной сорбируемости компонентов смеси происходит их разделение по длине колонки. Хроматографические методы различают по следующим признакам: а) по средам, в которых производится разделение; б) по механизму разделения; в)по форме проведения процесса. В сочетании с методами радиоактивных индикаторов, люминисценции и др. хроматограф. Анализов является одним из важнейших в современной науке, и очень широко применяемым для исследований в биологии, медицине. В настоящее время хроматографический анализ биологических жидкостей успешно служит для диагностики разнообразных заболеваний. Также с помощью хр. Производится анализ крови на присутствие в ней алкоголя, наркотиков. летучих веществ. Хроматография применяется для допинг контроля у спортсменов.
|
 Скачать 1.22 Mb.
Скачать 1.22 Mb.
