воспол. Причины воспаления
 Скачать 0.52 Mb. Скачать 0.52 Mb.
|
|
ВОСПАЛЕНИЕ - Типовой патологический процесс. Возникает в ответ на действие патогенного (флогогенного) фактора. Характеризуется развитием как патогенных, так и адаптивных реакций организма. Направлен на локализацию, уничтожение и удаление из организма флогогенного фактора, а также на восстановление поврежденной ткани. Этиология: Воспаление – результат воздействия на организм патогенных факторов различного генеза (причин воспаления) в определенных условиях. ПРИЧИНЫ ВОСПАЛЕНИЯ  Физические факторы. Наиболее часто это: механическая травма тканей, чрезмерно высокая или низкая температура, воздействие электрического тока или лучистой энергии, внедрение в ткань инородного тела и т.п Химические факторы. Это экзо- и эндогенные органические или неорганические кислоты и щелочи в высоких концентрациях; избыток в тканях органических соединений: продуктов метаболизма, экскретов, компонентов биологических жидкостей (молочной, пировиноградной и других кислот, а также их солей; жёлчи; мочи; мочевины; солей кальция и др.); ЛС, вводимые в ткани (в частности — гипертонические растворы хлористого кальция, хлорида калия, натрия, карбонатов; камфора; некоторые витамины) и др Биологические агенты. Одна из наиболее распространённых причин воспаления: инфекционные (вирусы, риккетсии, бактерии, а также одно-и многоклеточные паразиты, грибы); иммуноаллергические (комплексы Аг-АТ; антигенно- и генетически чужеродные структуры, например, денатурированные белки или погибшие участки ткани; инфицированные вирусом или опухолевые клетки; аутоантитела); токсины насекомых, животных, растений. Экзогенные причины воспаления. Наиболее частыми причинами воспаления являются биологические агенты: паразиты; микроорганизмы (бактерии, риккетсии, вирусы); патогенные грибы; токсины и яды растений, насекомых и животных; чужеродная плазма, сыворотка (например, при вакцинации) или цельная кровь; компоненты некротизированных клеток; трансплантаты аллогенных тканей или органов. Эндогенные причины воспаления. Чаще всего представляют собой биологические агенты (продукты деструкции повреждённых или погибших тканей, например, в результате их ушиба, ожога, отморожения или нарушения кровотока в них; активировавшаяся условно-патогенная микрофлора; иммуноаллергические комплексы «Аг+АТ+комплемент» и др.); эндогенные химические вещества (в частности – продукты нормального или нарушенного метаболизма, если они не выводятся из организма с экскретами; избыток продуктов липопероксидных реакций). Так, при почечной недостаточности в некоторых тканях накапливается мочевая кислота и её соли, мочевина и другие продукты азотистого обмена, что сопровождается развитием воспаления – возникают бронхиты, пневмонии, гастриты, энтероколиты, дерматиты. При нарушении функции печени, расстройстве обмена жёлчных пигментов, последние, а также другие компоненты жёлчи, могут в избытке накапливаться в различных тканях, приводя к развитию в них воспаления. УСЛОВИЯ, ВЛИЯЮЩИЕ НА ВОЗНИКНОВЕНИЕ И ОСОБЕННОСТИ РАЗВИТИЯ ВОСПАЛЕНИЯ. Реактивность организма и регионарные особенности тканей РЕАКТИВНОСТЬ ОРГАНИЗМА Реактивность организма может быть нормальной, повышенной и сниженной. Нормальная реактивность организма характеризуется адекватными выраженностью, масштабом и другими особенностями течения воспаления флогогенному фактору. В этом случае говорят о нормергическом течении воспаления. Повышенная или качественно изменённая реактивность организма (например, при его сенсибилизации аллергеном) проявляется чрезмерной воспалительной реакцией со значительным повреждением ткани или органа. Такой характер воспаления обозначают как гиперергический. Сниженная реактивность организма (например, у детей первых месяцев и лет жизни; у лиц, перенесших хронические заболевания; у людей преклонного возраста) характеризуется незначительно выраженным воспалением. В таком случае его называют гипоергическим РЕГИОНАРНЫЕ ОСОБЕННОСТИ ВОСПАЛЕНИЯ Регионарные особенности тканей или органов, подвергшихся воздействию флогогенного агента, важны для возникновения и характера развития воспаления. Так, хроническая локальная травматизация тканей, дистрофические процессы, нарушения кровообращения, пониженная активность механизмов иммунной и неиммунной резистентности облегчают реализацию действия патогенного фактора и нередко усугубляют повреждение тканей в очаге воспаления. МЕХАНИЗМ РАЗВИТИЯ ВОСПАЛЕНИЯ КОМПОНЕНТЫ ВОСПАЛЕНИЯ преимущественно альтеративные изменения в очаге воспаления закономерно сменяются преимущественно экссудативными и далее – преимущественно пролиферативными Наиболее значимыми компонентами механизма развития: альтерация, – сосудистые реакции и изменения крово- и лимфообращения, – экссудация, – эмиграция лейкоцитов и выход других форменных элементов крови в ткань, – фагоцитоз, – пролиферация АЛЬТЕРАЦИЯ - первое и непосредственное следствие повреждающего действия флогогенного фактора и инициальное звено механизма развития воспаления.  ЗОНА ПЕРВИЧНОЙ АЛЬТЕРАЦИИ Причиной формирования этой зоны является флогогенный фактор, действующий на ткань. Локализуется она в месте прямого контакта причины воспаления с тканью (эта зона — эпицентр очага воспаления). Основными механизмами повреждения тканей в зоне первичной альтерации являются:– расстройства энергетического обеспечения функций и пластических процессов в повреждённой ткани; – изменение мембран и ферментов клеток, а также структур межклеточного вещества; – нарушение трансмембранного переноса и градиента ионов, соотношения их между собой, содержания жидкости внутри и за пределами клетки и в зоне альтерации в целом; – расстройства регуляции в очаге воспаления. Проявляется воспаление в зоне первичной альтерации – нарушением функций повреждённых, но ещё жизнеспособных участков ткани вне зоны некроза; – некрозом избыточно поврежденных тканей; –. значительными физико-химическими изменениями; – .различными формами дистрофии. Время начала развития вышеуказанных изменений колеблется в широком диапазоне и определяется особенностями флогогенного фактора, состоянием ткани или органа, подвергшегося его воздействию; реактивностью организма. Тем не менее, первые изменения выявляются сразу после воздействия причины воспаления на ткань. ЗОНА ВТОРИЧНОЙ АЛЬТЕРАЦИИ Причинами формирования зоны вторичной альтерации являются: 1) воздействие флогогенного агента (хотя за пределами эпицентра очага воспаления эффективность его значительно ниже); 2) влияние факторов, вторично формирующихся в зоне первичной альтерации в связи с образованием медиаторов воспаления, развитием метаболических, физико-химических и дистрофических изменений. Локализуется зона вторичной альтерации частично в месте контакта флогогенного агента с тканью (там, где сила его воздействия была максимальной), но в основном — вокруг области первичной альтерации. Обычно площадь этой зоны значительно больше площади первичной. Механизмы развития зоны вторичной альтерации включают: 1) расстройства местной нервной регуляции (в связи с повреждением тел нейронов, нервных стволов и/или их окончаний, синтеза и накопления нейромедиаторов); 2) нарушение высвобождения нейромедиаторов (норадреналина, ацетилхолина и др.) симпатической и парасимпатической системы в очаге воспаления и стадийные изменения чувствительности тканей к ним в этом очаге; 3) расстройства аксонного транспорта трофических и пластических факторов (углеводов, липидов, белков, адениннуклеотидов, нуклеиновых кислот, БАВ, ионов и других агентов) от тел нейронов к соматическим клеткам; 4) стадийные изменения тонуса сосудов микроциркуляторного русла и в связи с этим — расстройства кровообращения в зоне вторичной альтерации очага воспаления; 5) реализацию эффектов БАВ, поступающих из зоны первичной альтерации, а также образующихсяся за пределами очага воспаления. Проявляется воспаление в зоне вторичной альтерации характерными для нее изменениями: структуры клеток и межклеточного вещества расстройствами метаболизма отклонениями физико-химических параметров Время начала формирования изменений в зоне вторичной альтерации несколько более позднее (на секунды–минуты), чем формирование зоны первичной альтерации. Интенсивность формирования различных зон альтерации, выраженность изменений в них и соотношение их размеров существенно различаются и в каждом конкретном случае зависят от причины воспаления, структурных и функциональных особенностей ткани или органа, в котором развивается воспаление, реактивности организма и других условий. СТРУКТУРНЫЕ ИЗМЕНЕНИЯ Причина изменения структуры клеток и других гистологических элементов в очаге воспаление в течение первых минут после повреждения – прямое действие флогогенного агента. На более поздних этапах, дополнительно к прямому эффекту флогогена присоединяется влияние вторичных факторов: метаболических, физико-химических, микроциркуляторных и регуляторных расстройств. Основными механизмами морфологических изменений в очаге воспаления являются: – нарушение энергетического обеспечения клеток; – повреждение их мембран и ферментов; – дисбаланс ионов и воды; – нарушения местных (клеточных и органно-тканевых) механизмов регуляции. Проявления изменений в тканях весьма разнообразны: от минимальных структурных отклонений до деструкции и некроза ткани. Структурные изменения наблюдаются как в клетках, так и в строме тканей и органов. ИЗМЕНЕНИЯ ОБМЕНА ВЕЩЕСТВ В очаге воспаления наблюдаются закономерные фазные изменения метаболизма. Причины их: действие флогогенного фактора и вторичные расстройства в ткани, выражающиеся в перестройке местных механизмов нервной и гуморальной регуляции, микроциркуляции, в формировании физико-химических сдвигов. УГЛЕВОДНЫЙ ОБМЕН В очаге воспаления метаболизм углеводов претерпевает характерные изменения, выражающиеся в преобладании гликолиза и развитии ацидоза. Причины этих изменений: – действие флогогенного агента и других факторов, активирующихся или образующихся в ходе воспалительной реакции. Они вторично, повреждают мембраны и ферменты митохондрий. К этим факторам относятся: – свободные радикалы, перекисные соединения, вещества с детергентным действием 226 (ВЖК, гидроперекиси липидов), гидролазы лизосом, избыток Н+ и других агентов; – избыток ионов Ca2+, оказывающих (наряду с жирными кислотами) существенное разобщающее действие на процесс окислительного фосфорилирования; – увеличение в клетках уровня АДФ, АМФ и неорганического фосфата, что активирует ключевые ферменты гликогенолиза и гликолиза. В связи с этим в очаге воспаления начинает возрастать удельный вес гликолитического ресинтеза АТФ. Проявляется нарушение углеводного обмена в очаге воспаления увеличением поглощения тканью кислорода при одновременном снижении эффективности окисления глюкозы в процессе тканевого дыхания; активацией гликогенолиза и гликолиза; уменьшением уровня АТФ в ткани; накоплением избытка лактата и пирувата. Последствия расстройств метаболизма углеводов. Образующаяся в процессе гликолиза АТФ, хотя и в недостаточной мере, но тем не менее поддерживает энергозависимые процессы в клетках, особенно – транспорта ионов и сокращения мышц, сохранения жизнеспособности и жизнедеятельности гистологических элементов в очаге воспаления. ЛИПИДНЫЙ ОБМЕН Обмен липидов в очаге воспаления характеризуется доминированием липолиза над реакциями их синтеза. Причина этого – прямое повреждение ткани флогогенным агентом, что приводит к ферментативной и неферментативной деструкции мембранных фосфолипидов, ЛП, гликолипидов и других липидсодержащих соединений с высвобождением из них ВЖК, свободных липидов и образованием кетокислот. Основной механизмом липолиза в очаге воспаления — интенсификация гидролиза липидов и их комплексов с другими веществами в результате повышенного высвобождения липаз и фосфолипаз из повреждённых клеток, а также – из лейкоцитов, в большом количестве накапливающихся в очаге воспаления. Проявляются расстройства липидного обмена активацией липолиза, накоплением избытка его продуктов, торможением реакций синтеза липидов, активацией перекисного окисления липидов, накоплением их перекисей и гидроперекисей в очаге воспаления. 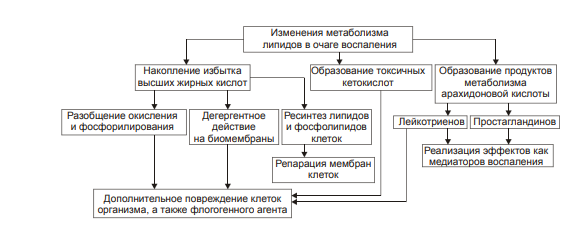 БЕЛКОВЫЙ ОБМЕН 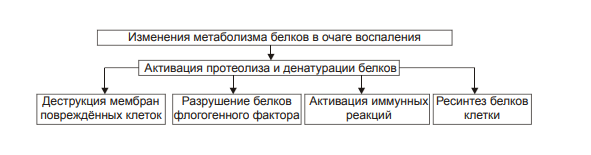 ОБМЕН ИОНОВ И ВОДА Для ионов характерен их трансмембранный дисбаланс, увеличение внутриклеточного содержания Na+ и Ca2+ и внеклеточного содержания K + и Mg2+. Характерны гипергидратация клеток и отёк ткани в очаге воспаления. Главными причинами этого являются прямое повреждающее действие флогогенного агента на мембраны клеток, нарушения 231 энергетического обеспечения селективного переноса катионов, расстройства работы ионообменных механизмов (Н+ -Ca2+, Na+ -Ca2+ , H + -K + ), снижение кинетической активности катион-зависимых мембранных АТФаз (Na+ ,K+ -АТФазы, Ca2+,Mg2+ -АТФазы), нарушения физико-химического состояния и микроструктуры клеточных мембран. Проявляется дисбаланс ионов и жидкости нарушениями распределения ионов по обе стороны плазмолеммы. Основными последствиями дисбаланса ионов и жидкости в очаге воспаления являются: – значительное увеличение осмотического давления внутри клеток, набухание их и их органелл, перерастяжение и разрыв мембран и в конце концов – гибель клеток; – расстройства формирования МП и ПД, стойкая деполяризация мембран возбудимых клеток (в особенности кардиомиоцитов), сочетающаяся со снижением их функций и болевой чувствительности в центре очага воспаления (в зоне первичной альтерации). ФИЗИКО-ХИМИЧЕСКИЕ ИЗМЕНЕНИЯ 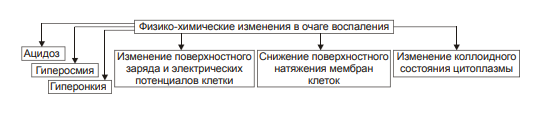 АЦИДОЗ Воспаление характеризуется увеличением [Н+ ] и, соответственно, снижением рН в клетках и межклеточной жидкости – развитием ацидоза. Причина Причина метаболического ацидоза – накопление в очаге воспаления избытка недоокисленных соединений. Механизмы накопления «кислых» метаболитов различны. Они заключаются в образовании большого количества продуктов изменённого метаболизма вследствие: – активации гликолиза, что сопровождается накоплением молочной и пировиноградной кислот; – усиления протеолиза и липолиза с образованием аминокислот, ВЖК и кетоновых тел; – нарушения оттока от очага воспаления продуктов как нормального, так и нарушенного обмена веществ. Последнее особенно выражено в связи с замедлением оттока венозной крови и развитием стаза в очаге воспаления; –«истощения» щелочных буферных систем (бикарбонатной, фосфатной, белковой и других) клеток и межклеточной жидкости, которые на начальном этапе воспаления нейтрализуют избыток кислых соединений. Последствия ацидоза  ГИПЕРОСМИЯ В очаге воспаления закономерно, в большей или меньшей мере, повышается осмотическое давление. Причинами гиперосмии являются: – повышенное ферментативное и неферментное разрушение макромолекул (гликогена, гликозаминогликанов, протеогликанов и других); – усиленный в условиях ацидоза гидролиз солей и соединений, содержащих неорганические вещества; – поступление осмотически активных соединений из повреждённых и разрушенных клеток. Гиперосмия обусловливает: –гипергидратацию в очаге воспаления; – повышение проницаемости сосудистых стенок; – стимуляцию эмиграции в зону воспаления лейкоцитов; – изменение тонуса стенок сосудов и кровообращения ; – формирование чувства боли. ГИПЕРОНКИЯ Увеличение онкотического давления в воспалённой ткани – закономерный феномен. Причинами гиперонкии являются: – увеличение концентрации белка в очаге воспаления в связи с усилением ферментативного и неферментного гидролиза пептидов; – повышение гидрофильности белковых мицелл и других коллоидов в результате изменения их конформации при взаимодействия с ионами; – выход белков (в основном — альбуминов) из крови в очаг воспаления в связи с повышением проницаемости стенок микрососудов. Основное последствие гиперонкии в очаге воспаления это развитие отёка МЕДИАТОРЫ ВОСПАЛЕНИЯ МЕДИАТОРЫ ВОСПАЛЕНИЯ — БАВ, образующиеся при воспалении, обеспечивающие закономерный характер его развития и исходов, формирование его местных и общих признаков.  Клеточные медиаторы высвобождаются в очаге воспаления уже в активированном состоянии непосредственно из клеток, в которых они синтезировались и накопились. Плазменные медиаторы образуются в клетках и выделяются в межклеточную жидкость, лимфу и кровь, но в не активном состоянии, а в виде предшественников. Эти вещества активируются под действием различных промоторов преимущественно в плазме крови. Они становятся физиологически дееспособными и поступают в ткани КЛЕТОЧНЫЕ МЕДИАТОРЫ ВОСПАЛЕНИЯ 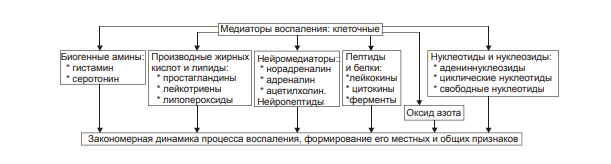 ПЛАЗМЕННЫЕ МЕДИАТОРЫ ВОСПАЛЕНИЯ 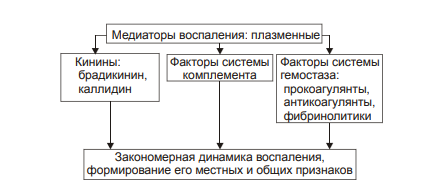 Медиаторы воспаления обусловливают развитие и/или регуляцию не только процессов альтерации (включая изменение обмена веществ, физико-химических параметров, структуры и функции), но и сосудистых реакций, экссудации жидкости и эмиграции клеток крови, фагоцитоза, пролиферации и репаративных процессов в очаге воспаления. В целом, альтерация, как инициальный этап и компонент воспалительного процесса, характеризуется развитием закономерных изменений метаболизма, физико-химических свойств, образованием и реализацией эффектов БАВ, отклонением от нормы структуры и функции тканей в очаге воспаления. СОСУДИСТЫЕ РЕАКЦИИ Понятие «сосудистые реакции» подразумевает изменения тонуса стенок сосудов, их просвета, крово- и лимфообращения в них, проницаемости сосудистых стенок для клеток и жидкой части крови.  При воспалении на разных стадиях сосудистых реакций происходят следующие важные и последовательные процессы: 1) Повышение тонуса стенок артериол и прекапилляров, сопровождающееся уменьшением их просвета и развитием ишемии. 2) Снижение тонуса стенок артериол, сочетающееся с увеличением их просвета, развитием артериальной гиперемии, усилением лимфообразования и лимфооттока. 3) Уменьшение просвета венул и лимфатических сосудов, нарушение оттока крови и лимфы по ним с развитием венозной гиперемии и застоя лимфы. 4) Дискоординированное изменение тонуса стенок артериол, венул, пре- и посткапилляров, лимфатических сосудов, сочетающееся с увеличением адгезии, агрегации и агглютинации форменных элементов крови, её сгущением и развитием стаза. ИШЕМИЯ Причина вазоконстрикции — высвобождение под влиянием альтерирующего фактора БАВ с сосудосуживающим эффектом: катехоламинов, тромбоксана А2, Пг. Преходящий характер вазоконстрикции и ишемии объясняется быстрой инактивацией 257 катехоламинов ферментами (главным образом, моноаминоксидазой), разрушением Пг в реакциях окисления. Значение ишемии состоит в локализации повреждающего влияния флогогенного агента и в препятствии его распространению за пределы очага непосредственного контакта с тканью. Проницаемость стенок микрососудов на этом этапе сосудистых реакций ещё не увеличена АРТЕРИАЛЬНАЯ ГИПЕРЕМИЯ Из механизмов, приводящих к развитию артериальной гиперемии, ведущее значение имеют нейрогенный, гуморальный и миопаралитический. Нейрогенный механизм (холинергический по своему существу) развития артериальной гиперемии характеризуется увеличением высвобождения парасимпатическими нервными окончаниями ацетилхолина и/или повышением чувствительности холинорецепторов к ацетилхолину. Это, как правило, наблюдается в условиях избытка внеклеточного содержания K+ и H + (что характерно для очага воспаления). Гуморальный компонент механизма развития артериальной гиперемии заключается в местном увеличении образования медиаторов с сосудорасширяющим действием: кининов, ПгЕ, ПгI, аденозина, оксида азота, гистамина. Миопаралитический механизм заключается в уменьшении базального тонуса артериол. Пролонгированный характер артериальной гиперемии, нередко наблюдающийся при воспалении, обусловлен избыточным синтезом указанных веществ, повышением чувствительности тканей в очаге воспаления к ним, замедленной инактивацией БАВ при воспалении, снижением базального тонуса артериол (так называемый миопаралитический эффект) ЗНАЧЕНИЕ И ПОСЛЕДСТВИЯ При артериальной гиперемии к тканям увеличивается приток кислорода, субстратов метаболизма и – в связи с этим – возрастает фильтрационное давление в прекапиллярах. Последнее в регионе артериальной гиперемии ведёт к некоторому повышению объёма межклеточной жидкости с низким содержанием белка (транссудата). Одновременно происходят активация обмена веществ и синтеза новых клеточных и неклеточных структур взамен повреждённых или погибших. В то же время чрезмерная и/или затянувшаяся артериальная гиперемия может создать условия для оттока из очага воспаления по венулам токсичных соединений, микроорганизмов, БАВ и попаданию их в общий кровоток. Длительное расширение артериол и прекапилляров может сочетаться также с постепенно нарастающим повышением проницаемости стенок микрососудов под влиянием медиаторов воспаления, образующихся в очаге воспаления. Жидкость и содержащиеся в ней белки из просвета микрососудов выходят во внесосудистое пространство – начинает образовываться экссудат. ВЕНОЗНАЯ ГИПЕРЕМИЯ ПРЕДСТАЗ Через некоторое время появляются периодические маятникообразные движения крови «вперёд – назад». Это является признаком перехода венозной гиперемии в состояние, предшествующее стазу (предстаз). Причина маятникообразного движения крови: в очаге воспаления возникает механическое препятствие оттоку крови по посткапиллярам, венулам и венам Основными причинами венозной гиперемии и предстаза являются: – сдавление венул экссудатом; – сужение просвета венул микротромбами, агрегатами форменных элементов крови, набухшими клетками эндотелия; – снижение тонуса стенок венул в результате уменьшения возбудимости их нервно-мышечных элементов, а также — повреждения их волокнистых структур и межклеточного вещества под действием флогогенного фактора, избытка медиаторов воспаления, в том числе ферментов (эластаз, коллагеназ, других гидролаз); – сгущение крови, повышение её вязкости и понижение, в связи с этим, текучести, что определяется повышенным выходом плазмы крови в ткань при экссудации; – скопление большого количества лейкоцитов у стенок посткапилляров и венул (феномен краевого стояния лейкоцитов) СТАЗ. Стаз характеризуется дискоординированным изменением тонуса стенок микрососудов и, как следствие – прекращением тока крови и лимфы в очаге воспаления. ЗНАЧЕНИЕ И ПОСЛЕДСТВИЯ ВЕНОЗНОЙ ГИПЕРЕМИИ И СТАЗА ПРИ ВОСПАЛЕНИИ Значение венозной гиперемии и стаза в очаге воспаления состоит в изоляции очага повреждения (благодаря препятствию оттоку крови и лимфы из него и, тем самым, содержащихся в них микробов, токсинов, продуктов метаболизма, ионов, БАВ и других агентов, способных повредить другие ткани и органы организма). При венозной гиперемии и стазе происходят дальнейшие расстройства специфической и неспецифической функций тканей, дистрофические и структурные изменения в них вплоть до некроза. Повышение проницаемости стенок микрососудов способствует образованию экссудата. ЭКССУДАЦИЯ ЭКССУДАТ - жидкость, выходящая из микрососудов, содержащая большое количество белка и, как правило, форменные элементы крови. Накапливается в тканях и/или полостях тела при воспалении. ПРИЧИНЫ ЭКССУДАЦИИ  ВИДЫ ЭКССУДАТА Серозный экссудат состоит из полупрозрачной жидкости, богатой белком (до 2–3%), и немногочисленных клеток, в том числе форменных элементов крови. Фибринозный экссудат содержит большое количество фибриногена и фибрина. Гнойный экссудат представляет собой мутную густую жидкость, содержащую до 6–8% белка и большое количество различных форм лейкоцитов, микроорганизмов, погибших клеток повреждённой ткани. Геморрагический экссудат содержит большое количество белка и эритроцитов, а также другие форменные элементы крови. Гнилостный экссудат. Любой вид экссудата может приобрести гнилостный (ихорозный) характер при попадании в очаг воспаления гнилостной микрофлоры (анаэробы). Смешанные формы экссудата могут быть самыми разнообразными (например, серозно-фибринозный, гнойно-фибринозный, гнойно-геморрагический и др.). ЗНАЧЕНИЕ ЭКССУДАЦИИ 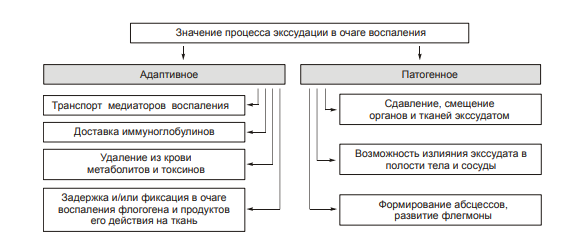 ЭМИГРАЦИЯ ЛЕЙКОЦИТОВ Эмиграция лейкоцитов – активный процесс их выхода из просвета микрососудов в межклеточное пространство. 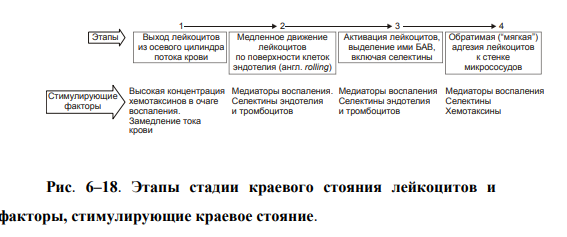  НАПРАВЛЕННАЯ МИГРАЦИИ ЛЕЙКОЦИТОВ За пределами стенки микрососуда начинается направленное движение лейкоцитов к зоне поражения – таксис. 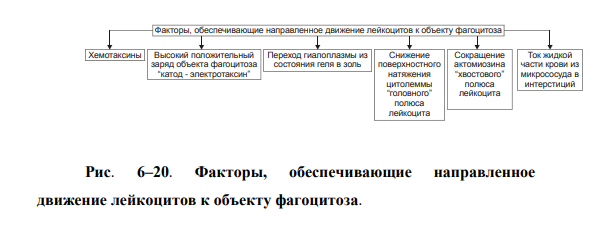 Механизмы таксиса На стороне лейкоцита, обращённой к региону наибольшей концентрации хемотаксинов (хемоаттрактантов) происходит скопление хеморецепторов (их кэппинг). Этот полюс («голова») лейкоцита становится ведущим, а хвостовой – ведомым. В последующем просходит изменение коллоидного состояния цитозоля лейкоцита: переход из состояния геля в состояние золя. На обращённой в сторону очага воспаления области мигрирующего лейкоцита («головной» полюс) снижается поверхностное натяжения, что стимулирует перемещение цитозоля лейкоцита именно в головной конец. Это происходит под действие ряда агентов, накапливающихся при воспалении. Поверхностное натяжение снижается под влиянием ВЖК, катионных белков и внеклеточных катионов. Сокращение 271 актиновых микрофиламентов хвостового полюса и перестройка других структур цитоскелета лейкоцитов способствует проталкивание цитозоля к головному концу лейкоцита и движение его в очаг воспаления. Движению лейкоцита в очаг воспаления способствует также ток жидкой части крови из просвета микрососудов через их стенки в интерстиций (по градиенту фильтрационного, осмотического и онкотического давления). ЗНАЧЕНИЕ ЭМИГРАЦИИ ЛЕЙКОЦИТОВ 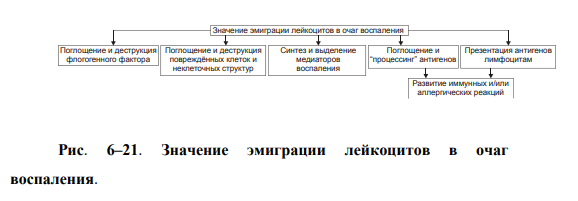 ФАГОЦИТОЗ ФАГОЦИТОЗ - Активный биологический процесс, заключающийся в поглощении чужеродного материала и его внутриклеточной деструкции специализированными клетками организма — фагоцитами. СТАДИИ ФАГОЦИТОЗА В процессе фагоцитоза условно выделяют несколько основных стадий: 1) Сближение фагоцита с объектом фагоцитоза. 2) Распознавание фагоцитом объекта поглощения и адгезия к нему. 3) Поглощение объекта фагоцитом с образованием фаголизосомы. 4) Разрушение объекта фагоцитоза.  Опсонизация (иммунный фагоцитоз) – связывание АТ с клеточной стенкой микроорганизма с последующим эффективным поглощением 275 образовавшегося комплекса фагоцитом Дегрануляция нейтрофилов, эозинофилов и базофилов сопровождается высвобождением в интерстициальную жидкость медиаторов воспаления (например, ИЛ1 и ИЛ6, ФНО, лейкотриенов) и активных форм кислорода, образовавшихся при респираторном взрыве. ПОГЛОЩЕНИЕ ОБЪЕКТА И ОБРАЗОВАНИЕ ФАГОЛИЗОСОМЫ Фагоцитируемый материал погружается в клетку в составе фагосомы – пузырька, образованного плазматической мембраной. К фагосоме приближаются лизосомы и выстраиваются по её периметру. Затем мембраны фагосомы и лизосом сливаются и образуется фаголизосома. В образовании фаголизосомы принимают участие и специфические гранулы нейтрофильного лейкоцита – видоизменённые лизосомы, а для самого процесса слияния необходимы микрофиламенты цитоскелета, Ca2+, протеинкиназа C. ВНУТРИКЛЕТОЧНОЕ «ПЕРЕВАРИВАНИЕ» Разрушение объекта фагоцитоза – внутриклеточное «переваривание» – реализуется в результате активации двух сложных механизмов: кислородзависимой (респираторный взрыв) и кислороднезависимой цитотоксичности фагоцитов. Кислороднезависимые механизмы активируются в результате контакта опсонизированного объекта с мембраной фагоцита. Кислородзависимая цитотоксичность фагоцитов играет ведущую роль в деструкции объекта фагоцитоза. Цитотоксичность сопряжена со значительным повышением интенсивности метаболизма с участием кислорода. Этот процесс получил название метаболического (дыхательного, респираторного, кислородного) взрыва.  ПРОЛИФЕРАЦИЯ Пролиферация – компонент воспалительного процесса и завершающая его стадия – характеризуется увеличением числа стромальных и, как правило, паренхиматозных клеток, а также образованием межклеточного вещества в очаге воспаления. Существенное значение на этой стадии воспаления имеют различные БАВ, в особенности стимулирующие пролиферацию клеток (митогены). РЕГУЛЯЦИЯ ПРОЦЕССА ПРОЛИФЕРАЦИИ К числу наиболее значимых среди них относят: – многие медиаторы воспаления (например, лейкотриены, кинины, биогенные амины, стимулирующие деление клеток); – специфические продукты метаболизма лейкоцитов (например, монокины, лимфокины, ИЛ, факторы роста), а также тромбоцитов, способные активировать пролиферацию клеток; – низкомолекулярные пептиды, высвобождающиеся при деструкции тканей, полиамины (путресцин, спермидин, спермин), а также продукты распада нуклеиновых кислот, активирующие размножение клеток; – гормоны (СТГ, инсулин, T4, кортикоиды, глюкагон), многие из них способные как активировать, так и подавлять пролиферацию в зависимости от их концентрации, активности, синергических и антагонистических взаимодействий; например, глюкокортикоиды в низких дозах тормозят, а минералокортикоиды — активируют реакции регенерации. ИСХОДЫ ВОСПАЛЕНИЯ При благоприятном течении воспаления в очаге воспаления наблюдается, как правило, полная регенерация ткани – восполнение её погибших и восстановление обратимо повреждённых структурных элементов. При значительном разрушении участка ткани или органа на месте дефекта паренхиматозных клеток образуется вначале грануляционная ткань, а по мере её созревания – рубец, т.е. наблюдается неполная регенерация ОСТРОЕ И ХРОНИЧЕСКОЕ ВОСПАЛЕНИЕ Острое воспаление характеризуется: – интенсивным течением и завершением воспаления обычно в течение одной–двух недель (в зависимости от повреждённого органа или ткани, степени и масштаба их альтерации, реактивности организма и др.); – умеренно выраженной альтерацией и деструкцией тканей, экссудативных и пролиферативных изменений в очаге повреждения при нормергическом 284 характере воспаления. При гиперергическом его течении в очаге воспаления доминируют альтерация и разрушение тканей. ХРОНИЧЕСКОЕ ВОСПАЛЕНИЕ Хроническое воспаление может быть первичным и вторичным. Если воспаление после острого периода приобретает затяжной характер, то оно обозначается как «вторично хроническое». Если воспаление изначально имеет персистирующее – вялое и длительное – течение, его называют «первично хроническим» ПРОЯВЛЕНИЯ ХРОНИЧЕСКОГО ВОСПАЛЕНИЯ Формирование гранулем (например, при туберкулёзном, бруцеллёзном или сифилитическом воспалении). Значительная инфильтрация очага воспаления различными видами лейкоцитов, но преимущественно моноцитами и лимфоцитами. Образование фиброзной капсулы Частое развитие некроза в центре очага хронического воспаления  ПРИЗНАКИ ОСТРОГО ВОСПАЛЕНИЯ МЕСТНЫЕ ПРИЗНАКИ ОСТРОГО ВОСПАЛЕНИ Местные признаки острого воспаления сформулированы ещё в Античности. К ним отнесены rubor, tumor, dolor, calor, functio laesa. В современной литературе, в качестве синонима, местное воспаление нередко обозначают как синдром локального воспатительного ответа (СЛВО), в англоязычной литературе – Local Inflammatory Response Syndrom (LIRS) RUBOR Причины покраснения (лат. rubor) очагавоспаления: – артериальная гиперемия, – увеличение числа, а также расширение артериол и прекапилляров; – возрастание количества функционирующих капилляров, заполненных артериальной кровью; – «артериализация» венозной крови, обусловленная повышением содержания HbO2 в венозной крови. TUMOR Причины припухлости (лат. tumor): – увеличение кровенаполнения ткани в результате развития артериальной и венозной гиперемии; – повышение лимфообразования (в связи с артериальной гиперемией); – отёк ткани; – пролиферация клеток в очаге воспаления. DOLOR Причины боли (лат. dolor): – воздействие на рецепторы медиаторов воспаления (гистамина, серотонина, кининов, некоторых Пг); – высокая концентрация H + , метаболитов (лактата, пирувата и других); – деформация ткани при скоплении в ней воспалительного экссудата. CALOR Причины повышения температуры (лат. calor) в зоне воспаления: – развитие артериальной гиперемии, сопровождающейся увеличением притока более тёплой крови; – повышение интенсивности обмена веществ, что сочетается с увеличением высвобождения тепловой энергии; – разобщение процессов окисления и фосфорилирования, обусловленное накоплением в очаге воспаления избытка ВЖК, Ca2+ и других агентов. FUNCTIO LAESA Причины нарушения функции (лат. functio laesa) органа или ткани: – повреждающее действие флогогенного фактора; – развитие в ответ на это альтеративных процессов, сосудистых реакций и экссудации; нередко расстройство функции ограничивается лишь тем органом или тканью, где развивается воспаление, но может нарушаться и жизнедеятельность организма в целом, особенно если воспалительный СИСТЕМНЫЕ ИЗМЕНЕНИЯ ПРИ ОСТРОМ ВОСПАЛЕНИИ  |
