|
|
Лекции биохимия 3. Лекция Обмен липидов
Лекция 6. Обмен липидов.
Аннотация. Излагаются механизмы синтеза, превращений и распада основных групп липидов в организмах. Даются особенности действия ферментов и ферментных комплексов, катализирующих эти биохимические реакции. Указывается локализация реакций синтеза и превращений конкретных липидов. Рассматриваются биохимические механизмы превращения липидов в углеводы и включения продуктов распада липидов в дыхательные реакции.
Ключевые слова. Синтетаза жирных кислот, ацилпереносящие белки, ацетил-кофермент А, пропионилкофермент А, малонилкофермент А, метилмалонилкофермент А, оксигеназы (десатуразы), глицеролфосфатацилтрансферазы, ЦДФ-этаноламин, ЦДФ-холин, липазы, α-окисление жирных кислот, β-окисление жирных кислот, карнитин, глиоксилатный цикл, глиоксисомы, глюконеогенез, фосфолипазы, циклоартенол.
Рассматриваемые вопросы:
Синтез глицеролфосфата и жирных кислот.
Синтез ацилглицеринов и фосфолипидов.
Распад жиров и фосфолипидов.
Превращение жирных кислот в углеводы.
Синтез и превращения других липидов.
Модульная единица 9. Обмен липидов.
Цели и задачи изучения модульной единицы. Изучить биохимические механизмы синтеза и превращений основных групп липидов. Научить студентов использовать знания по обмену липидов для прогнозирования биохимических процессов в растениях при обосновании технологий выращивания сельскохозяйственных культур и оценке качества растительной продукции.
9.1. Синтез глицеролфосфата и жирных кислот.
Главными запасными формами липидов растений являются жиры, которые интенсивно синтезируются в хлоропластах, семенах и плодах. Особенно много накапливается жиров в семенах масличных растений. Изучение биохимических процессов в созревающих семенах масличных растений показало, что увеличение в них содержания жиров сопровождается понижением концентрации сахаров. При введении в созревающие семена сахаров, меченных радиоактивным изотопом углерода 14С, радиоактивная метка довольно быстро обнаруживалась в составе ацилглицеринов жира. Это послужило доказательством, что синтез жира осуществляется из углеводов. В дальнейшем было выяснено, что непосредственными предшественниками в синтезе ацилглециринов жира являются активированные формы жирных кислот и фосфорилированный глицерин, которые образуются из продуктов углеводного обмена.
Синтез глицеролфосфата. Исходными веществами для синтеза глицеролфосфата служат продукты фотосинтеза и дыхания 3-фосфоглице-риновый альдегид и фосфодиоксиацетон. Они образуются в цикле Кальвина при фотосинтезе, на стадии гликолиза при дыхании, а также в реакциях пентозофосфатного цикла. Непосредственно глицеролфосфат синтезируется в результате восстановления фосфодиоксиацетона ферментом глицерол-3-фосфатдегидрогеназой:
Н
/
С=О СН2ОН СН2ОН
| | |
СНОН D С=О + НАД×Н +Н+ ¾® СНОН + НАД+
| | |
СН2О(Р) СН2О(Р) СН2О(Р)
3-фосфогли- фосфодиокси-
цериновый ацетон глицерол-3-фосфат
альдегид
Синтезированный из углеводных продуктов глицерол-3-фосфат затем используется для синтеза ацилглицеринов жира, фосфолипидов и гликолипидов.
Синтез жирных кислот
В опытах по изучению синтеза жирных кислот в созревающих семенах масличных растений выяснено, что наиболее легко они образуются из производных уксусной кислоты. На этой основе было сформулировано предположение, что жирные кислоты синтезируются в результате реакций конденсации двууглеродных органических соединений. В дальнейшем с использованием меченных 14С биохимических предшественников было показано, что основным органическим соединением, непосредственно участвующем в синтезе жирных кислот, является ацетилкофермент А, который образуется как продукт дыхательных реакций или реакций распада липидов и аминокислот.
На первом этапе происходит активирование ацетилкофермента А путем превращения его в малонилкофермент А. Эту реакцию катализирует фермент ацетил-КоА-карбоксилаза (6.4.1.2), содержащий в активном центре группировку биотина. В состав фермента также входят катионы Mn2+. Карбоксилирование ацетил-КоА сопряжено с гидролизом АТФ:
СН3–СS–КоА+СО2+Н2О+АТФ ¾®НООС–СН2–С
S–КоА+АДФ + Н3РО₄
|| ||
О О
ацетил-КоА малонил-КоА
В дальнейшем процесс синтеза жирной кислоты осуществляется с участием мультиферментного комплекса, называемого синтетазой жирных кислот. Ферментный комплекс растворён в жидкой фазе цитозоля и в его центральной части находятся молекулы специфического белка, способного присоединять и переносить ацильные остатки в ходе синтеза жирной кислоты. Этот белок получил название ацилпереносящего белка (АПБ). К одному из сериновых остатков ацилпереносящего белка через остаток фосфорной кислоты присоединена группировка витамина пантотеновой кислоты, с которой связан остаток тиоэтаноламина. В связи с тем, что остаток тиоэтаноламина содержит активную тиоловую группу, ацилпереносящий белок сокращённо обозначают HS-АПБ. С помощью АПБ поддерживается рост цепи синтезируемой жирной кислоты и её переход от одного фермента к другому в пределах мультиферментного комплекса. Строение ацилпереносящего белка можно представить в виде следующей схемы:
Н Н НО СН3 ОН
| | | | |
НS–СН2–СН2–N–С–СН2–СН2–N–С–С–С–СН2–О–Р–О–Ser–АПБ
|| || | | ||
О О Н СН3 О
тиоэтаноламин пантотеновая кислота
Под действием фермента АПБ-ацетилтрансферазы (2.3.1.38) остаток уксусной кислоты от ацетил-КоА переносится на АПБ:
(2)
СН–С
S–КоА + НS–АПБ ¾® СН3–С
S–АПБ + НS–КоА
|| ||
О О
ацетил-КоА ацетил-АПБ
С участием другого фермента АПБ-малонилтрансферазы (2.3.1.39) на АПБ также переносится остаток малоновой кислоты от малонил-КоА:
(3)
НООС–СН2–С
S–КоА + НS–АПБ ¾® НООС–СН2–С
S–АПБ + НS–КоА
|| ||
О О
малонил-КоА малонил-АПБ
В следующей реакции, происходящей в мультиферментном комплексе синтезы жирных кислот, под действием фермента 3-оксоацил-АПБ-синтазы (3.3.1.41) происходит образование из двууглеродного и трёхуглеродного радикалов ацетил-АПБ и малонил-АПБ четырёхуглеродного фрагмента, соединённого с АПБ. При этом в ходе реакции молекула малонил-КоА декарбоксилируется и в качестве продукта данного превращения выделяется та же молекула СО2, которая вошла в состав малонил-КоА в результате карбоксилирования ацетил-КоА: (4)
СН₃–С
S–АПБ + НООС–СН2–С
S–АПБ ® СН3–С–СН2–С
S–АПБ + СО2 + НS-АПБ
|| || || ||
О О О О
ацетил-АПБ малонил-АПБ ацетоацетил-АПБ
Таким образом, карбоксилирование ацетил-КоА можно рассматривать как реакцию активирования ацетильного радикала для переноса на соответствующий акцептор, котор
ый представляет собой ацильный радикал, соединённый с АПБ в ферментном комплексе синтетазы жирных кислот.
Образовавшееся 3-оксоацилпроизводное далее подвергается восстановлению под действием фермента 3-оксоацил-АПБ-редуктазы (1.1.1.100), который использует в качестве донора электронов и протонов восстановленные динуклеотиды НАДФ×Н. В результате восстановительной реакции синтезируется 3-оксипроизводное:
(5)
СН3–С–СН2–С
S–АПБ + НАДФ×Н+Н+®СН3–СН–СН2–С
S–АПБ+НАДФ+
|| || | ||
О О ОН О
ацетоацетил-АПБ 3-оксибутирил-АПБ
Как мы уже знаем, источниками образования восстановленных динуклеотидов НАДФ×Н служат фотосинтетическое фосфорилироввание или реакции пентозофосфатного цикла.
В следующей реакции от 3-оксибутирил-АПБ отщепляется молекула воды с образованием a,b-ненасыщенного производного кротонил-АПБ. Данное превращение катализирует фермент кротонил-АПБ-гидратаза (4.2.1.58):
(6)
СН3–СН–СН2–С
S–АПБ ® СН3–СН=СН–С
S–АПБ + Н2О
| || ||
ОН О О
3-оксибутирил-АПБ кротонил-АПБ
Ненасыщенное производное восстанавливается ферментом еноил-АПБ-редуктазой (1.3.1.10), который использует в качестве донора электронов и протонов восстановленные динуклеотиды НАДФ×Н:
(7)
СН3–СН=СН–С
S–АПБ+НАДФ×Н+Н+®СН3–СН2–СН2–С
S–АПБ+НАДФ+
|| ||
О О
кротонил-АПБ бутирил-АПБ
На следующем этапе синтеза жирной кислоты бутирил-АПБ становится акцептором ацетильного радикала, переносимого от малонил-АПБ, в результате осуществляется уже синтез шестиуглеродного 3-оксоацил-АПБ. Затем происходят реакции 5-7, в ходе которых синтезируется восстановленное шестиуглеродное производное гексаноил-АПБ. Затем оно также становится акцептором ацетильного радикала, переносимого от малонил-АПБ, снова повторяются реакции 5-7, дающие уже восьмиуглеродное восстановленное производное, связанное с АПБ. По аналогичной схеме указанные реакции повторяются до тех пор, пока не синтезируется полностью углеводородная цепь жирной кислоты, которая далее вследствие ослабления связи с АПБ переносится на кофермент А:
R–С
S–АПБ + НS–КоА ® R–С
S–КоА + НS–АПБ
|| ||
О О
ацил-АПБ ацил-КоА
Длина синтезированной углеводородной цепи жирной кислоты определяется природой ферментного комплекса синтетазы жирных кислот, а в свою очередь природа ферментного комплекса зависит от генотипа организма. Как мы видим, в указанных выше реакциях синтез жирной кислоты происходит в результате переноса на восстановленный акцептор двууглеродного фрагмента от малонил-АПБ, имеющего трёхуглеродный радикал. При этом каждый такой перенос сопровождается выделением СО2. Вначале акцептором двууглеродного фрагмента служит ацетил-АПБ, затем бутирил-АПБ, гексаноил-АПБ и т.д. В общем виде ход удлинения углеродной цепи жирной кислоты в процессе её синтеза можно показать в виде следующей схемы:
С2 + С3 ¾® С4 + С1
С4 + С3 ¾® С6 + С1
С6 + С3 ¾® С8 + С1 и т. д.
Согласно такой схеме синтеза в образующихся жирных кислотах всегда содержится чётное число углеродных атомов.
Учитывая, что исходным веществом для синтеза жирных кислот является ацетил-КоА и на отдельных этапах синтеза используются молекулы АТФ (при образовании малонил-КоА), восстановленных динуклеотидов НАДФ×Н и воды, можно записать суммарное уравнение синтеза насыщенной жирной кислоты на примере пальмитиновой кислоты:
8СН3–С
S–КоА + 7АТФ + 14НАДФ×Н + 14Н+ + Н2О ¾®
||
О
→ СН3(СН₂СН₂)7СООН + 8НS–КоА + 7АДФ + 7Н3РО4 + 14НАДФ+
В ходе синтеза молекулы пальмитиновой кислоты семь раз осуществляется перенос на акцептор двууглеродного фрагмента от малонил-АПБ, при образовании каждой молекулы которого происходит гидролиз АТФ. При этом на каждом этапе процесса удлинения углеводородной цепи жирной кислоты дважды повторяются реакции восстановления с участием восстановленных динуклеотидов НАДФ×Н.
У растений, животных и бактерий преобладают жирные кислоты с чётным числом углеродных атомов. Однако, в клетках некоторых бактерий в значительном количестве синтезируются жирные кислоты с нечётным числом углеродных атомов. Это обусловлено тем, что в клетках бактерий наряду с ацетилкоферментом А важным ключевым метаболитом является пропионилкофермент А, который вместо ацетил-КоА может связываться с ацилпереносящим белком и вступать во взаимодействие с малонил-АПБ, образуя пятиуглеродное 3-оксопроизводное:
СН3–СН2–С
S–АПБ+НООС–СН2–С
S–АПБ®СН3–СН2–С–СН2–С
S–АПБ+НS–АПБ
|| || ↓ || ||
О О СО₂ О О
пропионил-АПБ малонил-АПБ 3-оксопентаноил-АПБ
Затем пятиуглеродное 3-оксопроизводное восстанавливается, проходя такие же стадии превращений, которые представлены в реакциях 5-6 синтеза жирных кислот с участием ферментного комплекса синтетазы жирных кислот. Восстановленный пятиуглеродный фрагмент далее становится акцептором нового двууглеродного фрагмента от малонил-АПБ, после чего снова проходят восстановительные реакции, приводящие к синтезу семиуглеродного восстановленного фрагмента, который снова становится акцептором следующего двууглеродного фрагмента и т.д. Из представленного механизма синтеза видно, что на конечном этапе образуется восстановленная углеводородная цепь жирной кислоты с нечётным числом углеродных атомов. Синтез жирной кислоты с нечётным числом углеродных атомов можно представить в виде следующей схемы:
С3 + С3 ® С5 + С1
С5 + С3 ® С7 + С1
С7 + С3 ® С9 + С1 и т.д.
В составе некоторых разновидностей липидов бактерий, птиц и растений найдены жирные кислоты, имеющие боковые ответвления в их углеродной цепи. Как установлено, такие жирные кислоты могут синтезироваться с участием в качестве акцептора двууглеродных фрагментов разветвлённых ацильных производных, образующихся при распаде аминокислот с разветвлённой углеродной цепью – валина, лейцина, изолейцина:
О О О
// // //
СН3–СН–С
S–КоА СН3–СН–СН2–С
S–КоА СН3–СН2–СН–С
S–КоА
| | |
СН3 СН3 СН3
производное валина производное лейцина производное изолейцина
Универсальным донором разветвлённых ацильных радикалов при синтезе жирных кислот является пропионилкофермент А, который, под-вергаясь карбоксилированию, превращается в метилмалонилкофермент А:
СН3
|
СН3–СН2–С
S–КоА+СО2+Н2О+АТФ®НООС–СН–С
S–КоА+АДФ+Н3РО4
|| ||
О О
пропионил-КоА метилмалонил-КоА
Затем ацильный радикал метилмалонил-КоА переносится на ацилпереносящий белок ферментного комплекса синтетазы жирных кислот и участвует далее в синтезе жирных кислот в качестве донора разветвлённого ацильного радикала:
СН3 СН3
| |
СН3–СН2–С
S–АПБ+НООС–СН–С
S–АПБ ® СН3–СН2–С–СН–С
S–АПБ+НS–АПБ
|| || ↓ || ||
О О СО2 О О
пропионил-АПБ разветвлённое 3-оксопроизводное
После восстановления разветвлённого оксопроизводного образуется восстановленный ацильный радикал, имеющий боковое метильное ответвление у второго углеродного атома. Он далее служит акцептором следующего двууглеродного фрагмента с боковым метильным радикалом, донором которого служит метилмалонил-АПБ. Таким образом, с участием метилмалонильного радикала после каждого акта удлинения ацильного радикала углеродная цепь синтезируемой жирной кислоты удлиняется на два углеродных атома, а у каждого чётного углеродного атома имеется боковой метильный радикал.
Если к исходному акцептору с радикалом R происходит последовательное присоединение четырёх двууглеродных фрагментов с боковым метильным радикалом и на каждом этапе их присоединения осуществляется восстановление полученных 3-оксопроизводных, строение синтезированной жирной кислоты можно записать в виде следующей формулы:
О
8 7 6 5 4 3 2 1//
R–СН–СН2–СН–СН2–СН–СН2–СН–С
S–АПБ
| | | |
СН3 СН3 СН3 СН3
В составе растительных жиров и липидов клеточных мембран преобладают ненасыщенные жирные кислоты. Они синтезируются из насыщенных кислот путём их дегидрогенизации в аэробных условиях, то есть с участием кислорода. В анаэробных условиях происходит синтез насыщенных кислот. Кроме кислорода, важнейшими соединениями, необходимыми для синтеза ненасыщенных жирных кислот, являются восстановленные динуклеотиды НАДФ×Н. На свету в образовании ненасыщенных кислот участвует ферредоксин.
Процесс дегидрогенизации насыщенных жирных кислот катализиру-ют ферменты оксигеназы, которые также называют десатуразами. Различают два вида десатураз I и II. Десатуразы первого типа имеются в клетках растений, животных, грибов, простейших организмов. Они локализованы в цитозоле и способны инициировать образование олеиновой кислоты из стеариновой, образующей соединение с коферментом А – стеароил-КоА:
О О
// //
СН3(СН2)16С
S–КоА+НАДФ×Н+Н++О2®СН3(СН2)7СН=СН(СН2)7С
S–КоА+НАДФ+
↓
Стеароил-КоА 2Н₂О олеоил-КоА
Синтез полиненасыщенных жирных кислот в клетках растений осуществляют десатуразы II, локализованные в эндоплазматическом ретикулуме, так как они образуются с участием полирибосом, связанных с мембранами эндоплазматического ретикулума. В клетках человека и животных превращения олеоил-КоА в линолеоил-КоА не происходит, поэтому полиненасыщенные жирные кислоты (линолевая, липоленовая) для этих организмов являются незаменимыми компонентами пищи.
Линолевая кислота, имеющая две двойные связи, образуется в результате дегидрогенизации олеоил-КоА по такому же механизму, как и синтез олеоил-КоА из стеароил-КоА. Далее по указанному механизму происходит дегидрогенизация линолеоил-КоА с образованием линоленоил-КоА. У животных в клетках печени в результате дегидрогенизации линолеоил-КоА синтезируется производное арахидоновой кислоты–арахидоноил-КоА.
В связи с тем, что для синтеза ненасыщенных жирных кислот необходимы кислород и восстановленные динуклеотиды НАДФ×Н, при их недостатке образование данных кислот ослабляется. Так, например, происходит в условиях повышенных температур, когда снижается растворимость СО2 в жидкой физиологической среде. При избыточном азотном питании увеличивается доля восстановленных динуклеотидов НАДФ×Н, затрачиваемых на восстановление нитритов и синтез аминокислот, и меньше участвует в дегидрогенизации насыщенных жирных кислот, вследствие чего синтез ненасыщенных жирных кислот уменьшается.
9.2. Синтез ацилглицеринов и фосфолипидов.
Исходные соединения для синтеза ацилглицеринов – глицерол-3-фос-фат и активированные жирные кислоты, соединённые с коферментом А. В ходе синтеза ацилглицеринов последовательно осуществляется перенос двух ацильных радикалов жирных кислот на глицерол-3-фосфат под действием фермента глицеролфосфатацилтрансферазы (2.3.1.15) с образованием фосфатидной кислоты:
СН2ОН R1-СО
S-КоА СН2ОСОR1 R2-СО
S-КоА СН2ОСОR1
| | |
СНОН ¾¾® СНОН ¾¾® СНОСОR2
| | |
СН2О(Р) –НS-КоА СН2О(Р) –НS-КоА СН2О(Р)
глицерол-3-фосфат моноацил- фосфатидная
глицерид- кислота
3-фосфат
Фосфатидная кислота является важным промежуточным метаболитом в синтезе как ацилглицеринов, так и фосфолипидов и гликолипидов. В результате гидролиза фосфоэфирной связи под действием фосфатидат-фосфогидролазы (3.1.3.4) фосфатидная кислота превращается в диацилглицерин:
СН2ОСОR1 СН2ОСОR1
| |
СНОСОR2 + Н2О ¾® СНОСОR2 + Н3РО4
| |
СН2О(Р) СН2ОН
Фосфатидная диацилглицерин
кислота
При переносе на диацилглицерин третьего ацильного остатка осуществляется синтез триациглицерина – основного химического компонента жира:
СН2ОСОR1 СН2ОСОR1
| |
СНОСОR2 + R3СО
S-КоА ¾¾® СНОСОR2 + НS-КоА
| |
СН2ОН СН2ОСОR3
диацилглицерин триацилглицерин
Радикал R3 в этой реакции, как правило, представлен остатком ненасыщенной жирной кислоты. Учитывая, что радикалы R1, R2, R3 представляют собой остатки разных жирных кислот, совершенно очевидно, что синтезируемый жир включает определённую смесь ацилглицеринов, состав которой зависит от генотипа и фазы развития растений, а также от условий окружающей среды.
Хорошими объектами для изучения процесса синтеза ненасыщенных жирных кислот и ацилглицеринов являются созревающие семена масличных растений. При их созревании усиливается синтез ненасыщенных кислот, о чём свидетельствует увеличение йодного числа, и происходит превращение жирных кислот в ацилглицерины жира, которое сопровождается уменьшением кислотного числа.
Синтез фосфолипидов. В опытах с использованием меченых биохимических предшественников показано, что молекулы фосфолипидов образуются из фосфатидных кислот и других соединений, представленных этаноламином, холином, серином, глицерином, миоинозитом. В цитоплазме растительных клеток фосфатидные кислоты превращаются в диацилглицерины, которые уже далее участвуют в синтезе фосфолипидов – фосфатидилэтаноламина и фосфатидилхолина. На первом этапе происходит активирование азотистых оснований в ходе реакций фосфорилирования с образованием этаноламинфосфата и холинфосфата. Эти реакции катализируют ферменты этаноламинкиназа (2.7.1.31) и холинкиназа (2.7.1.32):
СН2-СН2ОН СН2-СН2О(Р)
| + АТФ ¾® | + АДФ
NН2 NН2
этаноламин этаноламин-
фосфат
СН2-СН2ОН СН2-СН2О(Р)
| + АТФ ¾® | + АДФ
N+(СН3)3 N+(СН3)3
холин холинфосфат
Этаноламинфосфат и холинфосфат затем подвергаются активированию с участием макроэргического соединения ЦТФ, в результате чего образуются цитидиндифосфатэтаноламин (ЦДФ-этаноламин) и цитидиндифосфатхолин (ЦДФ-холин):
СН2-СН2О(Р) СН2-СН2О–(Р)–О–(Р)–О–цитидин
| + ЦТФ ¾® | + Н4Р2О7
NН2 NН2
ЦДФ-этаноламин
СН2-СН2О(Р) СН2–СН2О–(Р)–О–(Р)–О–цитидин
| + ЦТФ ¾® | + Н4Р2О7
N+(СН3)3 N+(СН3)3
ЦДФ-холин
Эти реакции катализируют ферменты этаноламинфосфатцитидилил-трансфераза (2.7.7.14) и холинфосфатцитидилилтрансфераза (2.7.7.15).
Соединение диацилглицеринов с цитидиндифосфатпроизводными этаноламина и холина происходит с участием ферментов этаноламинфосфотрансферазы (2.7.8.1) и холинфосфотрансферазы (2.7.8.2). В этих реакциях осуществляется синтез фосфатидилэтаноламина и фосфотидилхолина, а в качестве побочного продукта высвобождается цитидиловая кислота (ЦМФ):
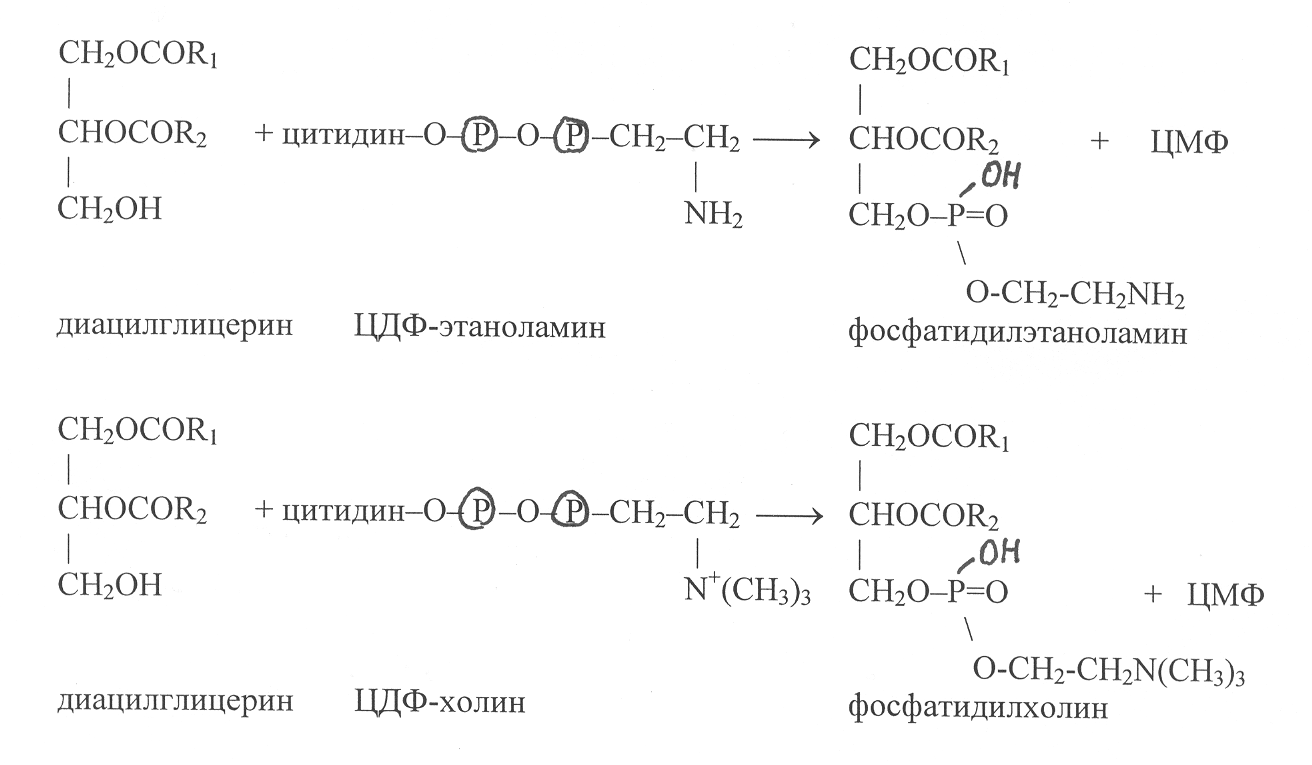
Следует отметить, что в процессе синтеза фосфолипидов реализуется такой механизм присоединения ацильных радикалов к глицерол-3-фосфату, при котором радикал R1 обычно представлен остатком насыщенной жирной кислоты, а радикал R2 – остатком ненасыщенной кислоты. П
ри синтезе фосфолипидов в хлоропластах и митохондриях активированию подвергается фосфатидная кислота в результате взаимодействия с ЦТФ:
В последующих реакциях остаток цитидиловой кислоты в молекуле ЦДФ-диацилглицерида может замещаться на серин или миоинозит, в результате осуществляется синтез фосфатидилсерина и фосфатидил-инозита:
Ф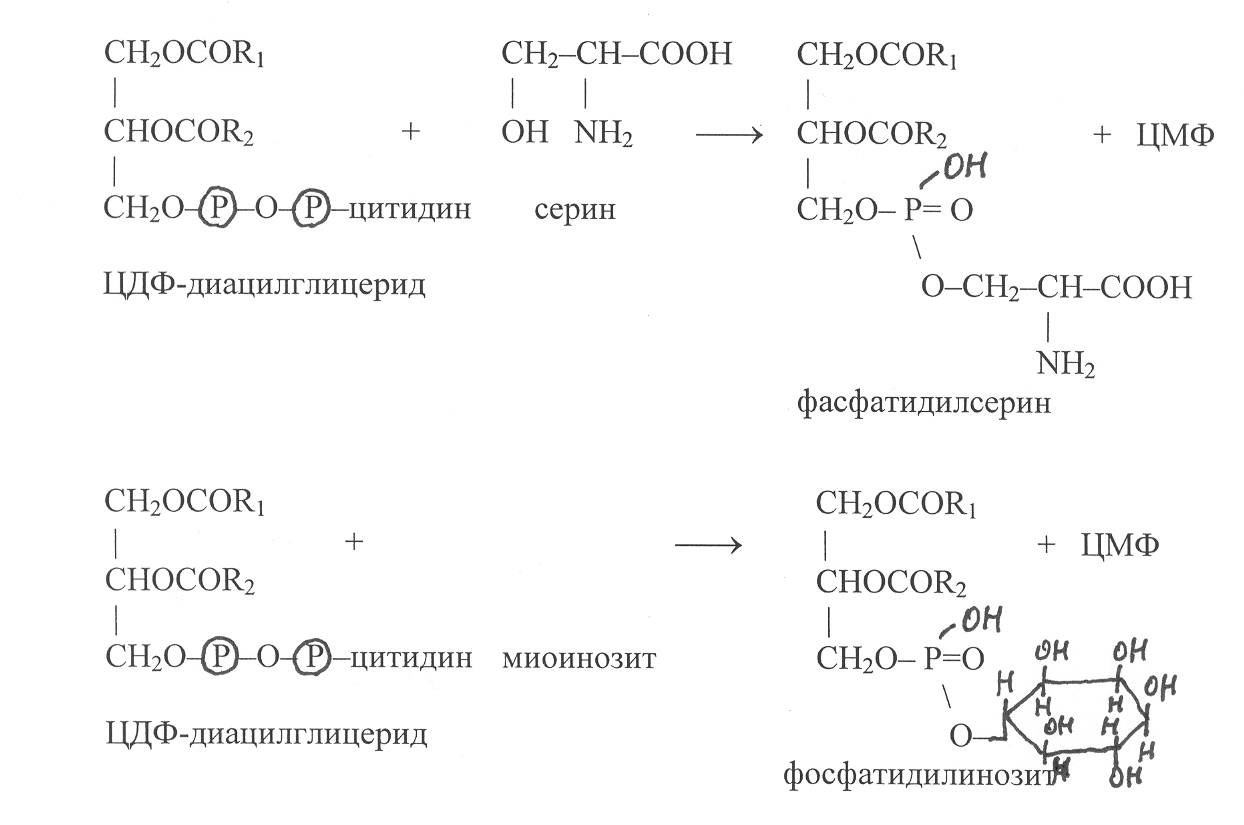
осфатидилсерины могут также синтезироваться при замещении остатков холина или этаноламина в молекулах фосфатидилхолинов или фосфати-дилэтаноламинов на серин:
фосфатидилэтаноламин + серин ¾® фосфатидилсерин + этаноламин
фосфатидилхолин + серин ¾® фосфатидилсерин + холин
В
реакцию с ЦДФ-диглицеридом может вступать глицерол-3-фосфат с образованием фосфатидилглицерофосфата:
Далее в результате гидролиза фосфоэфирной связи от молекулы фосфатилглицерофосфата отщепляется остаток фосфорной кислоты и происходит образование фосфатидилглицерина:
фосфатидилглицерофосфат + Н2О ¾® фосфатидилглицерин + Н3РО4
9.3. Распад жиров и фосфолипидов.
В процессе синтеза ацилглицеринов жира происходит образование сложноэфирных связей между остатками глицерина и жирных кислот. В ходе распада ацилглицеринов происходит обратный процесс – расщепление сложноэфирных связей гидролитическими ферментами липазами (3.1.1.3). Особенно высока активность липаз в прорастающих семенах масличных растений, у которых главными запасными веществами являются жиры. Под действием липаз жиры с участием воды расщепляются до глицерина и свободных жирных кислот:
СН2ОН
СН2ОСОR1 |
| + 3Н2О ¾® СНОН + R1–СООН + R2–СООН + R3–СООН
СНОСОR2 |
| СН2ОН
СН2ОСОR3
триацилглицерин глицерин жирные кислоты
В ходе реакции гидролиза фермент последовательно катализирует расщеп-ление первой сложноэфирной связи триацилглицерина, затем второй и далее третьей.
Большинство липаз находится в клетках растений или микроорганизмов в растворимом состоянии и имеют оптимум каталитического действия при рН 8. Для проявления каталитической активности липаз необходимо присутствие в физиологической среде катионов Са2+.
Образовавшиеся при гидролизе жира глицерин и жирные кислоты подвергаются дальнейшим превращениям. Глицерин вначале фосфорилируется от АТФ под действием фермента глицеролкиназы (2.7.1.30) и превращается в глицерол-3-фосфат:
СН2ОН СН2ОН
| |
СНОН + АТФ ¾® СНОН + АДФ
| |
СН2ОН СН2О(Р)
глицерин глицерол-3-фосфат
СН2ОН СН2ОН
| |
СНОН + НАД+ ¾® С=О + НАД×Н + Н+
| |
СН2О(Р) СН2О(Р)
глицерол-3-фосфат фосфодиоксиацетон
Затем глицерол-3-фосфат окисляется с участием уже известного нам фермента НАД-специфичной глицеролфосфатдегидрогеназы, превращаясь в фосфодиоксиацетон:
Н
/
СН2ОН С=О
| |
С=О D СНОН
| |
СН2О(Р) СН2О(Р)
фосфодиокси- 3-фосфоглицериновый
ацетон альдегид
Под действием фермента триозофосфатизомеразы фосфодиокси-ацетон изомеризуется в 3-фосфоглицериновый альдегид. В связи с тем, что данный фермент катализирует и обратную реакцию превращения 3-фосфоглицеринового альдегида в фосфодиоксиацетон, в физиологической среде между указанными метаболитами устанавливается динамическое равновесие:
Дальнейшие превращения фосфодиоксиацетона и 3-фосфоглицери-нового альдегида могут происходить в двух направлениях: они могут участвовать в синтезе углеводов или включаться в дыхательные реакции.
Если в клетках организма осуществляется превращение запасных жиров в углеводы, например, при прорастании семян масличных растений, под действием фермента альдолазы фосфодиоксиацетон и 3-фосфогли-цериновый альдегид конденсируются с образованием фруктозо-1,6-дифосфата, который превращается во фруктозо-6-фосфат, способный далее включаться в синтез различных углеводов по уже известным нам механизмам.
С другой стороны, 3-фосфоглицериновый альдегид может включаться в реакции дыхания и использоваться как энергетический материал. В этом случае он окисляется в анаэробной стадии дыхания до пировиноградной кислоты, которая в результате окислительного декарбоксилирования образует ацетил-КоА, включающийся далее в реакции цикла Кребса.
Другие продукты гидролиза жиров – жирные кислоты – подвергаются окислению у человека и животных преимущественно под действием ферментов, локализованных во внутреннем матриксе митохондрий, а у растений в значительном количестве ещё и в цитоплазме клеток. В соответствии с этим у растений различают два механизма окисления жирных кислот: a-окисление и b-окисление.
Распад жирных кислот по механизму a-окисления осуществляется в цитоплазме растительных клеток и происходит в две стадии. На первой стадии жирная кислота подвергается действию фермента пероксидазы жирных кислот (1.11.1.3), который с участием пероксида водорода катализирует окислительное декарбоксилирование жирной кислоты с образованием альдегида:
O
//
R2–CH2–CH2–COOH + H₂O₂ + ½ O2 ¾® R–CH2–C–H + CO2 + 2H2O
жирная кислота альдегид
жирной кислоты
На второй стадии a-окисления альдегид жирной кислоты окисляется до кислоты под действием фермента дегидрогеназы альдегидов жирных кислот (1.2.1.3), имеющего в качестве кофермента нуклеотидную группировку НАД:
О О
// //
R2–CH2–C–Н + Н2О + НАД+ ¾® R2–CH2–C–ОН + НАД×Н + Н+
В результате a-окисления кислород присоединяется к a-углеродному атому жирной кислоты, а от карбоксильной группы отщепляется СО2 и углеродная цепь жирной кислоты становится короче на один углеродный атом. При многократном повторении a-окисления происходит деградация жирной кислоты на СО2 и воду. Но в ходе окисления альдегидов жирных кислот на каждую молекулу выделившегося в предшествующей реакции СО2 синтезируется 1 молекула восстановленного динуклеотида НАД×Н. Таким образом, при a-окислении жирных кислот часть их свободной энергии используется для синтеза динуклеотидов НАД×Н, которые могут далее участвовать в восстановительных реакциях, лежащих в основе синтеза различных биохимических продуктов растительной клетки. Наиболее активно a-окисление жирных кислот происходит в прорастающих семенах масличных культур.
Распад жирных кислот по механизму b-окисления проходит во внутреннем матриксе митохондрий. Большая часть жирных кислот находится не в свободном виде, а превращается в КоА-производные под действием ацил-КоА-синтетазы (6.2.1.3). В ходе такого превращения осуществляется сопряжённый синтез ацил-КоА за счёт гидролиза АТФ:
О
//
R–CH2–CH2–C–OH + HS–КоА + АТФ ¾® R–CH2–CH2–C
S–КоА + АМФ + Н4Р2О7
||
|
|
|
 Скачать 4.12 Mb.
Скачать 4.12 Mb.



