|
|
Лекции биохимия 3. Лекция Обмен липидов
10.10. Cинтез РНК.
В клетках организмов синтез рибосомной, матричной и транспортной РНК представляет собой первый этап внутриклеточной реализации генетической информации, закодированной в молекулах ДНК, он получил название транскрипции. В ходе транскрипции под действием ферментов РНК-полимераз осуществляется копирование определённых участков нуклеотидных последовательностей ДНК в виде синтезируемых рибонуклеотидных цепей РНК, которые комплементарны ДНК-матрице. При синтезе РНК принцип комплементарности оснований реализуется путём спаривания аденина с урацилом (А У) и гуанина с цитозином (Г Ц). В качестве матрицы для синтеза РНК служит одна из цепей двуспиральной ДНК, которую называют значащей цепью.
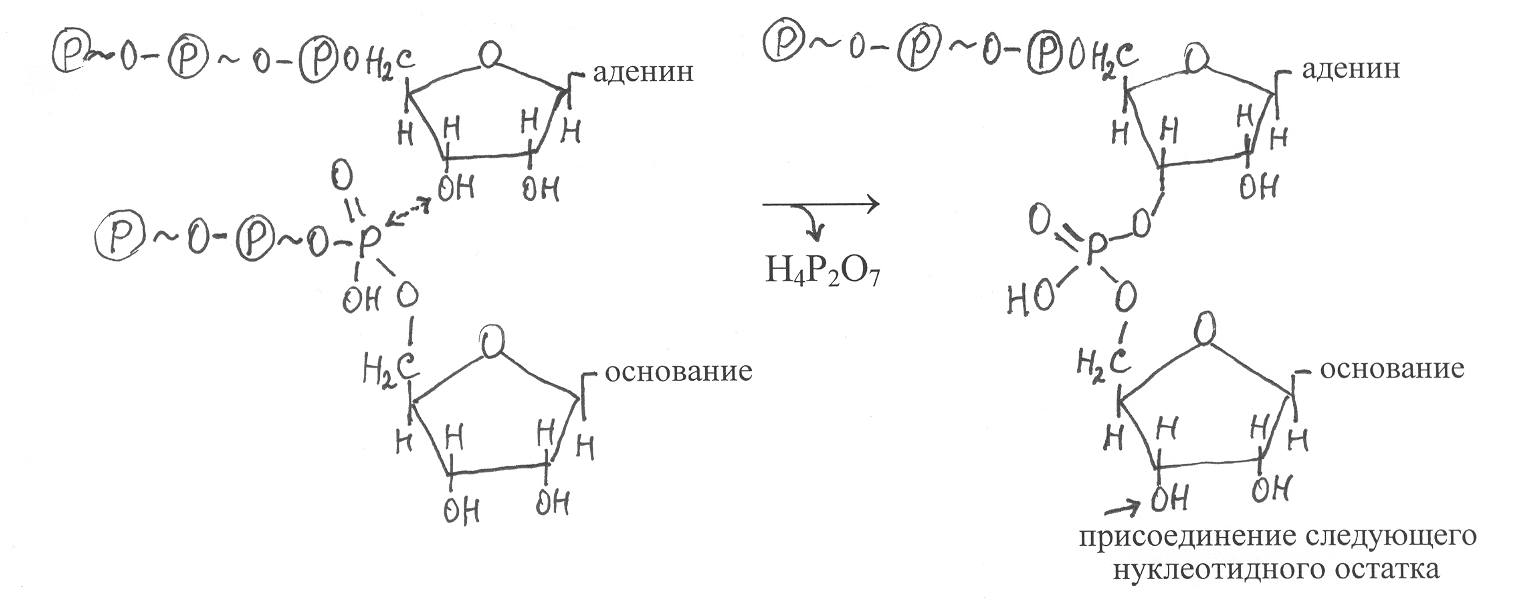
Построение полинуклеотидной цепи РНК происходит в результате присоединения к свободным 3'-концам синтезирующейся молекулы РНК 5'-фосфатных групп комплементарных ДНК-матрице остатков рибонуклеотидов, источниками которых в процессе синтеза служат соответствующие рибонуклеозидтрифосфаты. В ходе реакции происходит гидролиз макроэргической связи рибонуклеозидтрифосфата, присоединение рибонуклеотидного остатка 3'-ОН синтезируемой молекулы РНК и высвобождение свободного пироофосфата – Н4Р2О7. При этом у первого нуклеотидного остатка синтезированной цепи РНК на 5'-конце остаётся трифосфатная группировка. Чаще всего инициаторными рибонуклеозидтрифосфатами при синтезе РНК служат АТФ или ГТФ, с 3'-ОН которых далее взаимодействует следующий рибонуклеозидтрифосфат. Образование фосфодиэфирных связей в ходе синтеза РНК можно представить в виде следующей схемы:
Бактериальные РНК-полимеразы построены из двух белковых компонентов: основного фермента, включающего каталитические центры для синтеза РНК, и σ-субъединицы, обеспечивающей правильное присоединение РНК-полимеразы к промотору и отделяющейся от основного фермента после начала синтеза РНК.
Размер σ-субъединицы варьирует у разных бактерий. Синтез генов рибосомных, транспортных и большинства матричных РНК катализируют РНК-полимеразы, включающие главную σ-субъединицу (молекулярная масса у Е.coli » 70 тыс.). Однако для транскрипции некоторых генов используются так называемые минорные σ-субъединицы, которые по сравнению с главной σ-субъединицей имеют меньшие размеры и содержатся в клетках в значительно меньшем количестве.
В ядрах клеток высших организмов найдены три вида РНК-полимераз. РНК-полимераза I катализирует синтез в ядрышке 18S и 23S рибосомной РНК, РНК-полимераза II – синтез mРНК, РНК-полимераза III – синтез тРНК и других низкомолекулярных форм РНК. В каждой молекуле ядерных РНК-полимераз содержатся две большие субъединицы с молекулярными массами 120-220 тыс. и 5-13 малых субъединиц с молекулярными массами 10-100 тыс. Кроме того, в клетках высших организмов синтезируются хлоропластные и митохондриальные РНК-полимеразы. По строению хлоропластные РНК-полимеразы сходны с аналогичными ферментами бактерий. Митохондриальные РНК-полимеразы отличаются по строению и от ядерных, и от бактериальных РНК-полимераз, но они имеют значительное сходство с РНК-полимеразами некоторых бактериофагов.
Минорные σ-субъединицы РНК-полимераз инициируют синтез РНК не с основных промоторов, узнавание которых ферментом происходит в результате присоединения главной σ-субъединицы, а с дополнительных промоторов, дающих начало транскрипции определённых генов, активируемых, как правило, под воздействием факторов окружающей среды. Так, например, у бактерий Е.coli дополнительная σ-субъединица РНК-полимеразы с молекулярной массой 32 тыс. включает транскрипцию генов, активируемых тепловым шоком. У бактерий-азотфиксаторов транскрипция генов, кодирующих глутаминсинтетазу и ферментов азотфиксации, инициируется с участием специальной σ-субъединицы с молекулярной массой 60 тыс. Промоторы для начала транскрипции генов с участием минорных σ-субъединиц отличаются по нуклеотидной последовательности от участков ДНК, занимаемых главными промоторами.
Процесс транскрипции начинается с присоединения фермента РНК-полимеразы к промотору, который представляет собой участок двуспиральной ДНК в самом начале транскриптона. Размер промотора определяется размером молекулы РНК-полимеразы и у бактерий обычно составляет по длине 70-75 нуклеотидных остатков. Присоединяясь к промотору, РНК-полимераза образует комплекс с ДНК, в котором под действием ферментного белка происходит расплетание одного витка двойной спирали ДНК в той части промотора, где находится инициаторный нуклеотидный остаток, дающий начало синтезу рибонуклеотидной цепи РНК. К инициаторному нуклеотидному остатку ДНК комплементарно присоединяется молекула АТФ или ГТФ и далее уже к их 3'-ОН присоединяется следующий нуклеотидный остаток синтезируемой цепи РНК.
Инициаторный нуклеотидный остаток ДНК, дающий начало транскрипции, находится в составе промотора на расстоянии примерно 20-25 нуклеотидных остатков от его внешней границы, направленной по ходу транскрипции. В каждом промоторе содержится определённый набор участков со специфическими последовательностями нуклеотидных остатков, который «узнают» ферменты РНК-полимеразы и только тогда они образуют с промоторами достаточно прочные комплексы, способные к инициации транскрипции.
Стадия инициации транскрипции заканчивается при образовании зачатка нуклеотидной цепи РНК длиной до 3-6 нуклеотидных остатков (в зависимости от типа промотора), который образует со значащей цепью ДНК гибридную спираль и таким образом достаточно прочно удерживается в комплексе фермента с ДНК. Как только заканчивается стадия инициации транскрипции, у бактерий от фермента РНК-полимеразы отделяется σ-субъединица и процесс транскрипции переходит в следующую стадию – стадию элонгации синтезирующейся цепи РНК.
В ходе синтеза РНК РНК-полимераза движется по матрице в направлении от 3'-конца к 5'-концу значащей цепи ДНК, расплетая двойную спираль. В активном центре фермента осуществляется присоединение нуклеотидов к растущей цепи РНК и удерживается гибридный участок двойной спирали ДНК-РНК длиной примерно 12 нуклеотидных остатков. Позади фермента восстанавливается двойная спираль ДНК и одновременно из каталитического центра фермента высвобождается участок синтезируемой цепи РНК (рис. 47).
На скорость движения по ДНК-матрице РНК-полимеразы оказывает влияние степень спирализации ДНК. При увеличении отрицательной сверхспирализации ДНК скорость движения РНК-полимеразы по матрице и, следовательно, скорость синтеза РНК возрастает, так как в этом случае облегчается процесс расплетания ДНК.
У бактерий синтез РНК заканчивается при достижении РНК-полимеразой участка ДНК, называемого терминатором. В нём содержится ГЦ-богатая последовательность, вслед за которой в значащей нити ДНК по ходу транскрипции следует последовательность из 4-8 повторяющихся остатков адениловой кислоты (поли-А). Транскрипция прекращается на конце участка поли-А или сразу же за ним. В результате транскрибирования участка ДНК с повторяющимися ГЦ-парами нуклеотидов синтезируется последовательность нуклеотидов РНК, обладающая способностью к формированию двойной спирали в форме «шпильки», которая разрушает большую часть гибридной двойной спирали ДНК-РНК, что ослабляет связь синтезированной цепи РНК с ДНК-матрицей и приводит к высвобождению РНК из ферментного комплекса РНК-полимеразы (рис. 48). После этого происходит отделение от ДНК-матрицы и самого фермента РНК-полимеразы. После соединения с σ-субъединицей ферментная молекула может снова взаимодействовать с промотором и катализировать синтез новой молекулы РНК.
Изучение процесса терминации транскрипции генов у высших организмов с участием РНК-полимеразы II показало, что на 3'-концах синтезируемых полинуклеотидных цепей mРНК имеется специфическая последовательность ААУААА, которая предшествует 3'-концевой последовательности поли-А и во время синтеза является специфическим сигналом к полиаденилированию 3'-конца mРНК.
Синтез РНК является первым этапом реализации в организме генетической информации, который далее инициирует синтез белков и прежде всего белков-ферментов, катализирующих ту или иную жизненно важную биохимическую реакцию. Если в конкретных физиологических условиях потребности в данном ферменте нет, то и нет необходимости организму осуществлять синтез соответствующей mРНК. Поэтому синтез многих mРНК в клетках организмов подвержен регуляции, которая осуществляется как на стадии инициации транскрипции, так и в процессе транскрипции.
На стадии инициации транскрипции регуляторное воздействие оказывают специфические белки, которые, присоединяясь к определённым участкам ДНК, останавливают или, наоборот, активируют действие фермента РНК-полимеразы. Белки-регуляторы, подавляющие действие РНК-полимеразы, называют репрессорами, а усиливающие действие этого фермента активаторами транскрипции. Участок ДНК, с которым связывается белок-регулятор, у бактерий называют оператором, у высших организмов – регуляторным элементом гена. Способность регуляторных белков связываться с ДНК зависит от низкомолекулярных веществ – эффекторов. Эффекторы, соединяясь с регуляторными белками, вызывают аллостерическое изменение их структуры, вследствие чего изменяется сродство белка-регулятора к регуляторному участку ДНК.
Различают два вида белков-репрессоров транскрипции. Одни из них оказывают репрессирующее действие на промоторы в отсутствии эффектора, а при взаимодействии с эффектором теряют сродство к своему регуляторному участку и таким образом инициируют процесс транскрипции. Белки-репрессоры второго типа способны присоединяться к ДНК и ингибировать транскрипцию только в комплексе с эффектором. В отсутствии эффектора белок-репрессор неактивен и в таких условиях РНК-полимераза может взаимодействовать с промотором и осуществлять синтез mРНК.
Наиболее эффективный механизм репрессии транскрипции реализуется в том случае, когда участок связывания белка-репрессора находится на промоторе. Присоединившись к определённому участку промотора, репрессорный белок препятствует присоединению к промотору РНК-полимеразы. Действие белков-активаторов транскрипции очень часто заключается в том, что такой белок присоединяется к регуляторному участку ДНК, непосредственно прилегающему к промотору, и, взаимодействуя с РНК-полимеразой, переводит этот фермент в активное состояние.
Впервые принципы регуляции транскрипции бактериальных генов были сформулированы в 1961 г. Ф. Жакобом и Ж. Моно на основе изучения системы регуляции в клетках Е.coli синтеза фермента b-галактозидазы, катализирующего гидролитическое расщепление лактозы до глюкозы и галактозы. Синтез этого фермента происходит, когда в питательной среде нет глюкозы, но присутствует лактоза. Кроме гена, кодирующего b-галактозидазу, в состав лактозного оперона, также входят ген пермеазы, обеспечивающий транспорт лактозы в бактериальную клетку, и ген тиогалактозидтрансацетилазы, не участвующей в усвоении клеткой лактозы. Все три гена копируются в виде одного mРНК-транскрипта.
В отсутствии лактозы транскрипция лактозного оперона подавлена белком-репрессором, который связывается с оператором, находящимся рядом с промотором,и препятствует РНК-полимеразе начать синтез mРНК b-галактозидазы и других ферментных белков. Структура белка-репрессора кодируется специальным геном. Репрессор образует с операторным участком (длиной 24 нуклеотидных остатка) достаточно прочный комплекс и для поддержания его в устойчивом состоянии достаточно 10 молекул репрессорного белка в расчёте на одну клетку.
При появлении в питательной среде лактозы оно частично превращается в свой изомер аллолактозу, которая служит эффектором, образующим комплекс с белком-репрессором, переводя его в неактивное состояние по отношению к оператору. В таком состоянии он уже не препятствует РНК-полимеразе связываться с промотором и начинать транскрипцию, образуя mРНК b-галактозидазы и пермеазы. Далее уже с участием mРНК осуществляется синтез указанных ферментных белков. Под действием эффектора синтез ферментов возрастает примерно в 1000 раз и поддерживается на таком уровне, пока в питательной среде содержится лактоза.
При снижении концентрации лактозы в питательной среде белок-репрессор снова присоединяется к оператору и останавливает транскрипцию лактозного оперона. А все синтезированные молекулы mРНК быстро расщепляются под действием рибонуклеазы до нуклеотидов. Как было указано ранее, время полужизни mРНК у прокариот составляет несколько минут.
Лактозный оперон Е. coli также контролируется другим регуляторным белком – белком-активатором катаболитных оперонов (БАК), который функционирует совместно с циклическим АМФ (цАМФ) и его действие зависит от концентрации в питательной среде оптимального источника углерода для бактерий – глюкозы. В присутствии глюкозы концентрация цАМФ понижается, а в её отсутствие – повышается.
Комплекс БАК с цАМФ присоединяется к своему оператору, который непосредственно прилегает к промоторному участку. Под воздействием БАК инициируется связывание с промотором РНК-полимеразы, катализирующей далее синтез mРНК b-галактозидазы и пермеазы. Однако такой синтез возможен только в том случае, когда под действием лактозы инактивирован белок-репрессор. Таким образом, активная транскрипция лактозного оперона бактерий происходит при снижении в питательной среде концентрации глюкозы, повышающей концентрацию цАМФ, и при наличии достаточного количества лактозы. Образующийся цАМФ активирует БАК, который связывается со своим опероном и инициирует действие фермента РНК-полимеразы, а лактоза, превращаясь в аллолактозу, инактивирует белок-репрессор, подавляющий транскрипцию генов лактозного оперона. Схематически функционирование лактозного опреона Е coli представлено на рисунке 49 .
Как мы видим, в регуляции транскрипции лактозного оперона бактерий участвуют регуляторные белки – белок репрессор и БАК, которые кодируются генами, образующими свои опероны. И транскрипция этих оперонов управляется системой регуляции, включающей определённые белки.
К системе регуляции транскрипции относятся также терминаторы, находящиеся не в конце оперонов, а в их начале между промотором и нуклеотидным остатком, с которого начинается транскрипция структурных генов, или даже внутри структурных генов, кодирующих белковые полипептиды. После прохождения нуклеотидной последовательности такого терминатора РНК-полимеразой в синтезирующейся цепи РНК может образовываться терминаторная или антитерминаторная шпилька. Если возникает терминаторная шпилька, синтез РНК прекращается, если антитерминаторная – терминация транскрипции не происходит и синтез РНК продолжается.
У высших организмов регуляция транскрипции генов включает дополнительные регуляторные последовательности, которые локализованы в промоторах, в составе нуклеотидных последовательностей между промотором и структурным геном, а также внутри структурных генов в составе интронов–участков ДНК, не кодирующих полипептиды. К указанным регуляторным последовательностям присоединяются специфические белки, которые, взаимодействуя с РНК-полимеразой, активируют действие этого фермента или, наоборот, прекращают транскрипцию.
В транскриптонах высших организмов значительно сложнее структурная организация промоторов. Транскрипция генов, катализируемая РНК-полимеразой II, начинается на ДНК с инициаторной последовательности нуклеотидных остатков ТЦ (А,G)А. Этому участку на расстоянии 40-120 н.о. предшествует ТАТА-последовательность. Кроме того, в промоторной зоне обычно находятся повторяющиеся элементы так называемых активирующих последовательностей (АП), к которым присоединяются регуляторные белки, инициирующие действие фермента РНК-полимеразы II. При этом общая длина промоторной зоны может составлять 200-300 нуклеотидных остатков.
Синтезированные в ходе транскрипции молекулы всех видов РНК подвергаются направленному воздействию ряда ферментов, которые осуществляют превращение РНК-предшественников в функционально активные молекулы РНК, способные выполнять свойственные им биологические функции. Превращение РНК-транскриптов в функционально активные молекулы РНК получило название процессинга. В клетках высших организмов процессинг РНК происходит в ядре.
Образующиеся в ходе транскрипции ядерные предшественники mРНК связываются с ядерными белками, формируя рибонуклеопротеидные комплексы, которые далее включаются в процессинг. Особенность процессинга у эукариот заключается в том, что их mРНК-транскрипты состоят из участков, которые входят в состав функционально активных (зрелых) mРНК, и участков, подлежащих удалению в результате процессинга. Участки mРНК-транскрипта, входящие в состав зрелых mРНК, называют экзонами, а удаляемые в ходе процессинга фрагменты mРНК-транскрипта – интронами. Таким образом, гены высших организмов представляют собой определённую последовательность чередующихся экзонов и интронов (рис. 50).
Экзоны включают участки mРНК- транскриптов, кодирующие первичную структуру полипептидов, участки на 5'-конце, содержащие нуклеотидные последовательности промоторов и прилегающие к промоторам регуляторные последовательности, с которыми связываются регуляторные белки. Кроме того, в состав экзонов входят участки на 3'-конце mРНК-транскрипта между терминатором и поли-А последовательностью.
Интроны представляют собой участки mРНК-транскрипта, не кодирующие структуру белков, но они могут включать важные регуляторные последовательности, участвующие в регуляции транскрипции. Число интронов в составе эукариотических генов варьирует от одного до нескольких десятков и их общая длина может во много раз превышать длину экзонов.
Каждый экзон в структуре гена кодирует определённый участок в белковой молекуле длиной 40-50 аминокислотных остатков, который представляет собой отдельный функциональный элемент третичной структуры полипептида (относительно автономный участок белковой молекулы). Из таких элементов в целом и состоит белковая молекула. Если в двух разных белках содержится одинаковая структура, то она кодируется одним и тем же экзоном. Путём повторения и перекомбинации экзонов обеспечивается генетический механизм построения простран-ственной структуры белков из небольших автономных единиц, представляющих собой отдельные самостоятельные элементы вторичной и третичной структуры составляющих белки полипептидов.
В ходе процессинга происходит удаление из структуры mРНК-транскрипта с помощью ферментов интронов, а экзоны соединяются в определённой последовательности, образуя функционально активную mРНК. Процесс соединения экзонов в функционально активную mРНК получил название сплайсинга. Процессинг и сплайсинг mРНК представляют собой единый процесс образования зрелых mРНК, способных участвовать в синтезе белков. Активную роль в процессе сплайсинга выполняют специфические ядерные белки, а также малые ядерные РНК, синтез которых, как и mРНК, катализируют РНК-полимеразы II. Эти РНК содержат много остатков уридиловой кислоты и имеют длину от 90 до 140 нуклеотидных остатков.
В бактериальных клетках большая часть mРНК, синтезируемой в ходе транскрипции, не подвергается процессингу. Однако синтез функционально активных молекул рРНК и тРНК включает пост-транскрипционные изменения, то есть транскрипты рРНК и тРНК бактерий проходят через механизм процессинга.
В клетках высших организмов 28S, 18S- и 5S-РНК синтезируются в виде одного высокомолекулярного транскрипта, из которого они выщепляются в ходе процессинга. Образуемые в ядрах клеток высших организмов предшественники тРНК содержат интрон, включающий последовательность из 14-16 нуклеотидных остатков, которые следуют через один нуклеотидный остаток за 3'-концом антикодона. Молекула предшественника расщепляется эндонуклеазой, а образующиеся полинуклеотидные фрагменты экзонов фосфорилируются и соединяются фосфодиэфирной связью под действием специфической лигазы.
10.11. Синтез белков и нуклеотидов.
Синтез белков представляет собой биохимический механизм образования полипептидов, аминокислотные последовательности которых закодированы в виде последовательности кодонов в соответствующей mРНК. Однако в процессе синтеза полипептидов кодоны и протеиногенные аминокислоты вступают в непосредственное взаимодействие друг с другом. Роль посредников между ними выполняют тРНК и ферментные системы, катализирующие правильное связывание аминокислот с соответствующими тРНК, а также образование способных к синтезу белков рибосом и связывание их с mРНК. В связи с тем, что процесс синтеза белков включает перевод генетической информации, закодированной в виде последовательности кодонов в молекулах mРНК, в последовательность аминокислотных остатков в белковых полипептидах, его называют трансляцией.
Синтез полипептидов начинается с активирования аминокислот и их ковалентного связывания с соответствующими тРНК, которое катализируют ферменты аминоацил-тРНК-синтетазы. Для каждой аминокислоты существует свой фермент, который с высокой точностью катализирует присоединение конкретной аминокислоты к соответствующей тРНК. На первом этапе фермент катализирует взаимодействие аминокислоты с АТФ, в результате образуется аденилат аминокислоты, содержащий макроэргическую связь, и пирофосфат:
О О
// //
R-СН-С + АТФ ¾® R-СН-С + Н4Р2О7
| \ | \
NH2 ОН NH2 О АМФ
аминокислота аденилат аминокислоты
На следующем этапе осуществляется перенос радикала активированной аминокислоты на 3'-конец тРНК, имеющий последовательность из трёх нуклеотидных остатков ЦЦА со со свободным 3'-ОН. В ходе такой реакции происходит соединение макроэргической связью остатка аминокислоты с соответствующей тРНК, а фермент и адениловая кислота высвобождаются:
O О
// //
R-CH-C + HO-АЦЦ – тРНК ¾® R-CH-C
тРНК + АМФ
| \ |
NH2 O
АМФ NH2
аденилат аминоацил-тРНК
аминокислоты
Следует отметить, что промежуточный продукт–аденилат аминокислоты–взаимодействует с тРНК, не выходя из ферментного комплекса, который, кроме каталитической, выполняет ещё две функции: контролирующую и корректирующую. При синтезе аминоацил-тРНК фермент точно выбирает и присоединяет к соответствующим акцепторным участкам определённую аминокислоту и определённую тРНК. Контролирующая функция аминоацил-тРНК-синтетазы заключается в том, что фермент распознает правильность присоединения к аденилату аминокислоты соответствующей тРНК. И если в ходе реакции произошла ошибка, то аминоацил-тРНК-синтетаза, соответствующая данной тРНК, подвергает гидролизу образовавшееся соединение.
Корректирующая функция связана с проверкой ферментом правильного подбора аминокислоты для соединения с определённой тРНК. В случае присоединения к молекуле тРНК неправильной аминокислоты образовавшаяся аминоацил-тРНК также подвергается гидролизу. В результате точной работы фермента, активирующего аминокислоты, вероятность неправильного соединения аминокислоты с тРНК очень мала, она обычно не превышает 0,00006.
Следующий этап синтеза белков, называемый инициацией синтеза полипептидной цепи, происходит с участием рибосом, зрелой mРНК, специфических белковых факторов и инициаторной аминоацил-тРНК. В результате их взаимодействия образуется инициаторный комплекс, в котором осуществляется соединение mРНК с рибосомой и инициаторной аминоацил-тРНК.
Рибосомы – это нуклепротеидные частицы, в которых молекулы рибосомных РНК образуют комплексы с набором специфических рибосомных белков (55 у бактерий и около 70 у эукариот), многие из которых обладают основными свойствами, так как содержат большое количество остатков лизина и аргинина. Диаметр бактериальных рибосом обычно составляет 22 нм, длина около 30 нм. Размеры рибосом цитоплазмы эукариотических клеток превышают размеры бактериальных рибосом в среднем в 1,17 раза. Однако чаще всего размеры рибосом выражают в единицах Сведберга (S) по скорости седиментации частиц в процессе ультрацентрифугирования.
Бактериальные 60S-рибосомы состоят из двух субъединиц – малой 30S-субъединицы и большой 50S-субъединицы. В цитоплазме клеток высших организмов содержатся соответственно 80S-рибосомы, которые распадаются на 40S и 60S-субъединицы. В хлоропластах и митохондриях клеток высших организмов имеются свои собственные рибосомы, которые по химическому составу и размерам находятся ближе к рибосомам прокариот.
Инициация синтеза полипептидной цепи всегда начинается с участием особой метионил-тРНКi, которая с помощью водородных связей комплементарно присоединяется своим антикодоном УАЦ к кодону АУГ mРНК, называемому в связи с этим инициаторным кодоном. Таким образом, синтез любой полипептидной цепи начинается с включения в неё на N-конце остатка аминокислоты метионина, однако после того как синтез полипептида осуществляется, его молекула может подвергаться так называемой посттрасляционной модификации, в ходе которой концевые фрагменты молекулы полипептида могут отщепляться специфической протеазой, поэтому функционально активные полипептиды не всегда содержат на N-конце остатки метионина. С меньшей частотой в качестве инициаторного кодона может использоваться триплет ГУГ, к которому также присоединяется метионил-тРНКi.
У бактерий к инициаторному кодону присоединяется N-
O
//
СН3SCH2CH2CHC
тРНКi
|
НN–С=О
|
Н
формилметионил-тРНКi, у которой аминогруппа метионина блокирована формильной группировкой:
Однако вскоре после начала синтеза полипептидной цепи формильная группировка отщепляется. В отличие от аминоацил-тРНКi, участвующей в инициации синтеза полипептидной цепи, перенос остатков метионина в процессе дальнейшего синтеза полипептидной цепи осуществляется метионил-тРНК второго типа, которая не может взаимодействовать с инициаторным кодоном.
Образование инициаторного комплекса катализируют специфические белки, называемые белковыми факторами инициации синтеза полипептидной цепи. У бактерий это белковые факторы IF1, IF2, IF3, у растений и животных – IF-М1, IF-М2, IF-М3. Наиболее хорошо генетическая система синтеза белков изучена у бактерий.
В бактериальной клетке инициация синтеза белков начинается с того, что белок IF3 связывается с малой субъединицей рибосомы (рис. 51), предотвращая её соединение с большой субъединицей. Затем происходит присоединение малой рибосомной субъединицы к участку на m-РНК, содержащему инициаторный кодон. После этого оказывается возможным комплементарное присоединение к инициаторному кодону N-формил-тРНКi с участием белковых факторов IF2, IF1 и образование так называемого инициаторного комплекса. При этом белок IF2 содержит в связанном состоянии ГТФ, который в дальнейшем подвергается гидролизу в процессе присоединения к инициаторному комплексу большой субъединицы рибосомы, а высвобождающаяся при гидролизе энергия используется для формирования комплекса рибосомы, mРНК и присоединённой к mРНК метионил-тРНКi. Образовавшийся комплекс способен в дальнейшем участвовать в следующем этапе синтеза белка – элонгации полипептидной цепи), а белковые факторы IF3, IF1 и IF2 высвобождаются.
В клетках высших организмов порядок формирования инициаторного комплекса несколько отличается – с малой субъединицей рибосомы вначале связываются метионил-тРНКi, а затем уже к рибосоме присоединяется молекула mРНК.
Процесс элонгации полипептидной цепи катализируют специфические белки – у эукариот EF1 и EF2, у прокариот EF-Тu и EF-G. Кроме того, для осуществления синтеза необходима энергия, которая доставляется в рибосомы в виде ГТФ. Прежде чем включиться в синтез белков, активированные в форме аминоацил-тРНК аминокислоты образуют комплексы со специфическими белками EF1 и ГТФ и в таком виде проникают в рибосому. Однако с соответствующим в mРНК кодоном, следующим за инициаторным кодоном, может комплементарно присоединяться только аминоацил-тРНК, имеющая необходимый антикодон. После присоединения к mРНК данного антикодона происходит высвобождение из комплекса белкового фактора EF1, которое сопровождается гидролизом ГТФ (рис. 52).
Второй этап элонгации полипептидной цепи заключается в образовании пептидной связи между аминокислотными остатками метионина и другой аминокислоты, присоединённой через антикодон тРНК к следующему кодону mРНК. Направление размещения кодонов в mРНК происходит от 5'-конца к 3'-концу, а направление образования пептидных связей в синтезирующемся пептиде от N-конца к С-концу. Образование пептидной связи катализирует фермент пептидилтрансфераза, которая входит в состав большой субъединицы рибосомы. Энергия, необходимая для синтеза полипептидной связи, высвобождается в результате расщепления макроэргической связи между остатком аминокислоты и тРНК. Образование пептидной связи под действием пептидилтрансферазы можно записать в виде следующей реакции:
O O O O
|| || || //
H2N- CH-C
тРНКi + H2N- CH-C
тРНК2 ¾® H2N- CH-C-N-CH-C
тРНК2
| | ↘ | | | | | |
R1 R2 тРНКi R1 H R2
Третий этап процесса элонгации полипептилной цепи получил название транслокации. Этот этап катализирует белковый фактор IF2 в комплексе с ГТФ, под действием которого рибосома перемещается вдоль молекулы mРНК в направлении от 5' к 3'-концу на три нуклеотидных остатка, включая в сферу реакции присоединения аминоацил-тРНК следующий кодон. В ходе этой реакции, которая сопровождается гидролизом ГТФ, происходит высвобождение белкового фактора IF2 и выход из рибосомы тРНКi, а синтезированный дипептид остаётся связанным с тРНК2, присоединённой водородными связями к своему кодону в составе mРНК.
После этого уже к третьему кодону может присоединиться соответствующая тРНК, связанная со своим аминокислотным остатком, который соединяется новой пептидной связью с синтезированным дипептидом. Затем повторяется акт транслокации и рибосома снова перемещается на один кодон, к которому может уже присоединиться с помощью тРНК следующий аминокислотный остаток и т.д., пока не будет синтезирована полностью полипептидная цепь, закодированная в виде последовательности кодонов в структуре mРНК. При этом последовательность соединения аминокислотных остатков в синтезированной полипептидной цепи будет определяться последовательностью кодонов в mРНК-матрице.
По мере продвижения рибосомы вдоль молекулы mРНК в ходе синтеза полипептидной цепи происходит высвобождение её конца, содержащего инициаторный кодон. И на нём начинается образование нового инициаторного комплекса и активной рибосомы, которая будет осуществлять синтез новой полипептидной цепи на одной и той же mРНК-матрице. В результате одновременного взаимодействия с одной и той же молекулой mРНК нескольких рибосом образуется полирибосома. В зависимости от линейных размеров mРНК полирибосома может включать от 3-5 до нескольких десятков рибосом. За счёт образования полирибосом значительно повышается эффективность использования клеткой mРНК, так как на одной молекуле mРНК с помощью присоединённых к ней рибосом одновременно может синтезироваться несколько полипептидных цепей (по числу рибосом в полирибосоме).
Синтез полипептидной цепи продолжается до тех пор, пока на пути движения рибосомы по mРНК не встретится терминирующий кодон. Как было указано ранее (табл. 14), имеются три терминирующих кодона – УАГ, УГА и УАА. Они не кодируют аминокислотные остатки, но служат сигналами для прекращения синтеза полипептидной цепи. Эти кодоны способны узнавать специфические белки, называемые факторами терминации: у бактерий существуют два таких белковых фактора –RF1 и RF2, у высших организмов – один (RF- по-английски release factor).
Когда терминирующий кодон оказывается в составе рибосомы, с ним связывается белковый фактор терминации (рис. 53), который катализирует гидролитическое расщепление сложноэфирной связи, соединяющей синтезированную полипептидную цепь с последней тРНК, комплементарно связанной своим антикодоном с соответствующим кодоном mРНК. В результате гидролиза этой связи синтезированный полипептид отделяется от рибосомы, а освобожденный от полипептидной цепи рибосомный комплекс диссоциирует с образованием свободных субъединиц рибосомы, mРНК, свободных белковых факторов терминации трансляции и оставшейся последней молекулы тРНК, от которой была отделена синтезированная полипептидная цепь. В дальнейшем они могут снова принять участие в синтезе новой молекулы белкового полипептида.
После отделения синтезированной полипептидной цепи от рибосомы она приобретает свойственную ей пространственную структуру в соответствии с последовательностью соединения в ней аминокислотных остатков. Образовавшиеся в процессе трансляции полипептиды под действием соответствующих ферментов подвергаются посттрансляционному процессингу, в ходе которого они превращаются в функционально активные белки, имеющие характерную для них нативную конформацию молекул.
В результате процессинга от белковых полипептидов специфическими протеазами могут отщепляться концевые фрагменты их полипептидных цепей. Возможна также модификация аминокислотных радикалов (например, превращение остатков пролина в остатки оксипролина), образование дисульфидных связей, фосфорилирование остатков серина или тирозина и др. В связи с тем, что процесс трансляции осуществляет довольно сложный по структуре нуклеопротеидный комплекс, скорость синтеза полипептидной цепи существенно ниже, чем скорость образования молекул нуклеиновых кислот. В клетках бактерий с участием функционально активных рибосом за 1 мин может синтезироваться полипептидная цепь, включающая 300-400 аминокислотных остатков, а у растений и животных – полипептид, содержащий 30-50 радикалов аминокислот.
Таким образом, в ходе синтеза белков осуществляется перенос генетической информации, закодированной в виде последовательности кодонов в ДНК, на структуру белков, с помощью которых в клетке осуществляются все биохимические процессы. Процесс передачи генетической информации от ДНК на белки можно представить в виде следующей схемы:
-ААГ-АГТ-АТА -АЦГ-ГТА- последовательность кодонов в ДНК
-УУЦ-УЦА-УАУ-УГЦ-ЦАУ- комплементарная ей последовательность
нуклеотидов в mРНК
-Phe – Ser – Tyr – Cys – His - последовательность аминокислотных остатков в
синтезированном полипептиде
В процессе синтеза mРНК на ДНК-матрице последовательность дезоксирибонуклеотидных остатков ДНК переводится в последовательность рибонуклеотидных остатков mРНК. После осуществления процессинга и сплайсинга функционально активные молекулы mРНК связываются с рибосомами и используются в качестве биологических матриц для синтеза полипептидов. Выстраивание на mРНК-матрице аминокислотных остатков происходит с помощью тРНК, которые, присоединив аминокислотный остаток к ЦЦА-концу, переносят его в рибосому на основе комплементарного присоединения своего антикодона к соответствующему кодону mРНК. В результате синтеза полипептидных связей на mРНК-матрице образуется полипептидная цепь, в которой последовательность соединения аминокислотных остатков определяется последовательностью кодонов в mРНК.
В этом процессе чрезвычайна важна роль тРНК. Именно с помощью своего антикодона каждая тРНК, соединяясь комплементарно с кодоном, определяет место аминокислотному остатку в синтезирующейся полипептидной цепи. Учитывая, что существует 61 значащий кодон в молекулах ДНК и mРНК, можно было ожидать и наличие такого же числа тРНК, имеющих соответствующие кодонам антикодоны. Однако обычно клетки организмов в процессе синтеза белков используют меньшее число типов тРНК. Это связано с тем, что при спаривании в ходе синтеза полипептидов кодонов с антикодонами допускаются определённые отклонения от принципа комплементарности, которые характерны для последних нуклеотидных остатков на 3'-конце кодона и 5'-конце антикодона.
Первые два нуклеотидных остатка в кодоне и антикодоне спариваются без отклонений от принципа комплементарности. Третий же нуклеотидный остаток в антикодоне, оканчивающийся на Г, может при взаимодействии с кодоном соединяться с У или Ц. Если третий нуклеотидный остаток на 5'-конце антикодона представлен Ц или А, то он спаривается комплементарно с соответствующим нуклеотидным остатком кодона. Однако если третий нуклеотидный остаток в антикодоне представлен У, то он может спариваться с А или Г соответствующего кодона.
Исходя из выше указанных особенностей спаривания кодонов и антикодонов, мы видим, что в отдельных случаях один антикодон, может спариваться с двумя кодонами, которые отличаются нуклеотидными остатками на 3'-конце, в связи с чем общее число антикодонов, используемых в синтезе полипептидов, может быть меньше существующего числа кодонов. Так, например, в клетках растений для осуществления трансляции используются 37 типов тРНК.
Следует отметить, что процесс переноса генетической информации от ДНК или РНК на белки необратим. Для того чтобы реализовать обратный процесс, потребовалось бы иметь не менее сложную биологическую систему, чем система синтеза белков. Однако такой системы в организмах не существует. Поэтому обратный перенос информации от белков к РНК и ДНК никогда не наблюдался в живых организмах и, по-видимому, невозможен.
На синтез белков затрачивается очень большое количество энергии, которое доставляется в виде АТФ и ГТФ. При активировании каждой аминокислоты затрачивается 1 молекула АТФ, которая подвергается гидролизу до АМФ и Н4Р2О7, затем на стадии инициации синтеза полипептидной цепи в процессе образования способной к синтезу белка рибосомы затрачивается энергия гидролиза ГТФ до ГДФ и Н4Р2О7. В ходе элонгации полипептидной цепи при каждом акте включения в рибосому аминоацил-тРНК и каждой транслокации также затрачивается энергия, высвобождающаяся при гидролизе ГТФ. Как было показано ранее, значительное количество энергии требуется для синтеза mРНК.
Подтверждением правильности представленных выше молеку-лярных механизмов трансляции является создание искусственных бесклеточных систем синтеза белков. Так, например, для синтеза растительных белков в системе in vitro очень часто используют бесклеточный ферментный экстракт из зародышей пшеницы, содержащий молекулы тРНК и ферменты синтеза белков, к которому добавляют аминокислоты, АТФ, ГТФ, очищенные растительные рибосомы и функционально активные mРНК. В указанной бесклеточной системе синтезируются белки, первичная структура которых закодирована в молекулах mРНК. Если в бесклеточную систему синтеза белка добавляют mРНК из созревающих зерновок кукурузы – синтезируется запасной белок зерна кукурузы зеин , а если добавляют mРНК из созревающих семян гороха – образуется легумин гороха. Соответственно с участием mРНК созревающих зерновок ячменя синтезируется гордеин.
В цитоплазме растительных клеток синтез белков осуществляют цитоплазматические 80S-рибосомы, в хлоропластах и митохондриях – рибосомы этих внутриклеточных органелл.
|
|
|
 Скачать 4.12 Mb.
Скачать 4.12 Mb.
