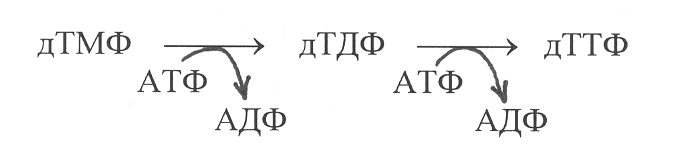|
|
Лекции биохимия 3. Лекция Обмен липидов
Перенос информации от РНК к РНК. У большинства растительных вирусов и некоторых вирусов животных основным наследственным материалом служит не ДНК, а молекулы РНК. При размножении этих вирусов осуществляется репликация молекул РНК, в ходе которой на родительской цепи РНК на основе комплементарного синтеза образуется полинуклеотидная цепь дочерней РНК с последовательностью нуклеотидных остатков, комплементарной родительской РНК. Синтез молекул РНК на РНК-матрице катализирует фермент, называемый РНК-зависимой РНК-полимеразой, или РНК-репликазой. Для РНК-зависимого синтеза РНК в качестве субстратов используются молекулы рибонуклеозидтрифосфатов.
Перенос информации от РНК к ДНК. Такой перенос информации наблюдается в животных клетках, инфицированных некоторыми вирусами. Наиболее хорошо изучен механизм синтеза ДНК на РНК-матрицах у ретровирусов, содержащих в качестве генетического материала одноцепочечные молекулы РНК.
Попадая в клетку животного, инфекционные частицы ретровируса с помощью содержащегося в них фермента обратной транскриптазы синтезируют ДНК-копию на РНК-матрице, а на вновь синтезированной цепи ДНК катализируют образование комплементарной цепи ДНК, которая при взаимодействии с родительской цепью формирует двойную спираль ДНК, содержащую такую же генетическую информацию, как одноцепочечные молекулы РНК ретровируса.
Затем двойная спираль ДНК-копии ретровируса внедряется в ядерную ДНК животной клетки и вместе с ней подвергается репликации, передавая из поколения в поколение генетическую информацию РНК ретровирусных частиц. В ходе транскрипции ядерной ДНК, содержащей ДНК-копии ретровируса, синтезируются mРНК ретровирусных белков, а также новые одноцепочечные молекулы РНК генома ретровируса, которые, формируя белковую оболочку, превращаются в инфекционные частицы ретровируса.
Очищенные препараты обратной транскриптазы вирусных частиц находят применение в экспериментах по синтезу генов, в которых в качестве матрицы для образования ДНК служат молекулы mРНК. При использовании в качестве матрицы химически модифицированных молекул РНК с помощью фермента обратной транскриптазы возможен также синтез искусственных генов.
Синтез нуклеотидов
Для синтеза нуклеиновых кислот, коферментных нуклеотидных группировок ферментов, макроэргических нуклеозидполифосфатов необходимы пуриновые и пиримидиновые нуклеотиды. Продуктами их первичного синтеза являются соответствующие рибонуклеотиды, из которых в дальнейшем в результате восстановительных реакций образуются дезоксирибонуклеотиды.
П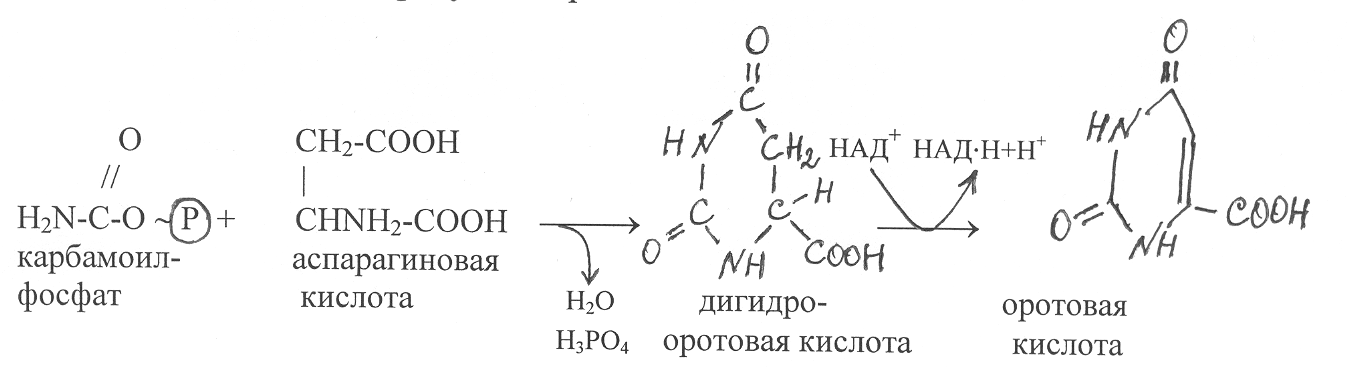
иримидиновые рибонуклеотиды синтезируются из аспарагиновой кислоты и карбамоилфосфата, на образование которого используются аммонийный азот, бикарбонат-ионы и молекулы АТФ (стр. …). Под действием фермента карбамоилтрансферазы карбамоильная группировка карбамоилфосфата переносится на остаток аспарагиновой кислоты и в результате отщепления молекулы воды из указанных компонентов синтезируется молекула дигидрооротовой кислоты. На следующем этапе дигидрооротовая кислота окисляется флавиновым ферментом, который отщепляет от неё атомы водорода и переносит их на окисленные динуклеотиды НАД+. В результате этой реакции образуется оротовая кислота:
Д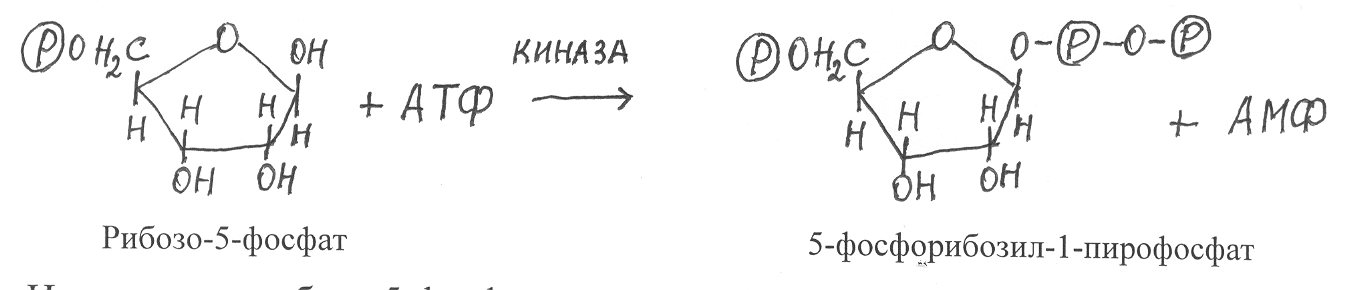
алее в реакции вступает рибозо-5-фосфат, который вначале активируется путём фосфорилирования от АТФ и превращается в 5-фосфо-рибозил-1-пирофосфат:
Источником рибозо-5-фосфата для синтеза нуклеотидов служат реакции цикла Кальвина и пентозофосфатного цикла.
О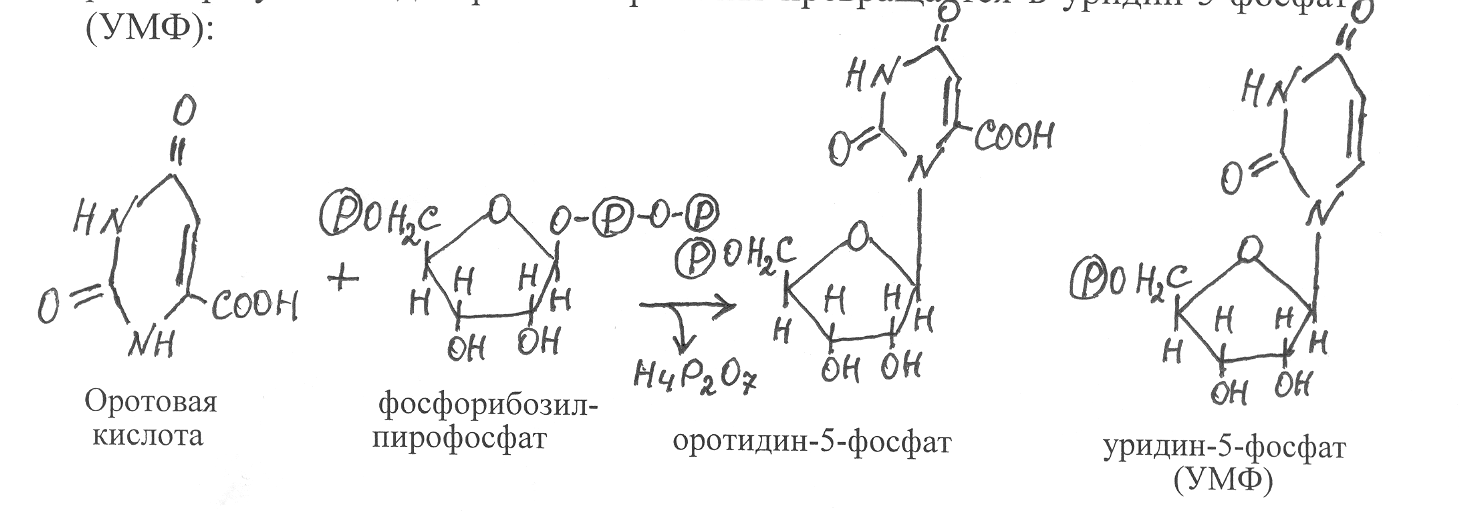
бразовавшийся фосфорибозилпирофосфат при взаимодействии с оротовой кислотой даёт первичный нуклеотид – оротидин-5-фосфат, который в результате декарбоксилирования превращается в уридин-5-фосфат (УМФ):
В ходе реакций фосфорилирования из УМФ синтезируются УДФ (уридиндифосфат) и УТФ (уридинтрифосфат):
АТФ АТФ
УМФ ¾® УДФ ¾® УТФ
-АДФ -АДФ АТФ
АДФ АДФ
Необходимый для синтеза РНК ЦТФ (цитидинтрифосфат) образуется из УТФ в результате аминирования азотистого основания в составе нуклеотида. Донором аминной группы служит амидная группировка гдутамина. Реакция аминирования сопряжена с гидролизом АТФ до АМФ.
Исходным соединением для синтеза пуриновых нуклеотидов, как и пиримидиновых, служит фосфорибозилпирофосфат, к которому присоединяются радикалы глутамина, глицина, аспарагиновой кислоты, углеродсодержащие группировки СО2, формил- и метенилтетрагидрофолиевой кислоты. В ходе довольно сложных превращений постепенно в соединении с фосфорибозильным радикалом строится структура азотистого основания. На ряде этапов построение гетероциклической группировки азотистого основания сопряжено с гидролизом АТФ.
Первичным пуриновым нуклеотидом, который синтезируется в процессе указанных выше превращений, является инозиновая кислота (ИМФ). Два атома углерода азотистого основания ИМФ гипоксантина включены в его гетероциклическую группировку из молекул глутамина (амидный азот), один атом азота из аспарагиновой кислоты и ещё один атом азота из аминной группы глицина. Кроме того, глицин является также донором двух атомов углерода. Ещё два атома углерода гипоксантина происходят от от формильных группировок 5,10-метенилтетрагидрофолиевой кислоты (5,10-метенил-ТГФК) и 10-формилтетрагидрофолиевой кислоты (10-формил-ТГФК). Донором карбонильной группы гипоксантина является СО2.
В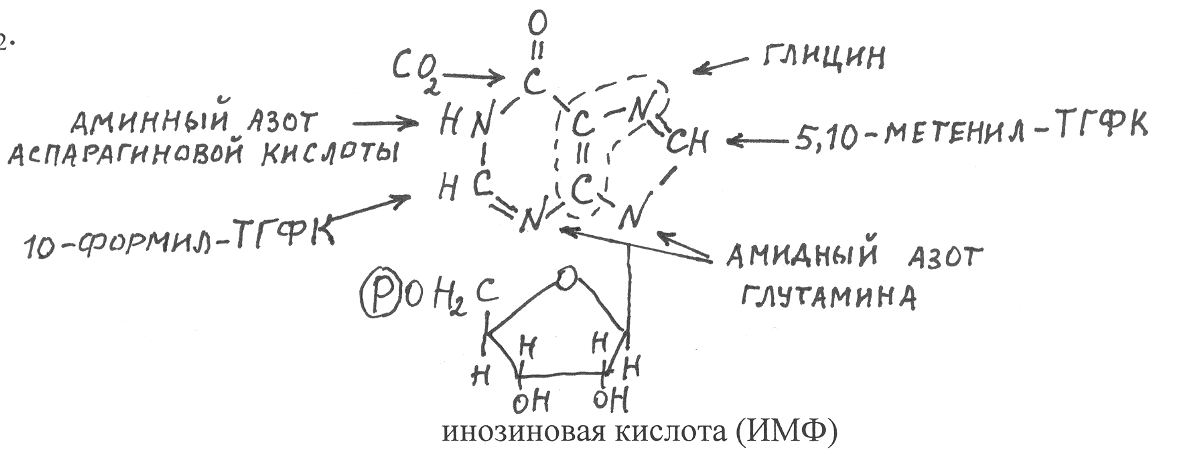
результате аминирования от аспарагиновой кислоты в ходе двухэтапного превращения из инозиновой кислоты синтезируется адениловая кислота. В связи с тем, что эта реакция эндергоническая, она сопряжена с гидролизом ГТФ. При окислении инозиновой кислоты НАД-зависимой дегидрогеназой происходит её превращение в ксантиловую кислоту, которая далее в результате аминирования от глутамина и сопряжённого гидролиза АТФ образует гуаниловую кислоту (ГМФ).
Из соответствующих монофосфатов далее синтезируются дифосфат- и трифосфатпроизводные пуриновых нуклеотидов. АДФ и АТФ образуются в результате субстратного или окислительного фосфорилирования АМФ:
АМФ ¾¾® АДФ ¾¾® АТФ
Н3РО4↓ Н3РО4↓
Н2О Н2О
По аналогичной схеме в результате фосфорилирования от АТФ из ГМФ синтезируются ГДФ и ГТФ:
ГМФ ¾¾® ГДФ ¾¾® ГТФ
АТФ↓ АТФ↓
АДФ АДФ
Таким образом, нами рассмотрены механизмы образования пиримидиновых и пуриновых рибонуклеотидов и их трифосфатпроизводных, необходимых для синтеза рибонуклеиновых кислот и использования в качестве макроэргических соединений.
Дизоксирибонуклеотиды образуются из дифосфатпроизводных (у некоторых организмов из трифосфатов) рибонуклеотидов при их восстановлении ферментом рибонуклеотидредуктазой, который переносит ко второму углеродному атому рибозы водород от восстановленной формы белка тиоредоксина.
Б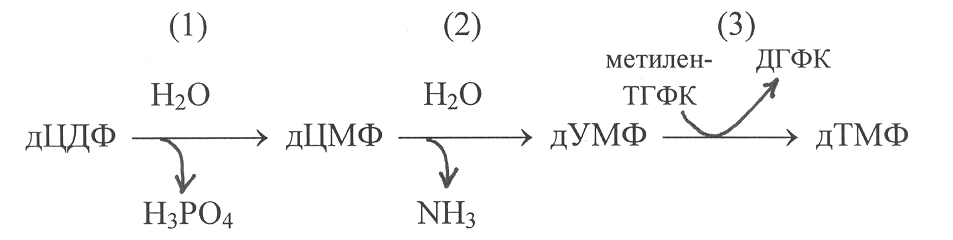
олее сложным путём осуществляется синтез дезокситимидиловой кислоты. У эукариотических организмов исходным соединением для её образования служит дезоксицитидиндифосфат (дЦДФ). Превращение дЦДФ в дезокситимидиловую кислоту (дТМФ) осуществляется по следующей схеме:
В первой реакции происходит гидролитическое отщепление от дЦДФ фосфорной кислоты, во второй реакции – дезаминирование цитозиновой группировки в составе нуклеотида и превращение её в остаток урацила. Более сложное превращение происходит на третьем этапе, которое катализирует фермент тимидилатсинтетаза. Под действием этого фермента осуществляется метилирование остатка урацила в нуклеотиде с участием метилентетрагидрофолиевой кислоты и превращение его в остаток тимина.
В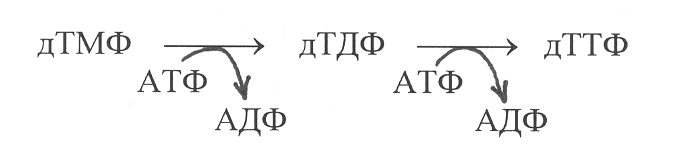
результате последующего фосфорилирования от АТФ дТМФ образуется дизокситимидинтрифосфат (дТТФ), необходимый для синтеза ДНК:
В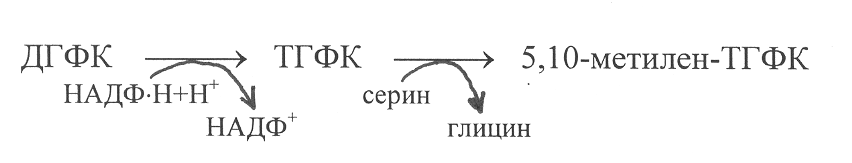
ажным этапом в синтезе дезокситимидиловой кислоты является обратное превращение дигидрофолиевой кислоты в метилентетрагидрофолиевую кислоту. На первом этапе дигидрофолиевая кислота восстанавливается в тетрагидрофолиевую кислоту под действием фермента дигидрофолатредуктазы. Донорами электронов и протонов в этой реакции служат восстановленные динуклеотиды НАДФ×Н. А далее уже другой фермент серинтрансоксиметилаза переносит на тетрагидрофолиевую кислоту формильный остаток от серина, превращая последний в глицин.
Ферменты тимидилатсинтетаза и дигидрофолатредуктаза, существенно влияющие на скорость образования тиминовых нуклеотидов, являются активными инициаторами синтеза ДНК. При понижении их активности замедляется или прекращается образование дезокситимидиловой кислоты, что далее вызывает прекращение синтеза ДНК. Подбирая эффективно действующие ингибиторы этих ферментов, можно при необходимости направленно подавлять синтез ДНК в клетках организма. Такие ингибиторы положены в основу химиотерапии рака, так как способны подавлять развитие раковых клеток, в которых интенсивно происходит синтез ДНК.
10.12. Процессы распада нуклеиновых кислот,
нуклеотидов и белков.
В клетках организмов постоянно происходит расщепление полинуклеотидов на олиго- и мононуклеотиды с участием ферментов, называемых нуклеазами. Ранее уже рассматривалось действие различных нуклеаз, участвующих в процессах репарации ДНК, процессинге и сплайсинге РНК-транскриптов, быстрой деградации молекул mРНК. Нуклеазы катализируют гидролиз фосфодиэфирных связей в молекулах РНК и ДНК, а также их ферментов и в зависимости от расщепляемого субстрата эти ферменты называют рибонуклеазами или дезоксирибонуклеазами.
Отдельные нуклеазы очень сильно различаются по специфичности действия и образуемым продуктам. Известны нуклеазы, обладающие невысокой специфичностью. Они способны катализировать гидролиз фосфоэфирных связей в одноцепочечных фрагментах РНК и ДНК с образованием олиго- и мононуклеотидов, имеющих на 5'-конце фосфатные группировки. К таким ферментам относится нуклеаза S1, выделенная из Aspergillus oryzae.
Неспецифические рибонуклеазы могут действовать на двухцепочечные участки РНК с образованием 5' или 3'-фосфорилированных олигонуклеотидов. Например, рибонуклеаза III Е. coli гидролизует двутяжевые участки в молекулах РНК, образуя в качестве конечных продуктов 3'-фосфорилированные олигонуклеотиды. Неспецифические дезоксирибонуклеазы гидролитически расщепляют двухцепочечные ДНК на олиго- или мононуклеотиды, имеющие фосфатные группировки на 5' или 3'-конце. Например, дезоксирибонуклеаза I из поджелудочной железы животных расщепляет двуспиральные молекулы ДНК на олигонуклеотиды, которые фосфорилированы по 3'-концам.
Специфические нуклеазы осуществляют направленный гидролиз полинуклеотидов, распознавая при своём действии или определённые нуклеотидные радикалы, или специфические последовательности нуклеотидных остатков в молекулах РНК или ДНК. Так, гуаниловая рибонуклеаза Т1 актиномицетов направленно гидролизует фосфодиэфирные связи в одноцепочечных РНК между остатками гуаниловой кислоты и любыми другими нуклеотидными остатками с образованием олигонуклеотидов, имеющих на 3'-конце остатки гуанозин-3- фосфата.
Среди специфических дезоксирибонуклеаз наиболее хорошо изучены рестриктазы, которые рапознают в молекулах ДНК специфические последовательности из 4-6 нуклеотидных остатков. Они расщепляют двухцепочечные молекулы ДНК на строго определённые фрагменты. В качестве примера можно рассмотреть действие рестриктазы Eco RI из клеток E. сoli. Этот фермент распознаёт в двуспиральной ДНК комплементарную нуклеотидную последовательность и гидролитически расщепляет межнуклеотидные связи в положениях, указанных стрелками.
¯
ГААТТЦ
ЦТТААГ
В результате действия этого фермента образуется специфический набор двухцепочечных фрагментов ДНК, содержащих на 5'-концах остатки фосфорной кислоты. В связи с высокой специфичностью действия рестриктазы широко используются для выяснения структуры нуклеиновых кислот.
Под действием набора разных нуклеаз нуклеиновые кислоты гидролизуются до свободных нуклеотидов, которые далее подвергаются распаду с участием гидролитических и окислительных ферментов.
С учасием нуклеотидаз нуклеотиды гидролизуются до нуклеозидов, которые далее под действием нуклеозидфосфорилазы подвергаются фосфоролизу, превращаясь в свободные азотистые основания и фосфорилированные остатки пентозы в виде рибозо-1-фосфата или дизоксирибозо-1-фосфата. Распад нуклеиновых кислот до азотистых оснований может быть представлен в виде следующей схемы.
нуклеазы нуклеотидазы
нуклеиновые кислоты ¾¾¾® нуклеотиды ¾¾¾® нуклеозиды ¾®
Н2О Н2О
нуклеозидфосфорилазы
¾¾¾¾¾¾¾® азотистые основания +рибозо-1-фосфат (дезоксирибозо-1-фосфат)
Н3РО4
Фосфорилированные пентозы включаются в углеводный обмен, а азотистые основания могут включаться в два типа биохимических процессов – вновь вступать в синтез нуклеотидов или подвергаться дальнейшему распаду.
П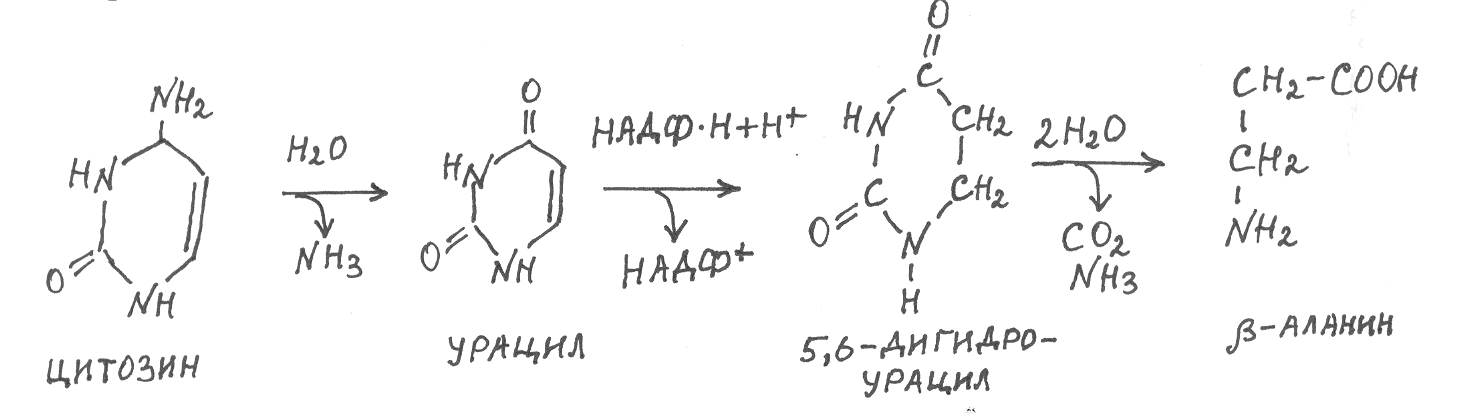
од действием ферментов фосфорибозилтрансфераз все азотистые основания, кроме тимина, способны взаимодействовать с фосфорибозилпирофосфатом и снова включаться в рибонуклеотиды, которые далее используются для синтеза нуклеиновых кислот. В ходе распада азотистых оснований цитозин в результате гидролитического дезаминирования превращается в урацил, который восстанавливается НАДФ×Н в 5,6-дигидроурацил, а последний подвергается гидролити-ческому расщеплению с образованием b-аланина, СО2 и NH3:
В свою очередь b-аланин может подвергаться окислительному расщеплению и превращаться в малонил-КоА, который при декарбок-силировании даёт ацетил-КоА. А возможные пути метаболизма малонил-КоА и ацетил-КоА нам уже известны.
Тимин в процессе распада подвергается таким же превращениям, как и урацил, только вместо b-аланина образуется b-аминоизобутират, который окислительным путём превращается в метилмалонил-КоА и далее в сукцинил-КоА, а последний включается в дыхательные реакции.
H2N-CH2-CH-COOH ¾® HOOC-CH-CO
S-КоА ¾® НООС-СН2-СН2-CO
S-КоА
| | сукцинил-КоА
CH3 CH3
b-аминоизобутират метилмалонил-КоА
П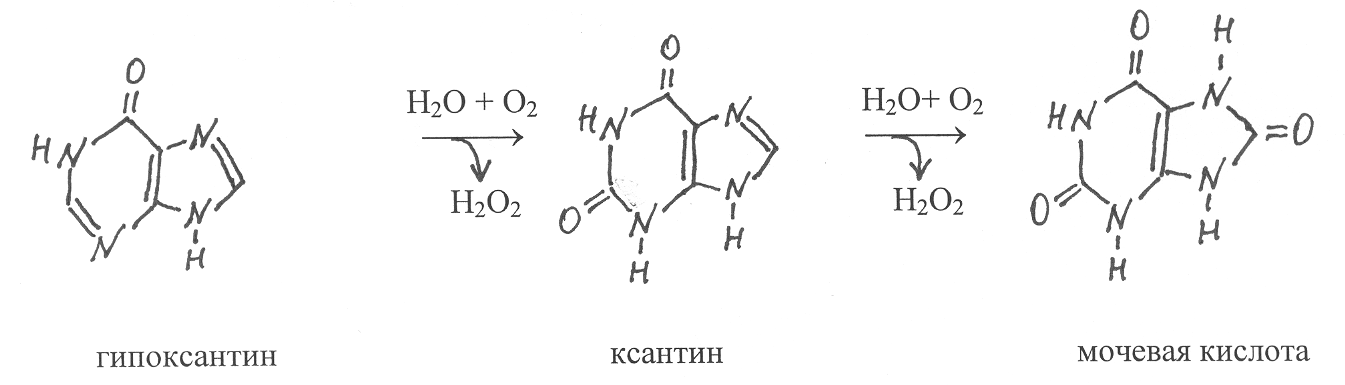
уриновые основания аденин и гуанин, подвергаясь гидролитическому дезаминированию, превращаются соответственно в гипоксантин и ксантин. Металлосодержащий флавиновый фермент ксантиноксидаза (1.2.3.2) окисляет гипоксантин в ксантин и далее ксантин в мочевую кислоту. Коферментом в молекуле этого фермента является ФАД, ассоциированный с одним атомом молибдена и четырьмя атомами железа. Всего в димерной молекуле фермента содержится два ФАД, два атома молибдена и восемь атомов железа.
У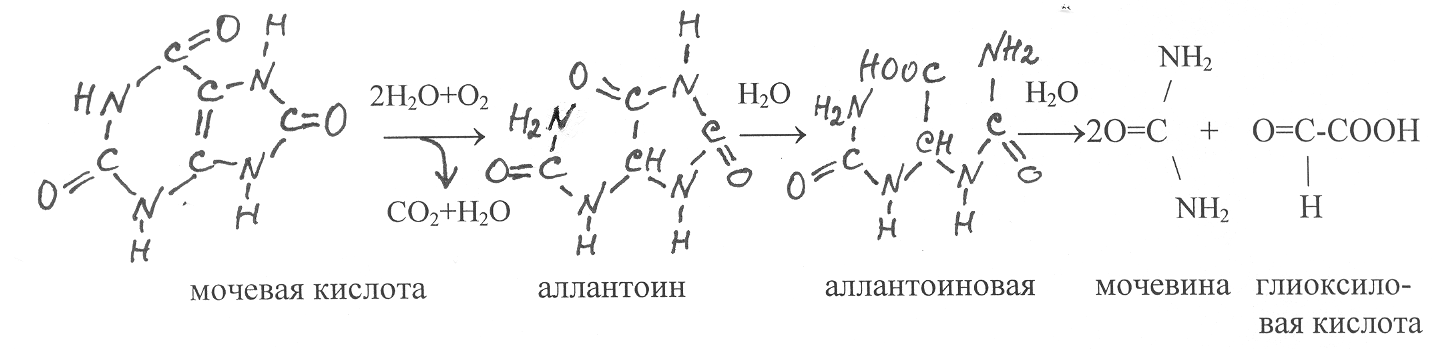
человека мочевая кислота является конечным продуктом распада пуринов, который выводится из организма. Однако у многих других организмов, включая растения, мочевая кислота окисляется в аллантоин. Эту реакцию катализирует медьсодержащий фермент уратоксидаза (1.7.3.3).
Аллантион в значительном количестве содержится в проростках, молодых побегах и пасоке некоторых растений. С участием фермента аллантоиназы (3.5.2.5) аллантоин гидролизуется с образованием аллантоиновой кислоты, которая также широко распространена в растениях. В клетках растений, плесневых грибов и многих рыб аллантоиновая кислота гидролитически разлагается на мочевину и глиоксиловую кислоту. Эту реакцию катализирует фермент аллантоиказа (3.5.3.4).
Таким образом, пуриновые основания в растительных клетках в результате гидролитических и окислительных реакций так же, как и в орнитиновом цикле, превращаются в мочевину, которая может затем использоваться в метаболизме азотистых веществ по уже известным нам механизмам. Следует отметить, что при высоком содержании в пище человека или кормах животных нуклеиновых кислот в результате диссимиляции пуриновых нуклеотидов образуется много мочевой кислоты, которая у этих организмов является конечным продуктом распада пуриновых оснований. При этом создаётся опасность возникновения мочекаменных заболеваний, вызванных отложением натриевых и кальциевых солей мочевой кислоты.
Распад белков.
В растительном организме постоянно происходят процессы синтеза и распада белков. Особенно интенсивному обмену подвергаются функционально активные белки и, прежде всего, белки-ферменты. По мере инактивации ферментных белков их молекулы гидролитически расщепляются протеолитическими ферментами. Кроме того, существуют специальные механизмы биодеградации и других функционально активных белков – регуляторных, транспортных, иммуноспецифических и др. В активно функционирующих клетках синтез белков и их деградация находятся в динамическом равновесии. Процесс восполнения белковых молекул, подвергнутых деградации, называют обновлением белка.
Процессы распада белков активизируются при старении растений, когда интенсивность синтеза в них азотистых веществ ослабляется, но усиливается расщепление белков листьев и других вегетативных органов до аминокислот, которые перемещаются в репродуктивные органы и используются в них для образования структурных, ферментных и запасных белков.
Интенсивное расщепление запасных белков происходит при прорастании семян, клубней, корнеплодов. В их тканях очень быстро нарастает активность протеолитических ферментов, под действием которых молекулы запасных белков быстро деградируют до пептидов и свободных аминокислот, необходимых для новообразования азотистых веществ в тканях проростков. Высокая протеолитическая активность обнаруживается также в дрожжах и плесневых грибах. Изменение активности протеолитических ферментов при прорастании зерна ячменя показано на рисунке .
Процессы распада белков и других веществ усиливаются при повреждении тканей растений. В неповреждённых тканях интенсивно проходит обмен веществ и процессы синтеза преобладают над распадом. Как было указано ранее, для осуществления биосинтеза белков необходимо поддержание целостности внутриклеточных структур, а при их деградации новообразование белковых молекул прекращается. Протеолитические ферменты способны функционировать в жидкой физиологической среде в растворённом состоянии. При этом для осуществления распада белков не требуется большого количества энергии, наоборот, в таких условиях свободная энергия уменьшается, что свидетельствует о возможности самопроизвольного хода указанных реакций.
Распад белков начинается со структурной деградации их молекул под действием специфических редуктаз, расщепляющих дисульфидные связи, что приводит также к разрыву части водородных связей и обеспечивает более лёгкую доступность к изменённой молекуле белка протеолитических ферментов, которые гидролизуют белковые полипептиды до свободных аминокислот. Протеолитические ферменты, или протеазы, подразделяются на две группы: протеиназы и пептидазы.
Протеиназы – однокомпонентные ферменты, катализирующие расщепление пептидных связей в белках и пептидах с образованием более низкомолекулярных полипептидных фрагментов и определённого количества свободных аминокислот. Большинство протеиназ действуют направленно, расщепляя пептидные связи, соединяющие определённые аминокислотные радикалы. Например, хорошо известная растительная протеиназа папаин подвергает гидролизу преимущественно пептидные связи, в образовании которых участвуют радикалы основных, алифатических и ароматических аминокислот. Протеиназа, выделяемая слизистой оболочкой желудка человека и называемая пепсином, избирательно катализирует гидролиз пептидных связей, соединяющих в белках и пептидах остатки тирозина и фенилаланина с другими аминокислотными радикалами.
В растениях различают два вида протеиназ, одни из них содержат в активном центре сульфгидрильную группу (НS-группу) и поэтому их называют тиоловыми протеиназами. Другие растительные протеиназы не содержат в активном центре тиоловых группировок и они по строению каталитического центра имеют сходство с протеиназами животного происхождения – пепсином и трипсином.
+2Н
Ф-S-S-Ф ¾¾® Ф-SH + Ф-SH
¬¾¾
-2Н восстановленная
окисленная восстановленная
форма фермента форма фермента
форма фермента
Характерное свойство тиоловых протеиназ – их способность акти-вироваться цианидами и сульфгидрильными соединениями, содержащими НS-группы (цистеин, восстановленный глютатион и др.). Указанные соединения переводят окисленную форму фермента в восстановленную, которая и обладает гидролитической активностью. Схематически процесс восстановления тиоловых протеиназ можно представить следующим образом:
Под действием окислителей фермент переходит в окисленную дисульфидную форму.
Типичными представителями этих ферментов являются папаин, выделенный из сока плодов дынного дерева; бромелаин, полученный из плодов и стеблей ананаса; фицин, содержащийся в млечном соке фигового дерева. В листьях многих растений найдены протеиназы, активируемые сульфгидрильными соединениями. К тиоловым протеиназам также относятся многие протеолитические ферменты, выделяемые из пшеничного солода. Из семян и плодов многих растений выделены также нетиоловые протеиназы. К ним относятся арвенсин из семян гороха; арахаин, содержащийся в семенах арахиса; соланаин, выделенный из плодов паслёна. К этой же группе ферментов относятся протеиназы многих грибов.
Пептидазы катализируют гидролиз пептидных связей в пептидах. Существуют три разновидности этих ферментов: аминопептидазы, карбоксипептидазы и дипептидазы.
Аминопептидазы гидролитически отщепляют от молекул пептидов N-концевые аминокислотные остатки, образуя соответствующие аминокислоты:
O H Н
|| | H2O |
H2N–CH–C–N–CH–C–N–Rn ¾¾® H2N–CH–COOH + H2N–CH–C–N– Rn
| | | || | | ||
R1 H R2 O R1 R2 O
гидроли-
зуемая связь
Карбоксипептидазы отщепляют аминокислотные остатки от С-кон-цов полипептидов:
O
|| H2O
Rn–C–N–CH–COOH ¾¾® Rn–COOH + H2N–CH–COOH
| | |
½Н R R
гидролизуемая
связь
Дипептидазы осуществляют гидролиз пептидной связи в дипептидах:
O
|| H2O
H2N–CH–C–N–CH–COOH ¾¾® H2N–CH–COOH + H2N–CH–COOH
| | | | |
R1 H R2 R1 R2
Известны различные дипептидазы. Так, например, глицилглицинпептидаза (3.4.13.11) гидролизует дипептид глицилглицин на две молекулы глицина, а фермент пролиназа (3.4.13.8) расщепляет дипептиды, у которых в образовании пептидной связи участвует карбоксильная группа пролина.
Пептидазы в большинстве своём металлосодержащие ферменты, которые могут проявлять каталитическую активность при различных условиях физиологической среды в зависимости от места локализации в органах и тканях растений и клетках других организмов. При совместном действии всего комплекса протеолитических ферментов белки гидролизуются до свободных аминокислот, которые могут быть снова использованы для образования белковых молекул, синтеза нуклеотидов и других азотистых веществ или включаться в процессы распада по уже известным нам механизмам.
Сведения об активности протеолитических ферментов имеют важное практическое значение. Особенно они важны при оценке качества продукции зерновых культур. На ранних стадиях созревания зерновок злаковых культур в них наюлюдается высокая активность протеолитических ферментов. Однако при созревании в зерновках усиливается синтез белков – эндогенных ингибиторов протеаз, которые связывают ферментные белки в неактивные комплексы, в результате чего к моменту полного созревания зерна в нём почти не обнаруживается протеолитическая активность. Связывание протеаз в неактивные комплексы может также осуществляться запасными белками зерна и мембранными структурами клеток.
Однако при влажных условиях во время созревания зерна ослабляется синтез запасных белков и белков – ингибиторов протеаз, вследствие чего к концу созревания в зерновках остаётся повышенная протеазная активность. И если такое зерно используется для приготовления хлеба, то в процессе формирования теста под действием протеолитических ферментов происходит значительная деградация молекул запасных белков, что приводит к ослаблению клейковинного комплекса. В результате понижается газоудерживающая способность и усиливается разжижение теста, вследствие чего снижается качество выпекаемого хлеба. При использовании зерна с повышенной протеазной активностью для производства макарон и крупы также наблюдается ухудшение качества этих продуктов вследствие ослабления комплекса их клейковинных белков.
При поражении зерна клопом-черепашкой ухудшение его качества происходит в результате того, что эти насекомые вводят в созревающие зерновки активный комплекс протеолитических ферментов, вызывающих деградацию белков зерна, и прежде всего клейковинных белков. От действия протеолитических ферментов в значительной степени зависит и качество солода, которое получают из проросшего зерна.
Вопросы для повторения:
1. Какой нуклеотидный состав имеют ДНК и РНК? 2. Как установлена генетическая роль ДНК? 3. В чём состоят правила Чаргаффа? 4. Каково строение молекул ДНК? 5. В виде каких структурных образований находятся молекулы ДНК в хромосомах высших и низших организмов? 6. Каковы строение и биологическая роль рибосомной, транспортной и матричной РНК? 7. Как был расшифрован генетический код? 8. Какими основными свойствами обладает генетический код? 9. Какое биологическое значение имеет вырожденность генетического кода? 10. Каков механизм синтеза (репликации) ДНК? 11. Какие известны сведения о ферментах, катализирующих синтез ДНК? 12. Какова вероятность ошибок при синтезе ДНК и как происходит защита от этих ошибок? 13. В чём заключается механизм транскрипции ДНК? 14. Какие биохимические реакции происходят в ходе транскрипции? 15. В чём состоят особенности синтеза матричной, рибосомной и транспортной РНК? 16. Как осуществляется регуляция синтеза РНК? 17. В чём состоит механизм процессинга в ходе образования функционально активных молекул РНК? 18. Какова роль рибосомных, матричных и транспортных РНК в синтезе белковых полипептидов? 19. Как осуществляются процессы образования полипептидов с участием функционально активных рибосом? 20. По каким механизмам возможен перенос генетической информации от РНК к РНК и от РНК к ДНК? 21. Какие происходят биохимические превращения при синтезе пиримидиновых и пуриновых нуклеотидов? 22. Как происходит образование дезоксирибонуклеотидов? 23. С участием каких ферментов происходит распад нуклеиновых кислот и нуклеотидов и какие при этом образуются промежуточные и конечные продукты? 24. Какие биохимические механизмы реализуются в ходе распада белков? 25. В чём заключаются особенности действия ферментов, катализирующих распад белков? 26. Как влияют протеолитические ферменты на качество растительной продукции.
Резюме по модульной единице 10. В клетках организмов содержится два вида нуклеиновых кислот – ДНК и РНК. Молекулы нуклеиновых кислот представляют собой длинные цепочки, состоящие и нуклеотидных остатков, которые соединены через остатки ортофосфорной кислоты фосфодиэфирными связями. ДНК содержится в вирусах, клетках низших организмов (прокариот) и в ядрах клеток высших организмов (эукариот), а также в митохондриях хлоропластах высших организмов. В цитоплазме прокариот и эукариот содержатся малые кольцевые ДНК. РНК в основном локализованы в цитоплазме клеток, где они являются главными факторами, инициирующими синтез ферментов и других белков.
Молекулы ДНК содержат генетическую информацию, определяющую наследственные свойства организмов. Эта информация записана в виде набора и последовательности кодонов, каждый из которых представляет собой последовательность из трёх нуклетидных остатков и кодирует определённый аминокислотный остаток в стуктуре белкового полипептида. Уотсон Д. и Крик Ф. Установили, что молекула ДНК представляет собой двойную правозакрученную спираль, состоящую из двух полинуклеотидных цепей, которые закручены между собой и вокруг общей оси. Цепи ДНК в результате специфики образования водородных связей имеют комплементарное строение. В ядрах клеток высших организмов молекулы ДНК в комплексе с белками-гистонами упакованы в виде упорядоченных структур – нуклеосом.
В организмах синтезируется три вида РНК – рибосомная (рРНК), информационная, или матричная (мРНК), и транспортная (тРНК). Рибосомная РНК локализована в рибосомах. Она содержит информацию о структуре рибосомных белков, в комплексе с которыми формирует рибосомы цитоплазмы клеток, а также внутриклеточных органелл – митохондрий и хлоропластов. Основная функция матричной РНК – копирование нуклеотидных последовательностей ДНК, кодирующих структуру белков, и участие совместно с рибосомами и тРНК в синтезе белков. Транспортная РНК избирательно связывает аминокислоты, переносит их к рибосомам и включает в синтез белковых полипептидов.
Синтез ДНК катализируют ферменты ДНК-полимеразы, синтез РНК – РНК-полимеразы в комплесе с другими ферментами и кофакторами. В ходе синтеза ДНК, называемого репликацией, благодаря комплементарному присоединению нуклеотидных остатков образуются новые молекулы ДНК, которые идентичны ДНК родительских клеток. Синтез РНК в клетках организмов называют транскрипцией. Он регулируется специфическими белками. В процессе транскрипции осуществляется копирование определённых участков нуклеотидных последовательностей ДНК, которые комплементарны ДНК-матрице. С участием трёх видов РНК происходит синтез белковых полипептидов. Рибосомные РНК формируют структуру рибосом, с которыми связывается матричная РНК. Транспортные РНК избирательно связывают в виде активированных комплексов аминокислотные остатки и включают их в синтезируемые полипептидные цепи на основе комплементарных взаимодействий антикодонов тРНК с кодонами мРНК. Синтезируемые в ядрах клеток РНК-транскрипты подвергаются процессингу и последующему сплайсингу под действием соответствующих ферментов. В ходе процессинга из РНК-транскрипта удаляются не кодирующие белки участки – интроны, а оставшиеся кодирующие фрагменты соединяются в процессе сплайсинга и образуют зрелые молекулы РНК, участвующие в синтезе белковых полипептидов.
Синтез белковых полипептидов начинается с присоединения остатка метионина к инициаторному кодону в составе инициаторного комплекса, который включает мРНК, связанную с малой субъединицей рибосомы, и белковые факторы инициации синтеза белков. После присоединения к инициаторному комплексу большой субъединицы рибосома вступает в стадию элонгации полипептидной цепи, в ходе которой к остатку метионина последовательно присоединяются другие аминокислотные остатки с образованием пептидных связей. При этом рибосома движется вдоль полинуклеотидной цепи мРНК в направлении от 5'-конца к 3'-концу. Синтез полипептида прекращается при достижении рибосомой терминирующего кодона в цепи мРНК. В ходе синтеза белков осуществляется перенос генетической информации от ДНК к РНК и далее на белки. У большинства растительных вирусов основным генетическим материалом является не ДНК, а РНК, поэтому у них осуществляется перенос информации от РНК к РНК.
Пиримидиновые нуклеотиды синтезируются из аспарагиновой кислоты, карбамоилфосфата, рибозы и остатков фосфорной кислоты, источниками которых служат молекулы АТФ. В синтезе пуриновых нуклеотидов участвуют молекулы глутамина, аспарагиновой кислоты, глицина, СО₂, производные фолиевой кислоты. Донорами фосфатных остатков служат молекулы АТФ. Дезоксирибонуклеотиды образуются из рибонуклеотидов в результате восстановления остатков рибозы ферментом рибонуклеотидредуктазой. Распад нукленовых кислот катализируют гидролитические ферменты рибонуклеазы и дезоксирибонуклеазы. Нуклеотиды гидролизуются под действием нуклеотидаз, а образующиеся из них нуклеозиды с участием нуклезидфосфорилаз превращаются в азотистые основания и фосфаты рибозы или дезоксирибозы. При распаде пуриновых оснований важными промежуточными продуктами являются аллантоин, аллантоиновая и мочевая кислоты.
Гидролиз белковых полипептидов катализируют ферменты протеиназы, направленно расщепляющие определённые полипептидные связи с образованием полипептидов, которые далее подвергаются действию пептидаз. Дисульфидные связи в белках расщепляют специфические редуктазы с образованием восстановленных тиоловых групп. При совокупном дествии всего указанного выше набора ферментов белки расщепляются до аминокислот. Сведения об активности протеолитических ферментов используются при оценке качества растительной продукции.
Тестовые задания к лекции. Тесты № 253-283.
Лекция 9. Биохимические основы качества растительной продукции.
Аннотация. Рассматриваются основные группы веществ вторичного происхож-дения и их влияние на качество растительной продукции. Изучется химический состав основных сельскохозяйственных растений и влияние условий выращивания и режимов питания на накопление полезных веществ в растительных продуктах. Излагаются биохимические основы формирования качества урожая сельскохозяйственных культур.
Ключевые слова: вторичные метаболиты, оксибензойные кислоты, оксикоричные кислоты, кумарины, флавоноидные соединения, лигнин, дубильные вещества, меланины, хинная кислота, шикимовая кислота, хоризмовая кислота, терпеноидные соединения, эфирные масла, мевалоновая кислота, алкалоиды, гликозиды, сердечные гликозиды, гликоалкалоиды, клейковина, индекс деформации клейковины, запасные белки, сильная пшеница, слабая пшеница, высоколизиновые генотипы; химический состав зерна и семян злаковых, зернобобовых, масличных культур, клубней картофеля, корнеплодов, овощей, плодов и ягод, вегетативной массы кормовых трав; влияние природно-климатических факторов, орошения, режимов питания растений на качество и безопасность растительной продукции, пути улучшения качества растительной продукции.
Рассматриваемые вопросы:
Фенольные соединения.
Терпеноидные соединения и эфирные масла.
Алкалоиды и гликозиды сельскохозяйственных растений.
Биохимические основы формирования качества растительной продукции.
Модульная единица 11. Вещества вторичного происхождения.
Цели и задачи изучения модульной единицы.
Изучить строение, свойства и биологические функции различных групп вторичных метаболитов растений. Научить студентов использовать сведения о веществах вторичного происхождения при оценке качества и безопасности растительной продукции.
В растениях существуют специальные ответвления биохимических путей для синтеза целого ряда веществ, которые, как правило, не подвергаются интенсивному метаболизму и определяют специфику обмена веществ, как у отдельных групп растений, так и у растений в целом. Эти химические соединения принято называть веществами вторичного происхождения, или вторичными метаболитами.
Они содержатся в продуктовых органах многих растений и влияют на качество растительной продукции. Обладая тонизирующими свойствами, некоторые группы этих веществ определяют вкусовые и пищевые достоинства растительной продукции (алкалоиды, гликозиды, некоторые фенольные соединения). Другие группы вторичных метаболитов находят применение в парфюмерии (эфирные масла, гликозиды), медицине (алкалоиды, гликозиды, некоторые фенольные вещества), технике (растения способные накапливать каучук и гутту).
Рассмотрим наиболее важные и распространённые группы веществ вторичного происхождения: фенольные и терпеноидные соединения, алкалоиды, гликозиды.
11.1. Фенольные соединения.
Фенольные соединения широко распространены в растениях. Известно более двух тысяч различных представителей этой группы веществ. Все они содержат в молекуле ароматическое ядро, в котором один или больше атомов водорода замещены на гидроксильные группы.
Некоторые фенольные соединения принимают активное участие в метаболизме растений. Уже известные нам пластохиноны служат переносчиками электронов и протонов в электронтранспортной цепи хлоропластов. Убихиноны выполняют аналогичные функции в системе окислительного фосфорилирования, локализованной во внутренней мембране митохондрий. Важными фенольными производными являются жирорастворимые витамины, токоферолы, менахиноны и филлохиноны. Оксикоричные кислоты являются активаторами ростовых процессов у растений.
Другие разновидности фенольных соединений обладают Р-витаминной активностью (катехины, некоторые флавонолы) или окрашивают плоды, листья, лепестки цветков (антоцианы, флавоны и флавонолы). Некоторые фитоалексины, защищающие растения от патогенов, также относятся к производным фенолов. Полифенольные соединения служат веществами–антиоксидантами. Они быстро вступают во взаимодействие с кислородом и таким образом защищают от окисления другие вещества в тканях растений. Фенольные группировки способны также гасить свободнорадикальные реакции, происходящие в ходе окисления веществ. Полимерные фенольные соединения выполняют структурную и защитную функции (лигнин, дубильные вещества).
Различают три группы фенольных соединений: оксибензойные кислоты, оксикоричные кислоты и кумарины, флавоноидные соединения. При взаимодействии простых фенольных соединений образуются их полимерные производные: лигнин, дубильные вещества, меланины.
К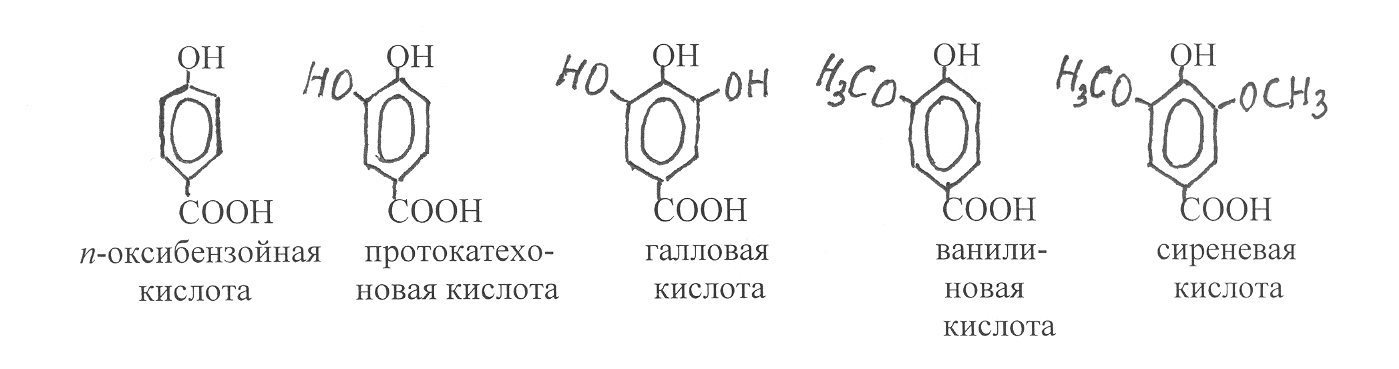
важнейшим представителям оксибензойных кислот относятся n-оксибензойная, протокатеховая, галловая, ванилиновая и сиреневая кислоты:
Протокатеховая и галловая кислоты содержатся в растениях как в свободном, так и связанном состоянии, а n-оксибензойная, ванилиновая и сиреневая кислоты являются продуктами распада полимерного фенольного соединения - лигнина. Альдегидное производное ванилиновой кислоты ванилин в виде гликозида содержится в плодах ванили. Как вещество, обладающее приятным запахом, оно используется в кондитерской промышленности. Ванилин также определяет аромат коньяка. Он образуется при окислении кониферилового спирта, содержащегося в древесном материале дубовых бочек.
Оксикоричные кислоты встречаются в растениях как в свободном, так и связанном состояниях. Наибольшей биологической активностью обладают их цис-изомеры, которые активируют ростовые процессы. В связанном состоянии они могут своей карбоксильной группой образовывать сложные эфиры с шикимовой и хинной кислотами, а также некоторыми алифатичес-кими кислотами. Основные оксикоричные кислоты растений – n-оксикорич-н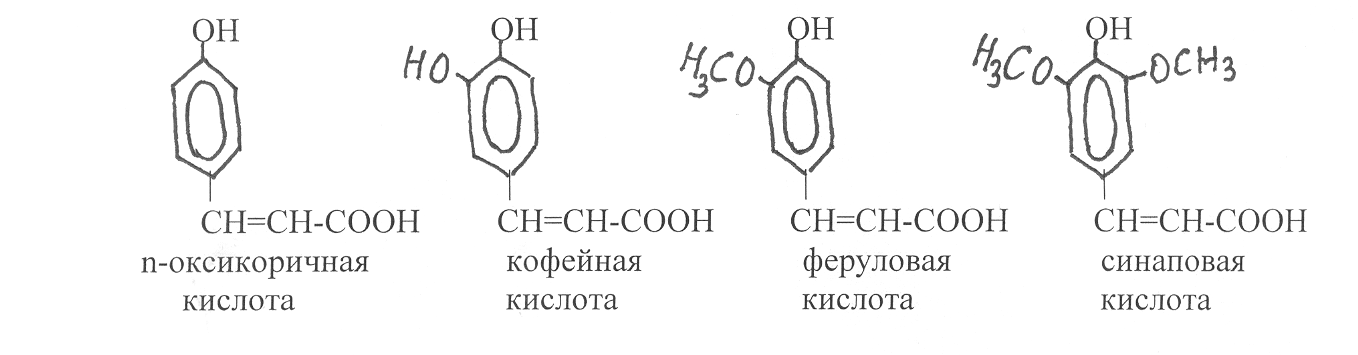
ая (n-кумаровая), кофейная, феруловая, синаповая кислоты:
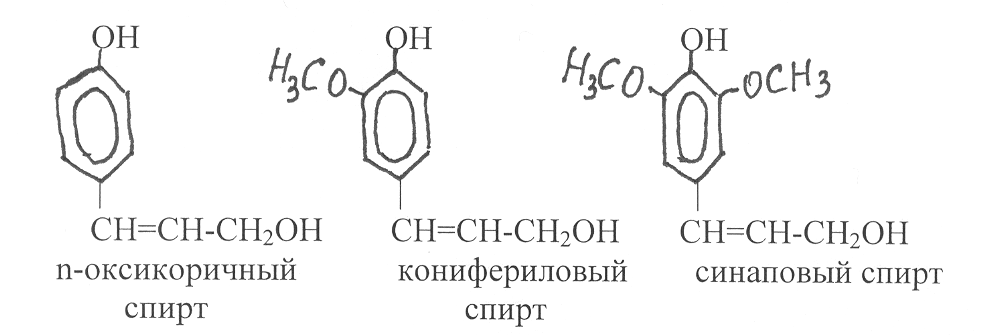
Производные оксикоричных кислот - n-оксикоричный, конифериловый и синаповый спирты - участвуют в синтезе лигнина:
Н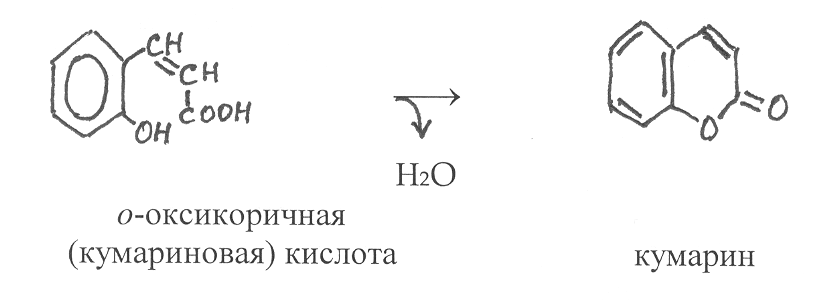
аряду с n-оксикоричной в растениях содержится также о-окси-коричная кислота. Её цис-измер самопроизвольно превращается в циклический лактон – кумарин:
К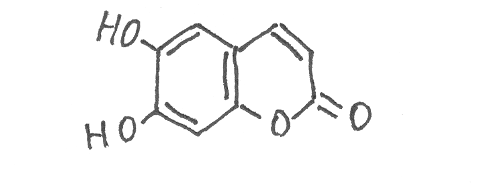
умарин душистое вещество с запахом сена, содержится в растениях в свободном виде, а также в виде глюкозида, используется в парфюмерии. Во многих растениях найдены гидроксилированные производные кумарина, которые в виде глюкозидов могут накапливаться в цветках и плодах растений. Наиболее известным из них является эскулетин:
Ф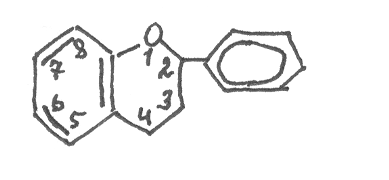
лавоноидные соединения являются производными флавана, в молекуле которого имеются два бензольных ядра, с одним из которых соединяется кислородсодержащая циклическая группировка:
В зависимости от степени окисления кислородсодержащей циклической группировки флавоноидные соединения подразделяют на шесть основных групп: катехины, лейкоантоцианы, флаваноны, антоцианы, флавоны и флавонолы. Конкретные представители флавоноидных соединений содержат заместители, присоединённые к ароматическим ядрам и кислородсодержащей циклической группировке, образуют гликозиды с моно- и олигосахаридами.
К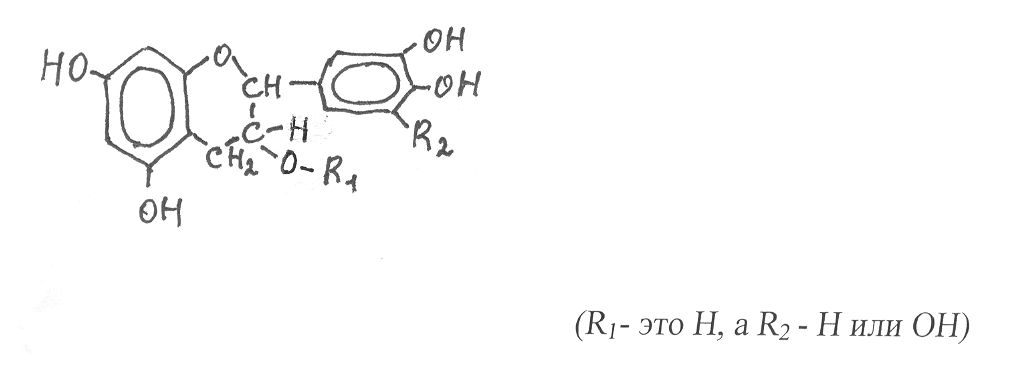
атехины благодаря наличию двух асимметрических атомов углерода в составе кислородсодержащей циклической группировки присутствуют в растениях в виде четырёх пространственных изомеров, содержащих в качестве заместителей гидроксильные группы. Строение катехинов можно представить следующей формулой:
В растениях наиболее распространены катехин (правовращающий) и эпикатехин (левовращающий), у которых радикалы R1 и R2 замещены на водород. В меньшем количестве содержатся галлокатехин (правовращающий) и эпигаллокатехин (левовращающий), у них радикал R1 замещается на Н, R2 – на гидроксил.
Значительная часть катехинов связывается в виде эфиров с галловой кислотой, которая взаимодействует с гидроксилом циклической кислородсодержащей группировки (R1 замещается на остаток галловой кислоты). Катехины легко окисляются и могут подвергаться полимеризации с образованием продуктов, обладающих характерной золотисто-красной окраской и приятным слабо вяжущим вкусом. Они также проявляют высокую Р-витаминную активность. Много содержится катехинов в различных плодах и ягодах. Но особенно ими богаты листья чая (до 30% от сухой массы).
Склонность катехинов к окислению и полимеризации используется в производстве чёрного чая. Ферментация чайных листьев проводится таким образом, что в ходе взаимодействия катехинов образуются димерные продукты, обладающие характерным для чая вкусом и цветом и в значительной степени сохраняющие Р-витаминную активность.
Л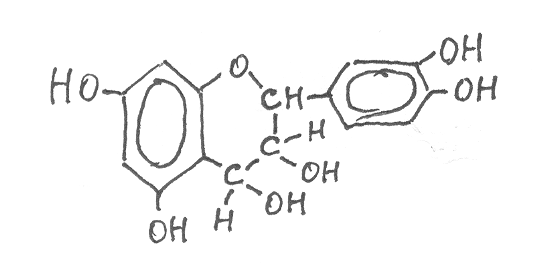
ейкоантоцианы – продукты дальнейшего окисления катехинов путём введения в циклическую кислородсодержащую группировку в качестве заместителя второй гидроксильной группы. Наиболее известным представителем лейкоантоцианов является лейкоцианидин:
Лейкоантоцианы так же, как и катехины, легко окисляются и образуют продукты полимеризации в виде конденсированных дубильных веществ (стр. 313).
А
нтоцианы – внепластидные пигменты, содержатся в вакуолях и окрашивают лепестки цветков, листья и плоды растений в розовый, коричневый, синий, голубой, фиолетовый и пурпурный цвет. В растениях они представлены в форме гликозидов, в которых остатки моносахаридов соединяются с фенольными компонентами, называемыми антоцианидинами. В антоцианидинах кислородсодержащая циклическая группировка модифицирована таким образом, что в ней появляются двойные связи, а атом кислорода, имеющий положительный заряд, способен присоединять кислотные анионы и образовывать соли. Строение антоцианидинов может быть представлено следующей формулой:
Наименования антоцианидинов происходят от названий цветков, из которых они выделены. Цвет синих васильков определяет пигмент, включающий в качестве агликона цианидин, у которого R1 в указанной формуле замещается на Н, а R2 – на гидроксил. В пелларгонидине из цветков красной герани R1 и R2 замещаются на водород, а в дельфинидине – на гидроксил. В пеонидине R1 представлен водородом, а R2 – оксиметильной группой; в петунидине R1 представлен гидроксилом, а R2 – оксиметильной группой; в мальвидине оба радикала замещаются на оксиметильные группы.
Остатки моносахаридов в гликозидах антоцианов присоединяются в положении 3 кислородсодержащей группировки и положении 5 ароматического ядра. Они представлены разными моносахаридами: глюкозой, рамнозой, арабинозой, галактозой. Например, антоциан василька цианин представляет собой гликозид, в котором агликон цианидин в 3 и 5 положениях соединён с двумя остатками глюкозы.
Обычно в растении содержится набор антоцианов, который включает остатки определённых моносахаридов, соединённых с одним или даже несколькими антоцианидинами. В некоторых растениях найдены антоцианы, содержащие ацилированные моносахаридные остатки. Антоциановая окраска зависит от количества гидроксильных и метильных групп в составе антоцианидина, набора моносахаридных остатков, образования комплексных солей с катионами металлов, а также от рН физиологической среды. Катионы К⁺ обусловливают пурпурную окраску, Ca⁺ и Mg⁺ – синюю, метилирование – пурпурную.
Ф
лаваноны присутствуют в растениях в виде гликозидов, особенно их много содержится в кожуре плодов цитрусовых. Наиболее распространены три вида флаванонов – нарингенин, эриодиктиол и гесперетин. Их строение можно записать следующей формулой:
В флаваноновых гликозидах к флаванону в положении 7 присоединяются один или два моносахаридных остатка. В кожуре апельсинов и мандаринов содержится гликозид гесперидин (до 8% сухой массы), у которого агликоном является флаванон гесперетин, соединённый в положении 7 с остатком дисахарида, образованного b-D-глюкозой и a-L-рамнозой через a(1®6)-связь (стр. ). А в кожуре грейпфрута накапливается гликозид нарингин, в составе которого имеется флаванон нарингенин, также соединённый в положении 7 с остатками b-D-глюкозы и a-L-рамнозы. Но между этими моносахаридными остатками образуется уже другая гликозидная связь через второй углеродный атом b-глюкозы. Гликозид гесперидин обладает Р-витаминной активностью, а нарингин придаёт горький вкус.
Флавоны являются дегидропроизводными флаванонов. Они имеют двойную связь в циклической кислородсодержащей группировке. А при введении в качестве заместителя в эту группировку гидроксильной группы
образуются флавонолы.
Флавоны и флавонолы – жёлтые красящие вещества растений, содержатся в виде гликозидов. У флавонов моносахаридные остатки присоединяются в положение 7 главного ароматического ядра (показано стрелкой), у флавонолов – в положение 3 гетероциклической группировки. К наиболее известным флавонам относятся апигенин (в формуле R1 и R2 замещаются на водород), лютеолин (R1 замещается на –ОН, R2 – на Н) и трицин (R1 и R2 замещаются на ОСН3). Из флавонолов широко распространены в растениях кемпферол (R1 и R2 замещаются на водород), кверцетин (R1 замещается на Н, R2 – на -ОН), мирицетин (R1 и R2 замещаются н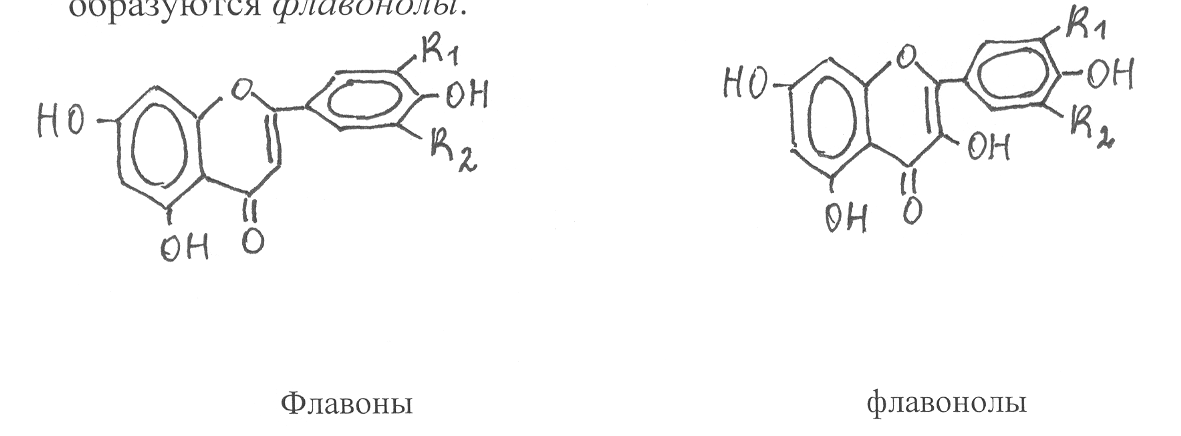
а ОН).
флавоны флавонолы
Очень распространённым в растениях гликозидом кверцетина является рутин, у которого к молекуле флавонола присоединяется дисахарид, состоящий из остатков b-D-глюкозы и a-L-рамнозы (стр. …). Рутин обладает Р-витаминной активностью. В листьях чая и цветках астрагала найден гликозид астрагалин, представляющий собой производное кемпферола и b-глюкозы.
|
|
|
 Скачать 4.12 Mb.
Скачать 4.12 Mb.