Лекции биохимия 3. Лекция Обмен липидов
 Скачать 4.12 Mb. Скачать 4.12 Mb.
|
(P) + CO2 + H2O ¾® CO-COOH ¾¾¾® CHOH-COOH
(P) CH2 NH2Синтез мочевины В клетках растений существует ещё один дополнительный механизм обезвреживания избыточной аммонийной формы азота – связывание его в виде мочевины, которая синтезируется в реакциях орнитинового цикла, впервые изученного в 1932 г. в клетках животных Кребсом Н.А. и Хензелайтом К. Много мочевины накапливается в клетках растений, имеющих на корнях микоризу. Высокое содержание мочевины найдено в шампиньонах и дождевиках (до 10-13 % сухой массы). В опытах было отмечено, что концентрация мочевины в клетках растений увеличивается при диссимиляции азотистых веществ, когда активируются процессы дезаминирования аминокислот и азотистых оснований, а также при выращивании растений на растворах аммонийных солей. Мочевина не токсична для клеток растений , так как является нормальным продуктом обмена веществ, который легко включается в биосинтетические реакции. Первый этап в синтезе мочевины – образование макроэргического соединения карбамоилфосфата из гидрокарбоната и глутамина, являющегося источником аминной группировки, под действием фермента карбамоилфосфатсинтазы (2.7.2.5). Реакция сопряжена с гидролизом двух молекул АТФ и активируется катионами Mg2+: O О СООН // Mg2+ \\ | HCO3¯ + C–NH2 + 2АТФ ¾¾® С–О |
| карбамоил- |
CHNH2 фосфат CHNH2
| |
COOH COOH
орнитин цитруллин
Таким образом, уреидогруппа цитруллина образуется из карбонильной группы бикарбоната и амидной группы глутамина, которая синтезируется в результате связывания избыточного аммиака.
Далее цитруллин реагирует с аспарагиновой кислотой под действием фермента аргининосукцинатсинтетазы (6.3.4.5). В активировании уреидогруппы цитруллина принимают участие АТФ и катионы Mg2+. В ходе этой реакции синтезируется аргининоянтарная кислота.
CH2NH CH2NH COOH CH2NH COOH
| \ | \ | | \ |
CH2 С=О COOH CH2 C=N–CH CH2 C=NH CH
| | | Mg2+ | | | | | ||
CH2 NH2 + CHNH2 + АТФ ¾® CH2 NH2 CH ¾® CH2 NH2 + CH
| | ↓ | | | | |
CHNH2 CH2 АМФ CHNH2 COOH CHNH2 COOH
| | Н4Р2О7 | | фумаровая
COOH COOH COOH COOH кислота
цитруллин аспарагиновая аргининоянтарная аргинин
кислота кислота
Затем аргининоянтарная кислота с участием фермента аргининосук-цинатлиазы (4.3.2.1) расщепляется на два продукта – аргинин и фумаровую кислоту. Последняя, присоединяя молекулу аммиака под действием аспартатаммиаклиазы, превращается снова в аспарагиновую кислоту, способную взаимодействовать с новой молекулой цитруллина. А аргинин в орнитиновом цикле путём гидролитического расщепления превращается в орнитин и мочевину. Эту реакцию катализирует фермент аргиназа (3.5.3.1):
СН2NH CH2NH2
| \ |
CH2 C+NH CH2
| | + H2O ¾® | + CO(NH2)2
CH2 NH2 CH2 мочевина
| |
CHNH2 CHNH2
| |
COOH COOH
аргинин орнитин
Высвобождающийся при гидролизе аргинина орнитин снова включается в первую реакцию орнитинового цикла и синтез мочевины может продолжаться. Схематически связывание аммиака в реакциях орнитинового цикла можно представить в виде следующих превращений:
СH2NH2 CH2NH CH2NH СH2NH2
| | \ | \ | Н2N
CH2 +NH3 + CO2 CH2 C=O +NH3 CH2 C=NH +H2O CH2 \
| ¾¾¾® | | ¾¾® | | ¾¾® | + C=O
CH2 - H2O CH2 NH2 - H2O CH2 NH2 CH2 /
| | | | Н2N
CHNH2 CHNH2 CHNH2 CHNH2 мочевина
| | | |
COOH COOH СООН COOH
Орнитин цитруллин аргинин орнитин
У некоторых растений связывание избыточного аммиака не доходит до образования мочевины, у них наблюдается накопление промежуточных продуктов орнитинового цикла – цитруллина или аргинина. В прорастающих семенах хвойных растений и клубнях топинамбура содержится много аргинина, а в корневых клубеньках ольхи, пасоке берёзы и орешника – цитруллина. У этих растений аргинин и цитруллин по-видимому являются основными продуктами связывания избыточного аммиака и они играют важную роль в обмене азотистых веществ.
10.4. Усвоение растениями азота мочевины
при некорневых подкормках.
Конечный продукт связывания аммиака в реакциях орнитинового цикла – мочевина – очень легко включается в обмен азотистых веществ растений с участием соответствующих ферментных систем. В листьях и других органах многих растений находится в активном состоянии или может активироваться мочевиной фермент уреаза, катализирующий гидролитическое разложение мочевины на диоксид углерода и аммиак:
Н2N
\ уреаза
C=O + H2O ¾® 2NH3 + CO2
/
H2N
мочевина
Затем аммиак включается в синтез аминокислот и амидов, которые далее могут участвовать в образовании молекул других азотистых веществ. Фермент уреаза найден у многих растений – огурцов, бобов, кукурузы, картофеля, томатов, сельдерея.
Однако у ряда растений уреаза отсутствует, однако они способны ассимилировать мочевину, наносимую на поверхность листьев или вводимую в ткани растений экзогенно, с помощью других ферментных систем. Из клеток дрожжей и хлореллы выделен фермент АТФ-гидролизующая уреаза (3.5.1.45), способный в присутствии АТФ и катионов Mg2+ разлагать мочевину на аммиак и диоксид углерода:
Mg2+
Н2N-С-NH2 + АТФ + 2Н2О ¾¾® 2NH3 + CO2 + AДФ + H3PO4
||
O
Вместе с тем при изучении ассимиляции мочевины листьями злаковых растений, клетками водоросли хлореллы и проростками бобовых, не имеющих уреазы, было отмечено накопление в них значительного количества аргинина и аргининоянтарной кислоты. При этом расщепление мочевины на аммиак и диоксид углерода не происходило. На основе этих данных была сформулирована гипотеза об обращении реакций орнитинового цикла при высокой концентрации в клетках растений мочевины, поступающей извне в виде некорневой подкормки, инъекций или при выращивании на среде, содержащей мочевину. Синтез аргинина и аргининоянтарной кислоты в соответствии с этой гипотезой может осуществляться по следующей схеме:
CH2NH2 CH2NH фумаровая CH2NH COOH
| H2N | \ кислота | \ |
CH2 \ CH2 C= NН CH2 C= N–CH
| + C=O ¾¾® | | ¾¾® | | |
CH2 / ↓ CH2 NH2 CH2 NH2 CH2
| H2N H2O | | |
CHNH2 мочевина CHNH2 CHNH2 COOH
| | |
COOH COOH COOH
орнитин аргинин аргининоянтарная
кислота
В результате расщепления аргининоянтарной кислоты могут далее образоваться цитруллин и аспарагиновая кислота. При этом цитруллин, превращаясь в орнитин, инициирует продолжение обращения реакций орнитинового цикла, направленное на связывание мочевины и образование аргинина, а аспарагиновая кислота является основным продуктом этих реакций, который далее включается в синтез аминокислот, белков и других азотистых веществ.
На усвоение мочевины в результате обращения реакций орнитинового цикла затрачивается метаболическая энергия, которая генерируется через усиление дыхания, наблюдаемое при таких процессах.
Понимание механизмов усвоения растениями мочевины имеет важное значение в связи с широким её использованием в качестве азотного удобрения, которое применяется как для корневого питания растений, так и в виде некорневых подкормок.
Некорневые подкормки чаще всего проводятся на пшенице и кукурузе путём опрыскивания растений раствором мочевины с помощью самолётов или при наличии технологической колеи наземными агрегатами в фазах формирования – начала молочной спелости зерна. Нанесённая на листья мочевина быстро проникает в их ткани и включается в аминокислоты и белки, увеличивая таким образом накопление в зерне запасных белков на 1-3 %.
В наших опытах с использованием мочевины, меченной 15N, показано, что азот некорневой подкормки, проведенной в фазу начала формирования зерна пшеницы, в зрелых зерновках обычно составляет около 10 % от общего белкового азота зерна. Из этого следует, что в результате поздней некорневой подкормки в зерновках пшеницы дополнительно может синтезироваться до 10 % от общей массы белков, накапливающихся в зерне. Кроме того, мочевина при поздней некорневой подкормке оказывает физиологически активное действие на растения, усиливая отток азотистых веществ из листьев в созревающие зерновки. Под действием подкормки мочевиной в зерне пшеницы существенно снижается активность a-амилаз и других гидролитических ферментов, вследствие чего улучшаются технологические свойства зерна. Благодаря применению некорневых подкормок мочевиной в поздние фазы развития растений можно значительно увеличить выход зерна пшеницы с высоким содержанием клейковины.
10.5. Восстановление нитратного азота в растениях.
В большинстве почв, особенно окультуренных, довольно активно происходит процесс нитрификации, в ходе которого аммонийная форма азота, образующаяся в почве при распаде органических остатков, а также внесённая в виде удобрений, превращается в нитраты. Поэтому большая часть азота, поступающая в растения при корневом питании представлена нитратами, которые очень легко усваиваются растениями, включаясь в синтез аминокислот. В связи с тем, что в составе аминокислот азот находится в аминной форме, нитратный азот в растениях, прежде чем включиться в состав аминокислот, подвергается восстановлению в аммонийную форму с помощью специальных ферментных систем.
Восстановление нитратного азота в аммонийный в клетках растений, водорослей, грибов и бактерий осуществляется в два этапа. На первом этапе под действием фермента нитратредуктазы происходит превращение нитратов в нитриты, а затем нитриты с участием фермента нитритредуктазы восстанавливаются с образованием аммонийной формы азота, которая используется для синтеза аминокислот и амидов. Схематически эти процессы можно представить следующим образом:
+5 2ē +3 6ē –3
NO3‾ ¾® NO2‾ ¾® NH4+
Нитратредуктазы высших растений, зелёных водорослей и грибов (1.6.6.1; 1.6.6.2; 1.6.6.3) представляют собой металлофлавопротеиды с молекулярными массами 200-330 тыс., включающие два типа субъединиц: имеющие флавиновые группировки (ФАД, ФМН) и содержащие молибденовый кофермент. Донором электронов для восстановления нитратного азота у растений служит НАД×Н, у грибов - НАДФ×Н. От восстановленных пиридиндинуклеотидов электроны и протоны переходят на флавиновую группировку нитратредуктазы. Затем электроны передаются на цитохром в557, служащий в составе фермента промежуточным переносчиком электронов от флавинового на молибденовый кофермент, а протоны высвобождаются и могут взаимодействовать с анионами кислорода, которые образуются при восстановлении нитратного азота.
Молибденовый кофермент содержит катионы молибдена, лабильно связанного с ароматической группировкой, которая нековалентно присоединяется к белковой части фермента. Катионы молибдена, обратимо изменяя степень окисления, способны акцептировать электроны от цитохрома в557 и передавать их на азот нитрата, который связывается с активным центром фермента. В результате восстановления азота нитрат превращается в нитрит, а высвобождающийся анион кислорода О2- соединяется с протонами, образуя молекулу воды. Механизм восстановления нитратов до нитритов под действием нитратредуктазы может быть представлен в виде следующей схемы:
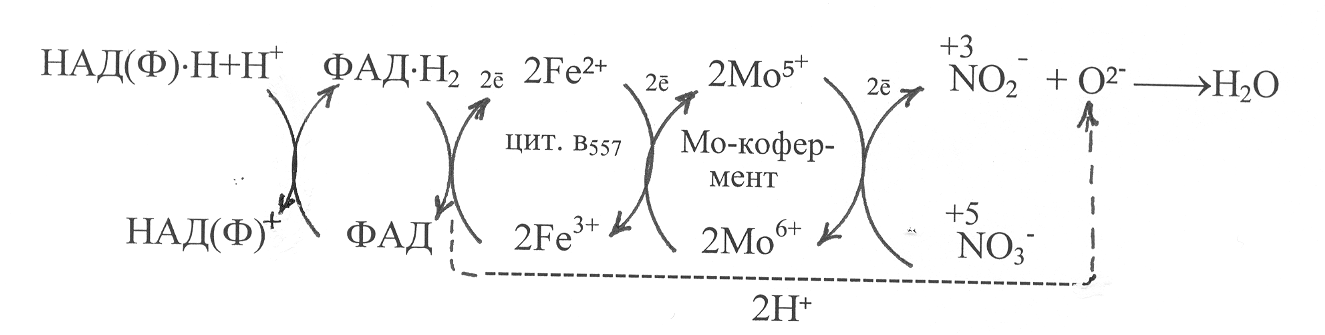
Суммарно процесс восстановления нитратов в растениях под действием фермента нитратредуктазы может быть выражен следующим уравнением:
NO3‾ + НАД×Н + Н+ ¾® NO2‾ + НАД+ + Н2О
У бактерий нитратредуктазы представлены относительно низкомолекулярными белками (70-180 тыс.), не содержащими флавиновых группировок. Донором электронов у них служит восстановленный ферредоксин или его аналоги. Нитратредуктазы бактерий тесно связаны с клеточными мембранами, тогда как у высших растений, зелёных водорослей и грибов эти ферменты локализованы в цитоплазме.
У растений наиболее высокая нитратредуктазная активность обнаруживается в меристематических тканях. У большинства растений при активном фотосинтезе и достаточном количестве углеводов, являющихся источниками образования НАД×Н, процесс восстановления нитратов практически полностью происходит в корнях. Однако при недостатке света и низких температурах, ослабляющих синтез углеводов, а также избыточном азотном питании значительная часть нитратов поступает в вегетативную часть растений и подвергается восстановлению в листьях. Вместе с тем известны растения, у которых практически не обнаруживается нитратредуктазной активности в корнях. У них превращение нитратного азота в аммонийный осуществляется в основном в листьях. К таким растениям относятся свёкла, хлопчатник, марь, дурнишник и др.
Нитратредуктаза – типичный индуцибельный фермент. Его активность резко возрастает при поступлении в растения нитратов вследствие того, что происходит индукция синтеза фермента. Когда же концентрация нитратов в клетках растений уменьшается, синтез ферментного белка прекращается и нитратредуктазная активность снова понижается до исходного уровня. Кроме нитратов, индукторами синтеза нитратредуктазы могут быть цитокинин и органические нитросоединения, то есть возможна индукция синтеза этого фермента под воздействием химических регуляторов. В то же время катионы аммония подавляют в растениях синтез нитратредуктазы. В опытах показано, что индукция синтеза нитратредуктазы в присутствии нитратов происходит на свету, а в темноте усиливается деградация этого фермента.
Активность фермента нитратредуктазы в значительной степени определяется присутствием в физиологической среде окислителей и восстановителей. В восстановительных условиях большая часть активного фермента, находящегося в окисленной форме, переводится в неактивное (восстановленное) состояние, в результате нитратредуктазная активность в тканях растений понижается. Такое явление, например, наблюдается при переносе растений в темноту. Однако при освещении растений очень быстро осуществляется фотореактивация фермента, то есть перевод его из восстановленной в окисленную форму, вследствие чего процесс восстановления нитратов снова активируется.
Восстановление нитритов в аммонийную форму азота катализируют ферменты нитритредуктазы (1.6.6.4.; 1.7.99.3). У растений и фотосинтезирующих водорослей эти ферменты представляют собой сравнительно низкомолекулярные белки (60-70 тыс.), которые содержат в качестве активных группировок железо-серный центр ( 4Fe4S) и сирогем (железотетрагидропорфирин). Донором электронов служит восстанов-ленный ферредоксин, поэтому нитритредуктазы у указанных организмов локализованы в хлоропластах.
Ферредоксин передаёт электроны на железо-серный центр нитритредуктазы, который далее восстанавливает сирогем, способный передавать электроны на атомы азота нитритов, в результате происходит присоединение к ним протонов и образование аммонийной формы азота. А высвобождающиеся анионы кислорода О2-, реагируя с катионами Н+, дают молекулы воды. Перенос электронов от восстановленного ферредоксина на нитриты с участием нитритредуктаз можно показать в виде следующей схемы:
Fdвосст. ¾® 4Fe4S ¾® сирогем ¾® NO2‾
нитритредуктаза
Суммарное уравнение процесса восстановления нитритов под действием нитритредуктазы можно записать в следующем виде:
NO2‾ + 6Fdвосст. + 8Н+ ¾® NH4+ + 6 Fdокисл. + 2Н2О
Каталитическая активность нитритредуктаз в 5-20 раз превышает активность нитратредуктазы, поэтому нитриты, как правило, не накапливаются в растениях. В корнях нитритредуктазная активность локализована в пропластидах и донорами электронов для восстановления нитритов здесь служат восстановленные динуклеотиды НАДФ×Н.
Нитритредуктазы, как и нитратредуктазы, – индуцибельные ферменты. Индукцию их синтеза вызывают нитраты, а репрессию синтеза – катионы аммония.
В отличие от нитритредуктаз фотосинтезирующих организмов аналогичные ферменты бактерий и грибов представляют собой более высокомолекулярные формы, содержащие флавиновые коферменты. Донорами электронов для них служат восстановленные динуклеотиды НАД×Н и НАДФ×Н.
Существующие разновидности растений очень сильно различаются по способности восстанавливать нитраты, которая зависит главным образом от уровня нитратредуктазной активности, тогда как нитритредуктазы – каталитически более активные ферменты. Общий уровень нитратредуктазной активности определяется, с одной стороны, интенсивностью синтеза ферментного белка, а с другой стороны, – каталитической способностью фермента.
Для усиления синтеза нитратредуктазы в растительных тканях проводятся молекулярно-генетические исследования, связанные с воздействием на регуляторные гены, оказывающие влияние на скорость синтеза ферментного белка. Одновременно с этим ведётся поиск химических регуляторов, усиливающих действие генетической системы синтеза фермента нитратредуктазы. В целях повышения каталитической активности нитратредуктазы в растительных тканях разрабатываются на молекулярном уровне способы введения в геном растений генов из клеток бактерий, кодирующих более активные молекулярные формы нитратредуктазы. Кроме того, в результате применения методов белковой инженерии предпринимаются попытки оптимизации структуры фермента путём замены отдельных нуклеотидов в структурных генах нитратредуктазы, что предопределяет синтез видоизменённого белка с повышенной каталитической активностью.
Цель таких работ – повысить эффективность использования нитратного азота для синтеза азотистых веществ и таким образом увеличить продуктивность растений. Вторая важная задача – понизить накопление нитратов, так как они потенциально опасны для человека и животных. Нитраты очень легко восстанавливаются в нитриты неферментативным путём, а последние взаимодействуют с гемоглобином, переводя его в окисленную форму – метгемоглобин, не способный осуществлять функцию транспорта кислорода, в результате чего ухудшается обеспеченность организма кислородом. Кроме того, нитриты являются химическими предшественниками нитрозоаминов, обладающих мутагенным и канцерогенным действием.
Известны группы растений, имеющие природно невысокий уровень нитратредуктазной активности, вследствие чего они накапливают высокие концентрации нитратов. К таким видам относятся растения семейства тыквенные, шпинат, редька и др. Однако у большинства растений повышение содержания нитратов наблюдается при определённых неблагоприятных условиях выращивания, связанных с недостатком световой энергии, низкой температурой, недостатком фосфора, калия, ряда микроэлементов, избыточными дозами азотных удобрений. Поэтому для каждой группы растительных продуктов установлена предельно допустимая концентрация нитратов.
При недостатке света ослабляются процессы фотосинтеза и дыхания, в результате чего понижается скорость образования восстановленных динуклеотидов и восстановленного ферредоксина, являющихся донорами электронов для восстановления нитратов, поэтому значительная часть нитратов остаётся невосстановленной и не используется для синтеза азотистых веществ растений. Аналогичное явление наблюдается в условиях пониженных температур, когда замедляются биосинтетические процессы, связанные с регенерацией доноров электронов для нитратвосстанавливающей системы, тогда как поступление нитратов в растения продолжается, вследствие чего их концентрация в растительных тканях увеличивается.
Заметное влияние на функционирование нитратвосстанавливающей системы растений оказывает обеспеченность их микроэлементами – молибденом, железом, магнием, марганцем, медью, которые служат активаторами нитратредуктазы, нитритредуктазы и других ферментов азотного обмена. Особенно важна роль молибдена, входящего в состав молибденового кофермента нитратредуктазы. При недостатке молибдена и других микроэлементов замедляется процесс восстановления нитратов и происходит их накопление в растительных продуктах. Ещё большее накопление нитратов в растениях наблюдается при внесении избыточных доз азотных удобрений, а также при низкой обеспеченности растений фосфором и калием, когда формируется низкий урожай, и в этих условиях даже умеренные дозы азотных удобрений могут оказаться избыточными.
Таким образом, для предотвращения накопления в растениях большого количества нитратов необходимо правильно разрабатывать технологию выращивания растений, обеспечивая оптимальное питание растений макро- и микроэлементами. Особенно важно контролировать уровень азотного питания при выращивании овощных и кормовых культур.
10.6. Биохимические процессы симбиотической азотфиксации.
Известны группы растений, способные за счёт симбиоза с клетками микроорганизмов использовать для синтеза своих азотистых веществ молекулярный азот, который содержится в большом количестве в земной атмосфере. Этот процесс в биологии называют симбиотической азотфиксацией. У данных растений в специальных структурных образованиях на корнях или в листьях осуществляют жизнедеятельность микроорганизмы- симбионты: клубеньковые бактерии, актиномицеты, цианобактерии (синезелёные водоросли).
Большинство растений, способных к симбиотической азотфиксации, образуют на корнях или листьях утолщённые выросты, называемые клубеньками, в которых находятся видоизменённые клетки микроорганизмов- симбионтов. Симбиотические микроорганизмы, находящиеся в клубеньках, питаются растительными метаболитами, которые образуются из поступающих в клубеньки фотоассимилятов, а продукты их жизнедеятельности, синтезируемые за счёт связывания молекулярного азота атмосферы, используются растениями для новообразования своих азотистых веществ.
На корнях многих древесных и кустарниковых растений (ольха, облепиха, восковница и др.) вырастают клубеньки, образуемые актиномицетами. Экспериментально определено, что древесные насаждения ольхи за счёт симбиотической азотфиксации способны связывать в течение одной вегетации до 100 кг/га атмосферного азота. На корнях некоторых австралийских цикадовых растений в качестве симбионтов развиваются цианобактерии, фиксирующие молекулярный азот. У некоторых растений семейств Rubiaceae и Haloragaceae цианобактерии образуют клубеньки на листьях. На рисовых полях в южных странах разводят водяной папоротник Azolla, в листьях которого осуществляют жизнедеятельность симбиотические азотфиксирующие цианобактерии. За счёт его культивирования рисовые поля обогащаются азотом.
У бобовых растений в клубеньках живут бактерии рода Rhizobium. С их участием бобовые культуры могут фиксировать в год от 50 до 600 кг/га молекулярного азота, практически полностью обеспечивая свои потребности в азотном питании. Кроме того, в результате минерализации пожнивных остатков этих культур происходит существенное обогащение почвы доступным для усвоения последующими культурами азотом. Особенно много азота могут накапливать за счёт симбиотической азотфиксации люцерна (300-500кг/га), клевер (200-300 кг/га), люпин (100-200) кг/га).
Восстановление молекулярного азота в аммиачный катализирует ферментный комплекс нитрогеназы (1.18.2.1), состоящий из двух белков. Один из них, высокомолекулярный, осуществляет непосредственно восстановление молекул азота. Он представляет собой тетрамер, состоящий из двух типов субъединиц, входящих поровну в состав тетрамерного белка (a2b2). В каждой молекуле тетрамера содержится два атома Mo, с каждым из которых взаимодействуют три 4Fe4S-кластера, образуя каталитический центр. С ним связываются молекулы азота и подвергаются восстановлению. Белковый компонент нитрогеназы, катализирующий восстановление молекулярного азота, называют Mo,Fe-белком.
В составе нитрогеназы содержится также низкомолекулярный белок, состоящий из двух одинаковых полипептидных субъединиц. Он включает в качестве активной группировки 4Fe4S-кластер и выполняет функцию восстановления Mo,Fe-белка посредством переноса электронов от восстановленного ферредоксина. В связи с тем, что низкомолекулярный компонент нитрогеназы содержит железо-серную группировку, его называют Fe,S-белком. Следует отметить, что перенос электронов от Fe,S-белка на Mo,Fe-белок сопряжён с гидролизом АТФ. С помощью молекулярных расчётов определено, что на перенос каждой пары электронов в ферментном комплексе нитрогеназы затрачивается 4-5 молекул АТФ.
Молекулярная масса Fe,S-белка клубеньков бобовых растений составляет
| Сахароза, поступающая по флоэмной системе | ® | Моноса-хариды | ® | Глико- лиз | ® | Фосфоенолпирови- ноградная кислота |
| ↓ щавелевоук- НАД×Н + Н+ яблочная кислота
COOH H3РO4 сусная кислота ↘
фосфоенол- НАД+
пировиноградная кислота
В мембране, окружающей бактероид, локализованы также ферменты, катализирующие превращение яблочной кислоты в янтарную.
В ходе реакций цикла Кребса, происходящих в бактероиде, синтезируются восстановленные динуклеотиды НАД×Н и ФАД×Н2, которые служат донорами электронов для электронтранспортной цепи системы окислительного фосфорилирования, обеспечивающей синтез АТФ по такому же механизму, как и в митохондриях. Одновременно из электронтранспортной цепи системы окислительного фосфорилирования через ферредоксин осуществляется вывод электронов на Fe,S-белки нитрогеназы, которые сопряжённо с гидролизом АТФ переносят их на активные группировки Mo,Fe-белков.
Часть метаболитов растения, поступающих в бактероиды, превращается в полиэфир b-оксимасляной кислоты, который служит запасным веществом в клетках бактерий и бактероидах клубеньков. Поли-b-оксимасляная кислота откладывается в специальных гранулах и её содержание изменяется в зависимости от процесса азотфиксации. При усилении азотфиксации содержание полиэфира b-оксимасляной кислоты в клубеньках уменьшается, а при ослаблении указанного процесса происходит его накопление.
В связи с тем, что нитрогеназа инактивируется кислородом, клетка бактероида защищена от его проникновения внешней мембраной. Однако в системе окислительного фосфорилирования конечным акцептором электронов служит кислород, который вводится в бактероид в связанном состоянии специальным белком легоглобином. Легоглобины представляют собой гемопротеиды с молекулярной массой 15-16 тыс., которые синтезируются клетками растения-хозяина. Как и гемоглобин крови человека и животных, легоглобин содержит активную группировку в виде протогема, с которой связывается молекулярный кислород, образуя оксилегоглобин. В таком виде обеспечивается транспорт кислорода через мембрану бактероида и передача его на активный центр терминальной оксидазы электронтранспортной цепи бактероида, где кислород акцептирует электроны.
Кроме молекул азота, ферментный комплекс нитрогеназы одновременно восстанавливает также катионы водорода в молекулярный водород в соответствии с реакцией: 2Н+ + 2ē ¾® Н2. Поэтому наряду с аммиаком продуктом действия нитрогеназы является также молекулярный водород, при окислении которого у некоторых штаммов клубеньковых бактерий осуществляется дополнительный синтез АТФ, необходимого для азотфиксации. Окисление водорода катализирует фермент гидрогеназа. В опытах показано, что штаммы клубеньковых бактерий, способные к синтезу гидрогеназы, обеспечивают более интенсивную фиксацию молекулярного азота, вследствие чего повышается продуктивность бобовых растений, инфицированных этими видами клубеньковых бактерий.
Для питания бактероида субстратами цикла Кребса используется не только СО2, фиксированный в процессе фотосинтеза, но и диоксид углерода, поступающий в клубеньки из почвы или выделяющийся как продукт дыхания в клетках клубеньков. Нефотосинтетическую фиксацию СО2 в растительных клетках клубеньков катализирует фермент фосфопируваткарбоксилаза с образованием щавелевоуксусной кислоты. Затем щавелевоуксусная кислота по уже известным нам механизмам превращается в яблочную и янтарную кислоты. За счёт гетеротрофной фиксации СО2 в бактероиды поступает до 25 % углерода, находящегося в составе субстратов цикла Кребса.
Продукт восстановления в бактероидах молекулярного азота – аммиак – транспортируется из бактероида в цитоплазму растительных клеток клубеньков в виде катионов аммония или аланина, который синтезируется аланиндегидрогеназой бактероидов из поступающей в бактероиды пировиноградной кислоты растительного происхождения. В цитоплазме растительных клеток клубеньков локализован фермент глутаминсинтетаза, катализирующий синтез глутамина, а в пластидах – глутаматсинтаза, с участием которой синтезируются молекулы глутаминовой кислоты. Под действием указанных ферментов, а также аминотрансфераз в клубеньках осуществляется синтез транспортных форм азотистых веществ – глутамина и аспарагина, которые далее по транспортной системе растения переносятся в другие органы. У некоторых бобовых (соя, фасоль, вигна) транспортными формами азота служат аллантоин и аллантоиновая кислота, являющиеся продуктами нуклеотидного обмена (см. стр…). Таким образом, бобовые растения, имеющие активные клубеньки, за счёт симбиотической азотфиксации практически полностью обеспечивают свои потребности в восстановленных формах азота. Общая схема биохимических процессов, происходящих в бактероидах, показана на рисунке 40.
Эффективность азотфиксации в клубеньках бобовых растений тесно связана с интенсивностью фотосинтеза. Факторы, влияющие на процессы фотоассимиляции, соответствующим образом влияют и на скорость усвоения растениями молекулярного азота. Особенно заметно снижается симбиотическая азотфиксация у бобовых при недостаточном их питании молибденом и кобальтом. Как мы уже знаем, молибден входит в состав активной группировки Mo,Fe-белка нитрогеназы, а кобальт активирует ферменты в составе клубеньков, имеющие в качестве коферментов коферментные формы витамина В12.
У цианобактерий наблюдаются разные формы симбиоза в зависимости от растения-хозяина. Так, например, цианобактерии из рода Nostoc при симбиозе с водным папоротником Azolla проникают в полости листа, увеличиваются в размерах и покрываются плотной оболочкой, превращаясь в способные к азотфиксации структуры – гетероцисты. Восстановленный азот в виде аммонийной формы транспортируется в окружающие гетероцисты клетки листа и включается в обмен азотистых веществ растения.
Цианобактерии этого же вида способны также к симбиозу с цветковыми растениями из рода Gunnera. Они через специальные железы у основания черешков листьев проникают во внутреннюю полость листьев и инфицируют растительные клетки. Внутри растительных клеток цианобактерии превращаются в гетероцисты, способные фиксировать молекулярный азот атмосферы, превращая его в аммонийную форму, которая транспортируется в цитоплазму инфицированных растительных клеток и включается в состав аминокислот и амидов, обеспечивая таким образом растение восстановленными формами азота.
Кроме симбиотических азотфиксаторов, молекулярный азот атмосферы усваивают также некоторые свободноживущие микроорганизмы. К ним относятся аэробные бактерии родов Azotobacter и Beiyerinckia, анаэробные бактерии из рода Clostridium, отдельные виды цианобактерий и фотосинтезирующих бактерий. Их вклад в обогащение почвы биологически связанным азотом менее значителен по сравнению с симбиотическими микроорганизмами, при благоприятных условиях ежегодная фиксация ими азота может достигать 30-40 кг/га.
У анаэробных азотфиксаторов источником энергии и электронов для восстановления молекулярного азота служат процессы брожения, у аэробных форм – процесс аэробного дыхания, у фотосинтезирующих бактерий - продукты фотосинтеза. Все они способны синтезировать ферментный комплекс нитрогеназы, катализирующий в их клетках восстановление молекул азота до аммиачной формы. Донором электронов для нитрогеназы служит бактериальный ферредоксин и его молекулярные аналоги. Некоторые виды несимбиотических азотфиксаторов (Azotobacter, Beiyerinckia, Azospirillium, Flavobacterium) обитают на поверхности корней растений, так как в качестве энергетических продуктов используют их корневые выделения. Значительный вклад в обогащение рисовых полей азотом за счёт азотфиксации вносят цианобактерии из рода Tolypothrix.
Наряду с выяснением биохимических механизмов процесса азотфиксации у свободноживущих и симбиотических микроорганизмов проводятся также молекулярно-генетические исследования, связанные с направленным воздействием на регуляторную систему синтеза ферментов азотфиксации. Цель таких работ – добиться усиления синтеза нитрогеназы и других ферментов, участвующих в восстановлении и связывании молекулярного азота, и таким образом повысить эффективность биологической фиксации азота атмосферы и его использования сельскохозяйственными растениями. Кроме того, разрабатываются молекулярные подходы переноса генов азотфиксации из клеток микроорганизмов в генотипы растений. Особенно это актуально для злаковых растений, занимающих большой удельный вес среди возделываемых сельскохозяйственных культур. С использованием методов генетической инженерии в различных лабораториях предпринимаются попытки создания таких генотипов злаковых растений, которые подобно бобовым были бы способны усваивать молекулярный азот, содержащийся в земной атмосфере.
Вопросы для повторения:
1. В чём состоит механизм восстановительного аминирования кетокислот, образующихся в реакциях дыхания? 2. Какие реакции катализируют ферменты глутаматсинтаза и аспартатаммиаклиаза? 3. Какое значение в синтезе и превращениях аминокислот имеют реакции переаминирования? 4. Какие продукты образуются в реакциях орнитинового цикла? 5. Каким путём происходит распад аминокислот и превращения продуктов их распада? 6. В ходе каких биохимических реакций осуществляется связывание избыточного аммиака в растительных тканях? 7. Каковы механизмы ассимиляции растениями азота мочевины при некорневых подкормках? 8. Как восстанавливается в растениях нитратная форма азота? 9. При каких условиях происходит накопление нитратов в растительных тканях? 10. Как осуществляется синтез аминокислот при симбиотической азотфиксации? 11. Какие биохимические процессы происходят в бактероидах клубеньков бобовых растений?
Тестовые задания к лекции. Тесты № 193-252.
Лекция 8. Нуклеиновые кислоты, синтез и распад белков.
Аннотация. Рассматривается состав, строение и генетическая роль нуклеиновых кислот. Излагаются принципы передачи генетической информации в ходе репликации ДНК, процессов транскрипции и трансляции. Изучаются механизмы синтеза и распада белков и нуклеотидов, а также ферменты, катализирующие эти процессы.
Ключевые слова: дезоксирибонуклеиновая кислота (ДНК), рибонуклиновые кислоты (РНК), рибосомная РНК, матричная РНК, транспортная РНК, правила Чаргаффа, комплементарное строение ДНК, двойная спираль ДНК, нуклеосомы, генетический код, кодоны, репликация ДНК, ДНК-полимеразы, РНК-полимеразы, ДНК-праймазы, ДНК-лигазы, репликативная вилка, промоторы, транскрипция, терминаторы, репрессоры транскрипции, интроны, экзоны, процессинг, сплайсинг, трансляция, инициаторный кодон, терминирующие кодоны, полирибосомы, рибонуклетидредуктазы, рибонуклеазы, дезоксирибонуклеазы, нуклеотидазы, ксантиноксидазы, уратоксидазы, протеиназы, пептидазы.
Рассматриваемые вопросы:
Строение и функции нуклеиновых кислот.
Генетический код.
Синтез ДНК.
Синтез РНК.
Синтез белков и нуклеотидов.
Процессы распада нуклеиновых кислот, нуклеотидов и белков.
10.7. Строение и функции нуклеиновых кислот.
Нуклеиновые кислоты – это биологические полимеры, молекулы которых построены из нуклеотидов. Эти вещества были открыты Ф. Мишером в 1869 г., который выделил их из ядер клеток лейкоцитов и поэтому назвал нуклеином (ядро по гречески – nucleus). Поскольку они обладают кислотными свойствами, вновь открытые химические соединения в дальнейшем стали называть нуклеиновыми кислотами. Длительное время нуклеиновым кислотам отводилась второстепенная роль в жизнедеятельности организмов. И только в 1940-1950 г.г. было показано, что эти химические соединения ответственны за наследственность и реализацию генетических свойств у всех живых организмов.
В зависимости от состава и строения образующих их молекул нуклеотидов различают два вида нуклеиновых кислот: дезоксирибо-нуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК). Молекулы ДНК образуются из дезоксирибонуклеотидов в основном четырёх видов – дезоксиадениловой кислоты (дАМФ), дезоксигуаниловой кислоты (дГМФ), дезоксицитидиловой кислоты (дЦМФ) и дезокситимидиловой кислоты (дТМФ). Молекулы РНК синтезируются из рибонуклеотидов – адениловой кислоты (АМФ), гуаниловой кислоты (ГМФ), цитидиловой кислоты (ЦМФ) и уридиловой кислоты (УМФ). Кроме указанных нуклеотидов, в составе нуклеиновых кислот в небольшом количестве содержатся и некоторые другие нуклеотиды (см. стр…).
