Лекции биохимия 3. Лекция Обмен липидов
 Скачать 4.12 Mb. Скачать 4.12 Mb.
|
|
М 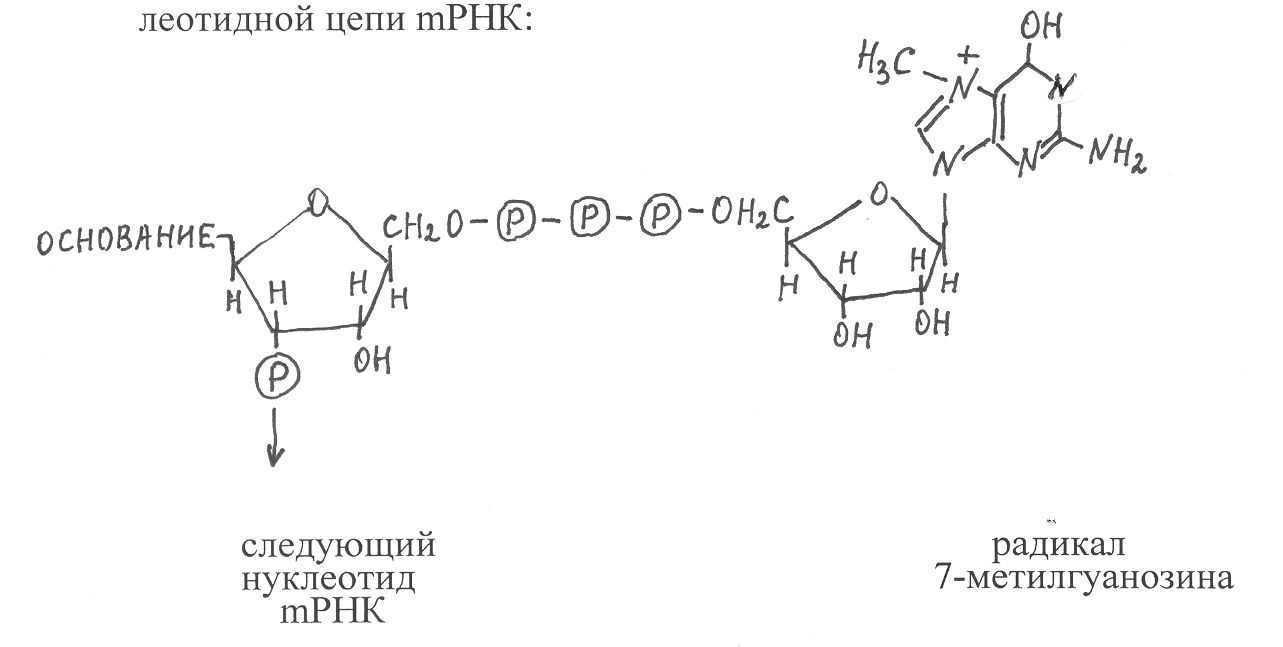 атричная РНК. Матричная, или информационная, РНК в отличие от рРНК является короткоживущей формой РНК. Период полужизни её молекул у бактерий составляет в среднем 2-3 минуты, а у высших организмов – от нескольких часов до 1-2 суток. Основная функция mРНК – копирование нуклеотидных последовательностей ДНК, кодирующих структуру определённых белковых полипептидов, и участие совместно с рибосомами и тРНК в синтезе белков. В клетках прокариот синтезируемая mРНК содержит нуклеотидные последовательности одного или нескольких генов. В клетках эукариот каждая молекула mРНК копирует структуру одного гена и обычно включает 1500-2000 нуклеотидов. На её 5'-конце находится радикал 7-метилгуанозина, а к 3'-концу присоединяется полинуклеотидная цепь, включающая около 100 повторяющихся остатков адениловой кислоты (поли-А), за исключением mРНК гистоновых белков. Радикал 7-метилгуанозина соединяется с 5'-концом mРНК трифосфатной группировкой, которая образует эфирные связи с остатками рибозы 7-метилгуанозина и последующего остатка нуклеотида на 5'-конце полинуклеотидной цепи mРНК. В клетках организмов количество mРНК обычно составляет 1-3 % от общей суммы РНК. По наличию в клетке тех или иных видов mРНК можно судить об активности функционирования соответствующих генов, кодирующих структуру определённых белков, которые в данный момент обеспечивают жизнедеятельность клетки. Молекулы рибосомной и матричной РНК образуются из одной полинуклеотидной цепи, которая на отдельных участках формирует короткие двойные спирали. Между участками двойной спирали в виде разной формы петель находятся участки одноцепочечной РНК (рис. 43). Меньшие по размеру одноцепочечные фрагменты в виде петель также довольно часто прерывают структуру двойных спиралей РНК. Образование двойных спиралей в молекулах РНК инициируют водородные связи, возникающие между парами оснований А–У и Г–Ц, а в отдельных случаях водородными связями скрепляются также пары оснований Г–У. Цепи РНК, образующие двойные спирали, антипараллельны и существуют в правозакрученной А-форме, подобной А-форме молекул ДНК. За счёт взаимодействия элементов вторичной структуры молекулы РНК формируют довольно компактную и упорядоченную третичную структуру. Она стабилизируется образованием водородных связей между основаниями, входящими в состав одноцепочечных участков в разных частях молекулы РНК, образуя с ними комплексы в виде двойной спирали. Одноцепочечные участки могут взаимодействовать также с основаниями в составе двойных спиралей РНК. Кроме того, возможно образование водородных связей при взаимодействии НО-групп рибозы с азотом оснований. Для стабилизации третичной структуры РНК важную роль играют также катионы Mg2+ и другие двухвалентные катионы, которые связываются с фосфатными остатками и отрицательно заряженными группировками оснований полинуклеотидной цепи. Транспортная РНК в клетках организмов находится в растворимом состоянии в жидкой фазе и осуществляет функцию избирательного связывания амминокислот и переноса их к рибосомам, осуществляющим синтез белков. Для каждой аминокислоты имеются свои виды тРНК. Молекулы тРНК прокариот и высших организмов по размерам и структурным характеристикам существенно не различаются. Они образуют полинуклеотидную цепь, состоящую из 70-90 нуклеотидных остатков, которая имеет пространственную структуру в виде «клеверного листа» (рис. 44). В молекуле любой тРНК имеется четыре участка, образующих двойные спирали за счёт водородных связей между комплементарными основаниями. Три таких участка заканчиваются одноцепочечными петлями, включающими модифицированные нуклеотиды, а четвёртый участок содержит 3'- и 5'-концы полинуклеотидной цепи тРНК. На 3'-конце любой тРНК находится последовательность из трёх нуклеотидов Ц-Ц-А, служащая для связывания аминокислоты. На противоположном конце третичной структуры тРНК имеется одноцепочечная петля, содержащая в центральной её части последовательность из трёх нуклеотидных остатков, называемую антикодоном. Она комплементарна одному из участков mРНК и в ходе синтеза полипептидной цепи соединяется водородными связями с этим участком mРНК, обеспечивая таким образом включение в полипептид соответствующего аминокислотного остатка, связанного с данной тРНК. У каждой тРНК имеется свой антикодон. Х 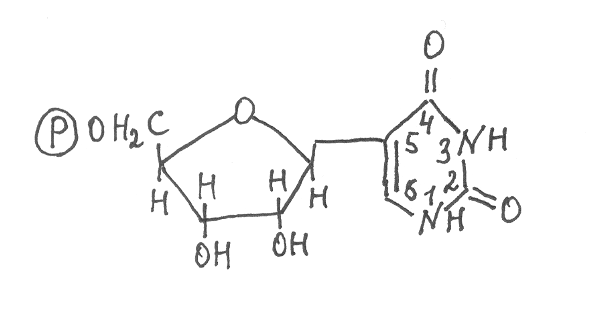 арактерной особенностью тРНК является наличие в их структуре большого количества модифицированных нуклеотидов. Одной из распространённых форм модификации нуклеотидов является метилирование оснований или остатков рибозы по гидроксильной группе у второго углеродного атома. В результате присоединения водорода к азотистым основаниям происходит образование дигидропроизводных различных нуклеотидов. Остатки уридиловой кислоты в ходе модификации превращаются в остатки псевдоуридиловой кислоты, в которой рибоза соединяется не с азотом, а с пятым углеродным атомом урацила: Остаток псевдоурациловой кислоты в полинуклеотидных цепях тРНК обозначают символом ψ. Остаток урацила псевдоуридиновой кислоты, как и в составе уридиловой кислоты, образует комплементарную пару с остатком аденина, входящего в состав адениловой кислоты. В антикодоновой петле тРНК к 5'-концу антикодона всегда присоединяется остаток уридиловой кислоты (У), а со стороны 3' конца – остаткок сильно модифицированного нуклеотида, обозначаемого символом Y. Этот нуклеотид образуется из гуаниловой кислоты в результате модификации в ней азотистого основания гуанина. У некоторых тРНК в состав антикодонов наряду с остатками типичных нуклеотидов входят также остатки инозиновой кислоты. 10.8. Генетический код. После того, как в 1944 г. была установлена генетическая функция ДНК, связанная с хранением наследственных свойств организма, биохимикам стало ясно, что каждый ген представляет собой часть молекулы ДНК, которая состоит из определённой последовательности нуклеотидных остатков, соединённых фосфодиэфирными связями. Сопоставление генетических карт мутаций генов, определяющих полипептидные последовательности белков, показало, что мутации, вызывающие аминокислотные изменения в конце полипептидной цепи, размещаются на генетической карте хромосомы дальше от её начала, чем аналогичные мутации, изменяющие аминокислотные остатки в начале полипептидной цепи. Следуя логике указанных экспериментов, биохимики сформулировали очень важную закономерность, что полинуклеотидные последовательности генов и полиаминокислотные последовательности белков колинеарны, а именно полинуклеотидная последовательность гена определяет полиаминокислотную последовательность соответствующего полипептида. Однако на примере изучения нуклеотидного состава ДНК и аминокислотного состава белков фагов и бактерий было определено, что в ДНК содержится значительно больше нуклеотидов, чем аминокислотных остатков в составе всех белков, синтезируемых клетками указанных организмов. Отсюда возникло предположение, что каждый аминокислотный остаток полипептидной цепи белка кодируется не одним нуклеотидом. Тем более было известно, что в составе ДНК имеются только четыре вида нуклеотидов, а протеиногенных аминокислот – 18, и если учитывать ещё два амида, участвующих в построении белковых молекул, то получится 20 протеиногенных аминокислот. И если даже предположить, что каждый аминокислотный остаток белка кодируется последовательностью из двух нуклеотидов в структуре гена, то получится только 16 комбинаций нуклеотидов из четырёх по два, что тоже недостаточно для кодирования 20 аминокислотных остатков. Только комбинации нуклеотидных последовательностей из четырёх по три обеспечивают кодирование указанного количества протеиногенных аминокислот. Всего их образуется 64, поэтому возникает вопрос все ли комбинации, включающие последовательности из трёх нуклеотидов, используются для кодирования аминокислотных остатков в составе белков. Ответ на этот вопрос был получен в 1961 г. М. Ниренбергом и Г. Маттэи, которые изучали роль различных РНК в качестве матриц для синтеза белков. Они проводили опыты с использованием системы синтеза белков in vitro. Эта система включала неочищенный экстракт растворимых веществ из клеток кишечной палочки (E. сoli), содержащий молекулы тРНК и ферменты, катализирующие связывание аминокислот с тРНК. В этот экстракт добавляли рибосомы, выделенные из клеток кишечной палочки, все протеиногенные аминокислоты, а также систему, генерирующую синтез АТФ. И когда в такую систему синтеза белков ввели в качестве матрицы, кодирующей структуру полипептида, синтетический полинуклеотид, построенный из остатков уридиловой кислоты, соединённых фосфодиэфирными связями (поли-У), то в качестве продукта синтеза был обнаружен полипептид, построенный из повторяющихся остатков фенилаланина, хотя в системе синтеза белков содержались все протеиногенные аминокислоты. Если же в качестве матрицы для синтеза белков использовали полинуклеотид из повторяющихся остатков цитидиловой кислоты (поли-Ц), то продуктом синтеза являлся полипептид, построенный из повторяющихся остатков пролина. При использовании в качестве матрицы в системе синтеза белков полинуклеотида поли-А образовывался полипептид, состоящий из остатков лизина. Если следовать концепции кодирования аминокислотных остатков в белках последовательностью из трёх нуклеотидов, то из результатов опытов М. Ниренберга и Г. Маттэи следовало, что остаток аминокислоты фенилаланина в полипептидных цепях белков кодируется в mРНК последовательностью из трёх нуклеотидов УУУ, остаток пролина – ГГГ, остаток лизина – ААА. Указанные последовательности из трёх нуклеотидов в полипептидных цепях mРНК, кодирующие определённые аминокислотные остатки в структуре белков, было предложено называть триплетами, или кодонами. В дальнейшем Х.Г.Корана синтезировал искусственные полинуклеотиды с известной и регулярно чередующейся последовательностью нуклеотидов. В ходе изучения аминокислотного состава полипептидов, синтезирующихся при использовании указанных искусственных полинуклеотидов в качестве матриц в системе синтеза белков in vitro, были выяснены все другие триплеты, кодирующие аминокислотные остатки в структуре белков. На основе полученных данных составлена таблица, содержащая 64 кодона триплетного генетического кода (табл. 14). В ней указаны триплеты, кодирующие аминокислотные остатки (всего их 61) и три терминирующих кодона (УАА, УАГ, УГА), которые не кодируют аминокислотные остатки у большинства организмов, а используются в качестве сигналов, прекращающих синтез на рибосомах полипептидных цепей. Последовательности нуклеотидов в кодонах записываются по такому же принципу, как и любая последовательность нуклеотидов в полипептидных цепях, крайним слева записывается нуклеотид на 5'-конце, а крайним справа – нуклеотид на 3'-конце. Большинство аминокислотных остатков кодируются не одним кодоном: остатки серина, глицина и лейцина – 6 кодонами; валина, пролина, треонина, аланина и аргинина – 4; изолейцина – 3 кодонами; другие аминокислотные остатки – 2 кодонами. И только остатки метионина и триптодана кодируются единичными кодонами. Выявленная неоднозначность в кодировании аминокислотных остатков получила название вырожденности генетического кода. Благодаря вырожденности генетического кода разные организмы могут синтезировать сходные по структуре белки, необходимые для выполнения одной и той же биологической функции. При этом выявлено, что у каждого типа организмов обычно для кодирования определённой аминокислоты используются из имеющегося набора кодонов не все, а только определённые один-два кодона. Явление вырожден-ности кода может служить также защитой от мутаций, связанных с модификацией или заменой отдельных нуклеотидов в структуре ДНК, в результате чего многие такие отклонения в нуклеотидном составе ДНК не приводят к изменению аминокислотного состава белков. 14. Кодоны генетического кода*
* Справа от кодона указано сокращённое обозначение аминокислоты, которую кодирует данный кодон; Т(У) – в кодонах ДНК содержатся остатки дезокситимидиловой кислоты (Т), а в кодонах РНК – уридиловой кислоты (У); Терм. – терминирующий кодон. Важное свойство генетического кода, характерное для большинства организмов, его неперекрываемость. Это означает, что последовательности кодонов, входящие в структуру разных генов, занимают определённые участки в молекуле ДНК, которые в структуре хромосом не перекрываются, а последовательно располагаются вдоль цепи ДНК. В составе каждого гена кодоны также не перекрываются, они последовательно следуют один за другим в цепи ДНК, образующей данный участок. Однако в геномах некоторых фагов найдены участки ДНК, в которых локализованы перекрывающиеся гены. Благодаря наличию перекрывающихся генов у таких генотипов оказывается возможным кодирование значительно большей генетической информации, чем это позволяют линейные размеры ДНК, ограниченные числом содержащихся в ней нуклеотидов. В многочисленных опытах с использованием различных систем синтеза белков in vitro было показано, что генетический код универсален для всех организмов. Если, например, в систему синтеза белка, выделенную из клеток микроорганизмов, добавлять mРНК животных, человека или растений, то в этой системе будут синтезироваться белки указанных высших организмов. Универсальность генетического кода послужила основой для развития нового научного направления – генной инженерии. В основу генетической инженерии положены биохимические методы, позволяющие выделение определённых участков ДНК, содержащих отдельные гены, из клеток одного организма и перенос их в клетки другого организма, где они включаются в ДНК хромосом и становятся источниками генетической информации для синтеза соответствующих белков, которые улучшают свойства данного организма или могут быть использованы в качестве биокатализаторов для производства пищевых продуктов и медицинских препаратов в биотехнологической промышленности. 10.9. Синтез ДНК. Различными методами показано, что в период, предшествующий делению клеток, количество в них ДНК удваивается. При этом синтез ДНК осуществляется таким образом, что и в дочерних, и в материнских клетках содержатся совершенно идентичные молекулы ДНК. Это означает, что в процессе синтеза реализуется механизм воспроизведения структуры ДНК, который обеспечивает передачу наследственных свойств в ходе размножения клеток. Механизм образования в клетках организмов новых молекул ДНК, которые идентичны по генетическим свойствам уже имеющимся молекулам, называют репликацией ДНК. Первые представления о механизме удвоения ДНК вытекали из модели строения молекул ДНК Д. Уотсона и Ф. Крика, которая представляет собой двойную спираль, состоящую из двух комплементарных полинуклеотидных цепей. Если такие цепи разъединить и использовать в качестве матрицы (шаблона) для синтеза новой цепи ДНК, то в процессе синтеза будет выстраиваться полинуклеотидная цепь, которая по всем нуклеотидам комплементарна исходной цепи ДНК. Таким образом, каждая из двух разъединённых цепей ДНК даёт начало новой двухцепочечной структуре, которая по последовательности в ней нуклеотидных остатков не отличается от исходной молекулы ДНК, используемой в качестве матрицы при синтезе новой молекулы ДНК. Принцип изложенного выше механизма удвоения ДНК может быть представлен в виде следующей схемы: -А-Т-Г-Ц-Т-Г-А-Ц- ( -А-Т-Г-Ц-Т-Г-А-Ц- -А-Т-Г-Ц-Т-Г-А-Ц-& -Т-А-Ц-Г-А-Ц-Т-Г- -Т-А-Ц-Г-А-Ц-Т-Г-( -А-Т-Г-Ц-Т-Г-А-Ц- -Т-А-Ц-Г-А-Ц-Т-Г-& -Т-А-Ц-Г-А-Ц-Т-Г- комплементарные синтез новых комплемен- цепи исходной разъединённые тарных цепей ДНК молекулы ДНК цепи ДНК Экспериментальное подтверждение механизма репликации ДНК было получено в 1958 г. М. Мезелсоном и Ф. Сталем, которые выполнили эксперименты с использованием тяжёлого изотопа азота 15N. Путём длительного выращивания кишечной палочки ( E. сoli) на среде, содержащей в качестве источника азота 15NH4Cl, они получили клетки, в которых молекулы ДНК были полностью насыщены 15N. Затем клетки перенесли в среду с источником азота в виде 14NH4Cl и стали отбирать пробы после появления каждой новой генерации клеток. Из каждой пробы выделяли ДНК и подвергали ультрацентрифугированию в градиенте плотности хлористого цезия. В ходе опытов было определено, что в первом поколении клеток после их высаживания на среду с 14N в составе ДНК только половина азота была представлена в виде 15N, а вторую половину составлял изотоп 14N. Такое распределение изотопов азота удалось определить путём разделения цепей ДНК при нагревании, в одной из цепей содержался изотоп азота 15N, а в другой – 14N. Полученные результаты свидетельствовали о том, что в ходе синтеза образуется гибридная молекула ДНК, в которой одна из цепей, содержащая 15N, переходит от родительской молекулы, а вторая синтезируется заново с использованием азота из питательной среды в виде 14N. В следующем акте деления клеток гибридная молекула ДНК разделялась на две цепи и на каждой из цепей синтезировалась новая полинуклеотидная цепь, используя в качестве источника азота только изотопы 14N. (рис. 45). Поэтому каждая гибридная молекула ДНК в ходе репликации давала начало одной новой гибридной молекуле и другой уже не гибридной молекуле, содержащей комплементарные цепи ДНК и имеющей атомы азота только в виде 14N. В каждом последующем поколении происходило уменьшение доли гибридных молекул в два раза. Синтез ДНК катализируют ферменты ДНК-нуклеотидилтрансфе-разы или более кратко ДНК-полимеразы, имеющие в активном центре катионы Zn2+. ДНК-полимеразы осуществляют синтез ДНК на одноцепочечной матрице, если на ней уже содержится небольшой олигонуклеотидный фрагмент, комплементарный нуклеотидным остаткам матрицы. Это так называемая «затравка», у которой на 3'-конце имеется свободная гидроксильная группа. Субстратами для построения синтезируемой полинуклеотидной цепи ДНК служат дезоксирибонуклеозидтрифосфаты, то есть дАТФ, дГТФ, дЦТФ, дТТФ. Порядок присоединения фосфорилированных нуклеотидных остатков определяется их комплементарным взаимодействием с соответствующими нуклеотидными остатками на ДНК-матрице, с которыми они образуют водородные связи. В ходе реакции под действием фермента осуществляется гидролиз макроэргической связи дезоксинуклеозидтрифосфата и высвобождение пирофосфата, а нуклеотидный остаток в виде дезоксинуклеотидмонофосфата присоединяется к 3'-ОН «затравки». И так последовательно происходит наращивание синтезируемой полинуклеотидной цепи ДНК в направлении от 5'-конца к 3'-концу. Вновь синтезируемая цепь ДНК комплементарна и антипаралельна полинуклеотидной цепи матрицы, что отвечает принципам построения двойной спирали ДНК. Реакция, катализируемая ДНК-полимеразой, может быть представлена в виде следующей схемы: О 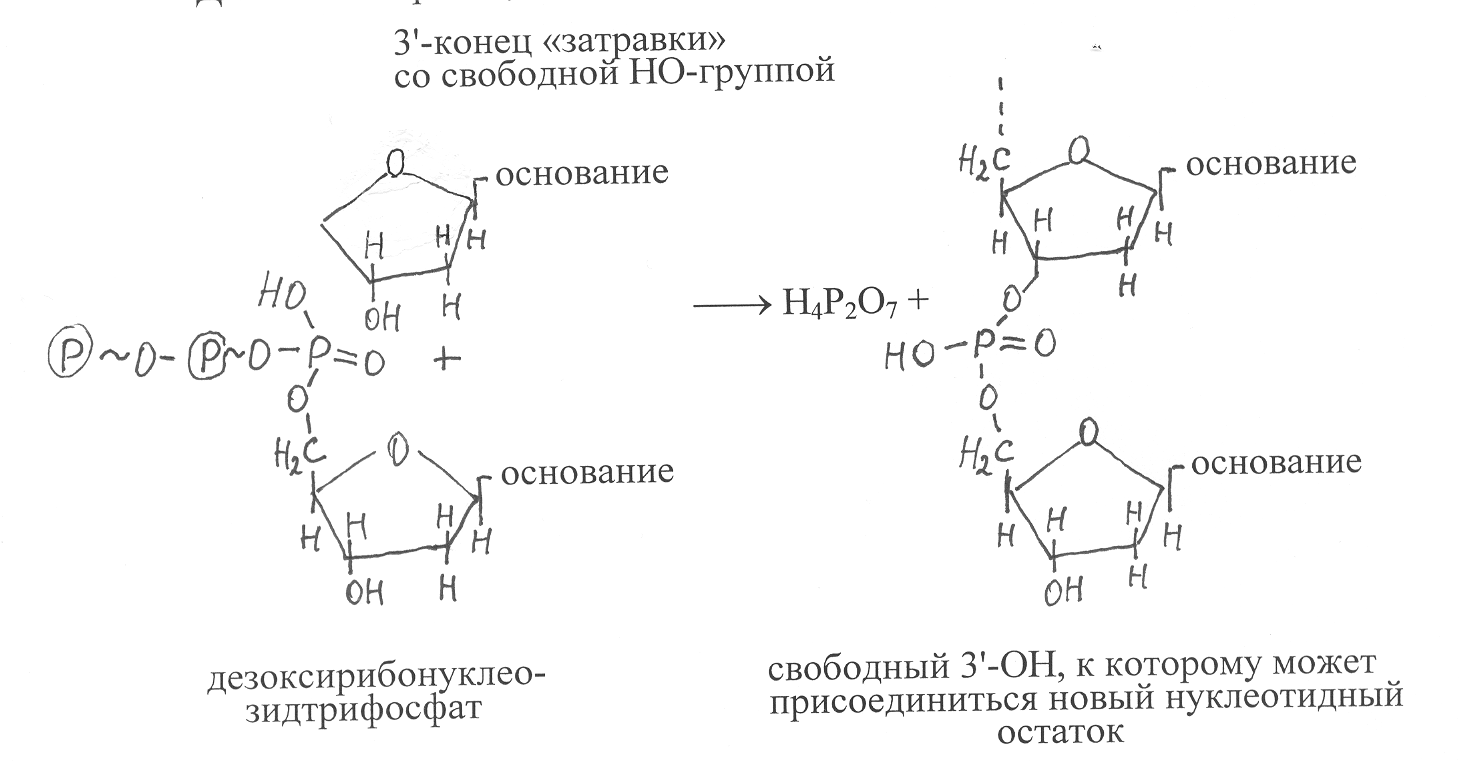 бразующийся в указанной реакции пирофосфат расщепляется пирофосфатазой, что предотвращает ход обратной реакции, вызывающей распад полинуклеотидов ДНК. ДНК-полимеразы осуществляют синтез полинуклеотидных цепей ДНК с очень высокой скоростью. Скорость этого процесса в клетках бактерий составляет около 1000 нуклеотидных остатков за 1 секунду. В клетках высших организмов – несколько десятков нуклеотидных остатков за 1 секунду (около 100). Однако даже при такой высокой скорости синтеза фермент действует очень точно и вероятность присоединения неправильного нуклеотидного остатка обычно не превышает 10-6 – 10-8, то есть ошибка в синтезе ДНК составляет один раз на десятки миллионов нуклеотидных остатков. К 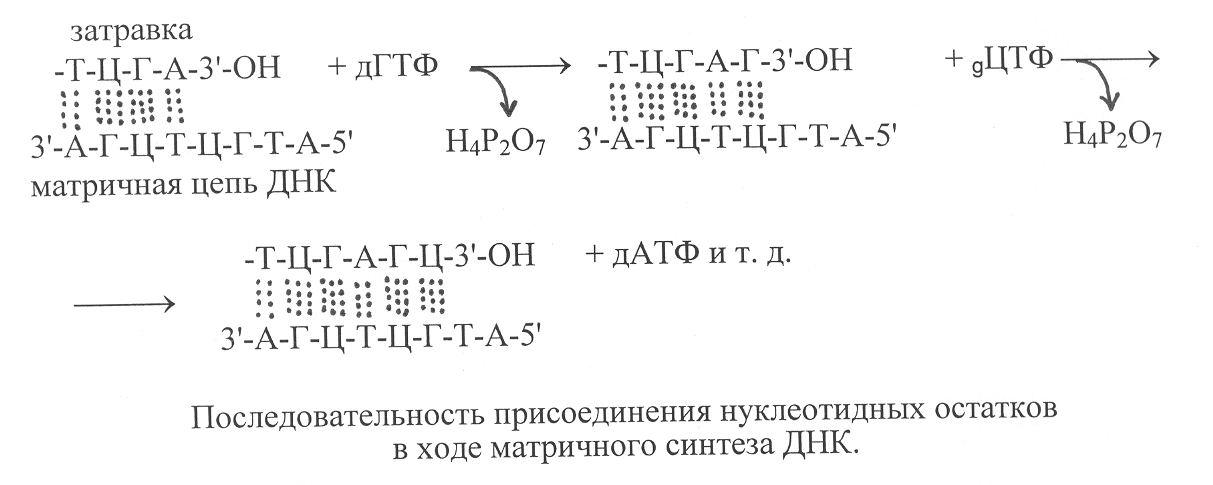 ак было указано выше, ДНК-полимеразы присоединяют нуклеотиды в ходе синтеза ДНК к 3'-концам олигонуклеотида, называемого «затравкой», комплементарно присоединённого к матрице. Однако эти ферменты не способны инициировать синтез ДНК на одноцепочечной матрице. Поэтому образование олигонуклеотида «затравки» катализирует другой фермент, который назвали ДНК-праймазой. ДНК-праймаза катализирует присоединение к матричной цепи ДНК нескольких остатков рибонуклеотидов, формирующих короткую «затравочную» цепь РНК, которая комплементарна матричной цепи и образует с ней двойную спираль. Именно к 3'-концу РНК-затравки происходит далее присоединение остатков дезоксирибонуклеотидов, катализируемое ДНК-полимеразами. После того, как синтез новой ДНК-цепи заканчивается, РНК-затравки удаляются специальным ферментом, который проявляет 5'-экзонуклеазную активность, то есть отщепляет от полинуклеотидной цепи 5'-концевые нуклеотидные остатки. В клетках бактерий выявлены три вида ДНК-полимераз – ДНК-полимеразы I, II, и III. ДНК-полимераза I представляет собой белок с молекулярной массой 102000, обладающий тремя видами каталитической активности. Он способен удалять неправильно присоединённые или изменённые в результате мутации нуклеотидные остатки за счёт проявления 3'-экзонуклеазной активности и присоединять вместо них правильные нуклеотидные остатки, комплементарные матричной ДНК. Кроме того, за счёт 5'-экзонуклеазной активности этот фермент катализирует удаление РНК-затравки и достраивание вместо неё полинуклеотидной цепи ДНК. ДНК-полимераза II имеет молекулярную массу около 120000 и обладает как полимеразной, так и 3'-экзонуклеазной активностью. Она присоединяется к двуцепочечной ДНК и катализирует на одной из цепей ДНК образование фрагментов длиной в несколько десятков нуклеотидов. Важную роль этот фермент играет в процессах репарации ДНК, направленных на удаление в ДНК изменённых под воздействием мутагенов нуклеотидных остатков. ДНК-полимераза III – главный фермент, катализирующий репликацию ДНК. Он состоит из семи разных субъединиц, образующих олигомерную молекулу с молекулярной массой около 500000. Ферментный белок присоединяется к двуцепочечной затравке и катализирует далее синтез новой цепи ДНК на ДНК-матрице. На активирование ДНК-полимеразы III в процессе присоединения к матрице затрачивается энергия, которая обеспечивается в результате гидролиза макроэргической связи АТФ с образованием АДФ и фосфорной кислоты. В клетках высших организмов имеются аналогичные ферменты, обладающие ДНК-полимеразной активностью. Основной фермент репликации ДНК в ядрах клеток – ДНК-полимеразе a, в составе которого содержится также полипептидная субъединица ДНК-праймазы, способная катализировать синтез РНК-затравки. ДНК-полимераза b, как и ДНК-полимераза II бактерий, участвует в репарации ДНК. ДНК-полимераза ¡ катализирует синтез ДНК в митохондриях. Аналогичный фермент найден в хлоропластах растений. У бактерий репликация ДНК начинается в определённом участке хромосомы, который сокращённо обозначают ori (от английского слова origin – начало). Этот участок хромосомы имеет специфическую последовательность нуклеотидов, узнаваемую одним из белков, участвующим в инициации синтеза ДНК. Его называют инициаторным белком. При этом может быть однонаправленная репликация, когда ферменты репликации движутся в одном направлении. Возможен также двунаправленный синтез ДНК, когда репликация ДНК от участка хромосомы, обозначаемого ori, осуществляется в двух противоположных направлениях. В хромосомах высших организмов репликация начинается одновременно на многих участках, расстояние между которыми составляет порядка 100000 нуклеотидных остатков. После того, как инициаторный белок связывается с участком ДНК ori, к этому участку присоединяется в определённой последовательности комплекс из шести белков, главным из которых является хеликаза. Хеликаза – АТФ-зависимый фермент, использующий энергию гидролиза АТФ для разъединения полинуклеотидных цепей двойной спирали ДНК. Ферментный белок хеликазы, присоединившись к одной из цепей ДНК, движется вдоль этой цепи и расплетает перед собой двойную спираль ДНК, образуя репликативную вилку, которая включает участок двойной спирали ДНК и две отходящие от него одноцепочечные ветви (рис. 46). Самопроизвольное объединение в двойную спираль образовавшихся под действием хеликазы одноцепочечных участков ДНК предотвращают специальные белки, которые имеют избирательное сродство к разъединённым полинуклеотидным цепям ДНК. Такие белки получили название SSB-белков (от английского single strand binding proteins). SSB-белки, вплотную прилегая друг к другу, связывают одноцепочечные участки ДНК и делают их более реакционноспособными для взаимодействия с ферментом ДНК-полимеразой. В результате расплетания хеликазой двойной спирали ДНК возникает её вращательное движение впереди репликативной вилки. Однако в связи с тем, что хромосома связана и закреплена клеточными мембранами, вращение двуспиральной ДНК приводит к образованию дополнительных витков и сверхскрученных узлов на пути продвижения репликативной вилки, что могло бы в дальнейшем остановить процесс репликации ДНК. Но этого не происходит вследствие того, что на участке сверхспирализации впереди по движению репликативной вилки действует фермент топоизомераза, образующий разрыв фосфоэфирной связи в одной из цепей двуспиральной ДНК. За счёт такого действия топоизомеразы обеспечивается свободное вращение оставшейся неразорванной одноцепочечной нити ДНК вокруг её υ-связи, что приводит к снятию сверхспирализации ДНК на участке продвижения репликативной вилки и раскручиванию образовавшихся узлов, вызванных действием фермента хеликазы. После раскручивания дополнительных витков сверхспирализации топоизомера восстанавливает разорванную фосфодиэфирную связь и таким образом сохраняет структурную целостность двойной спирали ДНК, которая участвует в процессе репликации. В результате действия хеликазы и SSB-белков образуются две разъединённые цепи ДНК, имеющие противоположную направленность. Одна из них начинается от 3'-конца, другая – от 5'-конца. На цепи ДНК, начинающейся с 3'-конца, после образования РНК-затравки возможен непрерывный синтез новой цепи ДНК под действием фермента ДНК-полимеразы, способного присоединять к 3'-ОН растущей цепи новые нуклеотидные остатки. Однако на цепи ДНК, начинающейся с 5'-конца, такой синтез новой цепи ДНК невозможен. Он должен происходить в обратном направлении после образования одноцепочечного участка ДНК определённой длины, вследствие чего синтез ДНК на одноцепочечной ветви репликативной вилки, начинающейся с 5'-конца, происходит медленней, чем на другой одноцепочечной ветви, начинающейся с 3'-конца. В связи с этим одну из синтезирующихся цепей ДНК называют ведущей, а другую цепь, синтез которой происходит медленней, – отстающей. В опытах Р. Оказаки было показано, что отстающая цепь ДНК синтезируется в виде коротких фрагментов, называемых фрагментами Оказаки. Каждый такой фрагмент начинается с синтеза РНК-затравки с участием ДНК-праймазы, а далее действует фермент ДНК-полимераза III (у бактерий) или ДНК-полимераза a (у высших оорганизмов), который уже синтезирует ДНК-цепь фрагмента Оказаки, доводя её до следующей РНК-затравки. После этого в действие включается фермент ДНК- полимераза, обладающая 5'-экзонуклазной активностью (у бактерий это ДНК-полимераза I), которая удаляет впереди себя РНК-затравку и вместо неё достраивает цепь ДНК до следующего фрагмента Оказаки. На стыке двух фрагментов Оказаки имеется с одной стороны 3'-ОН, а с другой 5'-фосфатная группа, между которыми под действием фермента ДНК-лигазы образуется фосфодиэфирная связь, соединяющая фрагменты Оказаки в единую синтезируемую цепь ДНК. Линейные размеры фрагментов Оказаки зависят от вида организмов; у бактерий они составляют в длину до 1000 нуклеотидных остатков, у высших организмов – около 100. Наиболее хорошо процесс репликации ДНК изучен у бактерий Е. cоli (рис. 47). В клетках E. coli формирование репликативной вилки инициируют два вида хеликаз. Одна из них образует комплекс с ферментным белком праймазы, который получил название праймосомы. Праймосома, расплетая двуцепочечную ДНК, движется по отстающей её цепи в направлении от 5'-конца к 3'-концу и синтезирует на этой цепи РНК-затравки для фрагментов Оказаки. Вторая хеликаза (вспомогательная) движется по ведущей цепи ДНК от её 3'-конца к 5'-концу. Впереди по движению репликативной вилки действует фермент ДНК-гираза, снимающий витки сверхспирализации двойной спирали ДНК, которые возникают в результате работы хеликаз. Образовавшиеся в репликативной вилке одноцепочечные участки ДНК связываются SSB-белками и сразу же становятся объектами действия для фермента ДНК-полимеразы III. Одна молекула ДНК-полимеразы III движется по одной из ветвей репликативной вилки и синтезирует ведущую цепь ДНК. Другая молекула этого же фермента движется по другой одноцепочечной ветви и катализирует образование фрагментов Оказаки, достраивая полинуклеотидные участки от одной затравки до другой. После этого фермент ДНК-полимераза I удаляет РНК-затравки и вместо них достраивает фрагменты Оказаки нуклеотидными остатками ДНК. На конечном этапе синтеза отстающей полинуклеотидной цепи ДНК фермент ДНК-лигаза соединяет фрагменты Оказаки фосфодиэфирными связями в единую цепь. В основных чертах механизм репликации ДНК у разных организмов имеет много общего, хотя у высших организмов по сравнению с низшими имеются определённые особенности. Многие из них уже показаны в данной главе. Следует добавить ещё одно отличие механизма репликации ДНК у высших организмов по сравнению с низшими. Оно связано со строением хромосом. У высших организмов хромосомы линейны и у них на 5'-конце отстающей цепи ДНК остаётся недореплицированный участок в связи с неспособностью ДНК-полимераз инициировать синтез ДНК на одноцепочечной матрице. Для того, чтобы репликация ДНК проходила полностью, у высших организмов имеются удлинения на концах хромосом из повторяющихся последовательностей нуклеотидов, которые образуют изгиб с разворотом цепи на 1800, так что свободных концов у хромосомы фактически нет. Присоединение к концам хромосом повторяющихся последовательностей нуклеотидов катализирует специальная трансфераза. Длина концевых фрагментов хромосом контролируется регуляторной системой клетки. Как было указано ранее, репликация ДНК в клетках организмов осуществляется с очень высокой точностью, однако с небольшой частотой ошибки всё-таки происходят и в структуру новосинтезируемой цепи ДНК включаются нуклеотидные остатки, которые не комплементарны матрице. Такие ошибки репликации исправляют ферменты, относящиеся к системе репарации ДНК. Процесс репарации ДНК – это исправление ошибок репликации ДНК и устранение изменённых нуклеотидных остатков, которые возникают под воздействием мутагенных факторов – радиации, ультрафиолетового излучения, алкилирующих химических веществ, дезаминирования и потери оснований в нуклеотидных остатках. Функционирование системы репарации ДНК обеспечивает исключение из её структуры неправильно присоединённых или изменённых под действием мутагенных факторов нуклеотидных остатков и таким образом устойчиво поддерживает стабильность содержащейся в молекулах ДНК генетической информации. Однако с небольшой частотой иногда такие ошибки возникают и дают начало при репликации изменённым молекулам ДНК. Появление в результате ошибок репликации или действия мутагенных факторов молекул ДНК с изменённым составом нуклеотидных остатков получило название генетических мутаций. |
