биотехнология. Вопросы Биотехнология. Генетическая инженерия растений, ее сущность и задачи
 Скачать 480.5 Kb. Скачать 480.5 Kb.
|
|
Генетическая инженерия растений, ее сущность и задачи. Генетическая инженерия – ветвь молекулярной генетики, исследующая возможности и способы создания лабораторным путем генетических структур и наследственно измененных организмов, т. е. создания искусственных генетических программ, с помощью которых направленно конструируются молекулярные генетические системы вне организма с последующим их введением в живой организм. Обычно употребляют два названия данного научного направления: генетическая инженерия и генная инженерия, являющиеся как бы синонимами. Однако их смысловое содержание неодинаково: генетическую инженерию связывают с генетикой, а генная инженерия имеет отношение только к генам. Кроме того, генетическая инженерия точнее раскрывает содержание дисциплины – создание генетических программ, основная задача которых создание in vitro молекул ДНК посредством соединения фрагментов ДНК, которые в естественных условиях чаще не сочетаются благодаря межвидовым барьерам (рекомбинантные ДНК). С помощью генетической инженерии растений решаются такие задачи: • повышение устойчивости к стрессовым факторам, фитопатогенам, гербицидам и пестицидам; • ввод генов скороспелости; • ввод генов симбиотической фиксации азота. В клетках растений возможна экспрессия генов, перенесенных не только от других растений, но и от микроорганизмов и от животных. Ферменты генетической инженерии: ДНК-полимеразы, ДНК-лигазы, нуклеазы и рестриктазы. Ферменты генетической инженерии - это ферменты, позволяющие проводить различные манипуляции с молекулами ДНК: разрезать в определенных местах, соединять различные по происхождению фрагменты, синтезировать новые, не существующие в природе последовательности и т. д. Среди ферментов генетической инженерии выделяют: ДНК-полимеразы. Чаще всего в ГИ используют фермент ДНК-полимеразу I, выделенную из Esherichia coli (кишечной палочки) или фага Т4. ДНК-полимераза I обладает способностью удлинять цепь ДНК путем присоединения комплиментарного нуклеотида. Это свойство фермента используется в ГИ для построения второй комплиментарной цепи ДНК, т.е. по сути - это удвоение ДНК. Из некоторых вирусов выделена специфическая ДНК-полимераза - РНК-зависимая, названная ревертазой, с помощью ривертаз получают молекулы ДНК и РНК. ДНК-лигаза - осуществляет одну функцию - соединение фрагментов ДНК путем восстановления фосфодиэфирных связей между соседними нуклеотидами. Этот процесс назван лигированием. В ГИ для лигирования обычно используют ДНК-лигазу фага Т4. Нуклеазы - это большая группа ферментов, катализирующих реакцию гидролиза молекул нуклеиновых кислот, в результате чего молекулы ДНК и РНК распадаются на фрагменты или отдельные нуклеотиды. Нуклеазы по типу их действия делят на группы: 1. нуклеазы, действующие только на ДНК или РНК; 2. нуклеазы, действующие и на ДНК и на РНК одновременно (нуклеаза золотистой фасоли). Рестриктазы- специфическая группа нуклеаз. В ГИ используется около 200 видов рестриктаз. Эти ферменты способны гидролизовать ДНК строго по определенным специфическим последовательностям - сайтам рестрикации. Каждая из рестриктаз узнает свой сайт рестрикации и разрезает ДНК либо внутри последовательности сайта рестрикации, либо в непосредственной близости от него. По характеру расщепления рестриктазы делят на несколько типов: - рестриктазы I типа узнают сайт рестрикации, но расщепляют последовательность нуклеотидов ДНК на произвольном расстоянии от сайта узнавания (от нескольких десятков до нескольких тысяч пар нуклеотидов). Такие рестриктазы в ГИ используют редко; - рестриктазы III типа - похожи на рестриктазы I типа, они гидролизуют ДНК на расстоянии 20-35 нуклеотидных последовательностей от сайта узнавания и тоже используются в ГИ довольно редко; - рестриктазы II типа - чаще всего используются в ГИ, у таких рестриктаз места рестрикации и сайты узнавания совпадают. Рестриктазы II типа в зависимости от размера сайта и длинны получаемых фрагментов делят на 3 класса: 1. мелкощепящие - сайт рестрикации представлен 4 парами нуклеотидов; 2. среднещепящие - сайт рестрикации - 6-8 н.п.; 3. крупнощепящие - сайт рестрикации - 10-14 н.п. Кроме того, некоторые рестриктазы II типа расщепляют молекулу ДНК симметрично, образуя так называемые «тупые» концы», другие - со сдвигом, с образованием «ступеньки», образуют так называемые «липкие» концы Фрагменты ДНК, имеющие комплиментарные «липкие» концы могут соединяться с помощью ДНК-лигаз и сайт рестрикации восстанавливается. Конструирование рекомбинантной ДНК. Сущность генетической инженерии сводится к целенаправленному конструированию генетических систем вне организма с последующим введением и в живой организм. При этом рекомбинантные ДНК становятся частью реципиентного организма, кроме того, они привносят в него новые генетические и физиолого-биохимические свойства, к числу таких свойств можно отнести синтез аминокислот, белков, гормонов, ферментов, витаминов и др. Один из важных этапов конструирования молекулы ДНК – лигирование (или сшивание) генов с помощью фермента ДНК-лигазы. Сшивание фрагментов ДНК, содержащих нужные гены, осуществляют двумя основными методами: а) по «липким» концам; б) с помощью искусственно достроенных «липких» концов. Сшивание генов (фрагментов) ДНК по «липким» концам, т. е. взаимнокомплементарным участкам, длиной из 4–6 пар нуклеотидов, осуществляется ферментом ДНК-лигами с образованием ковалентной фосфодиэфирной связи между соседними нуклеотидами: --АТГЦААТТ ЦАГТЦ---- --ТАЦГ ТТААГТЦАГ---- Сшивание ДНК-лигаза АТГЦ ААТТ-ЦАГТЦ ТАЦГ-ТТАА-ГТЦАГ При отсутствии комплементарных «липких» концов у сшиваемых фрагментов их достраивают, т. е. синтезируют искусственно ферментативным путем. Для этой цели применяют так называемые линкеры (или «переходники») короткие участки ДНК, имеющие разные «липкие» концы: - АТГЦААТТ ЦТГАГАТЦЦА ТАЦГ ТАЦГТТАА ГАЦТЦТАГГТ АТГЦ Фрагмент 1 Линкер Фрагмент 2 Линкерные фрагменты не только обеспечивают объединение генов, но и обусловливают их экспрессию, в связи с чем часто в середину линкера помещают какой-либо регуляторный генетический элемент, например, промотор, или участок связывания с рибосомой. Возможно сшивание фрагментов и по тупым концам, когда концы фрагментов двунитевые: ----АТГЦГГГ ЦЦЦГТАЦ---- ----ТАЦГЦЦЦ ГГГ ЦАТГ----- В этом случае реакция лигирования имеет биохимические особенности и ее эффективность ниже, чем при сшивке по «липким» концам. После того как рекомбинантная ДНК сшита, ее вводят в живые клетки. Для того чтобы рекомбинантная ДНК стала составной частью генетического аппарата клетки, она должна либо встроиться (интегрироваться) в ее геном и реплицироваться за его счет, либо быть способной к автономной репликации. Молекулы ДНК, способные акцептировать чужеродную ДНК и автономно реплицироваться, называются векторными молекулами. К числу векторов относят плазмиды, бактериофаги, вирусы животных. Векторы должны обладать следующими особенностями: 1 Иметь субстратные участки для определенных эндонуклеаз рестрикции. 2 Иметь свойства репликона. 3 Содержать один или несколько маркерных генов, которые после проникновения вектора в клетку придают ей фенотип, свидетельствующий о присутствии вектора. В частности, для бактериальных векторов в качестве маркерных генов чаще всего используются гены, вызывающие устойчивость клеток к некоторым антибиотикам. Таким образом, все векторы обеспечивают репликацию встроенных генов, их экспрессию, интеграцию в хромосому клетки и т. д. Чаще других в генетической инженерии в качестве векторов используют плазмиды. Плазмидами называют бактериальные репликоны (внехромосомные элементы наследственности), стабильно наследуемые. Они представляют собой двуцепочечные кольцевые молекулы ДНК с вариабельными молекулярными массами. По размеру они соответствуют 1–3% генома бактериальной клетки. Плазмиды разделяют на конъюгативные, способные сами перенестись в реципиентные клетки с помощью конъюгации, и неконъюгативные, не обладающие этим свойством. Они детерминируют разные свойства: резистентность к антибиотикам (R-плазмиды); биодеградацию (D-плазмиды) и др. Например, плазмиды стафилококков несут гены устойчивости к пенициллину, соединениям ртути и др. Гены устойчивости к тяжелым металлам обнаружены также в составе R-плазмид Е. coli. Количество плазмид в клетке может колебаться от одной до более ста. В целом, чем крупнее плазмида, тем меньше количество ее копий в клетке. Первый плазмидный вектор был получен С. Коэном (1973). Его источником была плазмида Е. coli R6-5 с Мг 65 кДа. Плазмида стала родоначальником серии векторов и других структур. Плазмидные векторы в настоящее время чрезвычайно разнообразны за счет следующих свойств: 1) уменьшения размеров плазмиды вследствие изъятия участков, не обязательных для репликации (чем больше плазмида содержит уникальных участков узнавания для рестриктаз, тем она универсальнее); 2) гибридизации векторов одного рода с другими векторами или природными плазмидами; 3) использования новых плазмид; 4) применения транспозонов; 5) создания векторов с генетическими маркерами, позволяющими вести отбор рекомбинантных клонов. Экариотические вирусы до сих пор нашли более скромное применение в качестве векторов. Практически используются только онкогенный вирус SV 40 и его производные. Все эти векторы – дефектные вирусы, не способные давать полноценные вирусные частицы в клетке хозяина. Анализируемую ДНК можно вводить и в другие репликоны, способные размножаться в клетках, например, бактериофаги. Чаще всего из известных фагов в качестве векторов применяют сконструированные производные фага и фагов М13 и fd. Векторные молекулы. Трансформация. Ключевой операцией в генетической инженерии является введение в клетку и стабильное поддержание генетической информации, содержащейся в рекомбинантных молекулах ДНК. Это достигается при помощи так называемых векторных молекул или векторов. Дело в том, что при обычном введении ДНК, например, в бактериальную клетку она, как правило, подвергается атаке ферментов, которые разлагают ее на составные компоненты — нуклеотиды. В некоторых случаях ДНК «выживает» в клетке, однако в процессе деления клеток она не наследуется и теряется. Для того чтобы рекомбинантная ДНК стала составной частью генетического аппарата клетки, она должна либо встроиться в ее геном (интегрироваться в хромосому) и реплицироваться за его счет, либо быть способной к автономной репликации. Молекулы ДНК, способные акцептировать чужеродную ДНК и обеспечивающие ее репликацию, а может быть, и экспрессию, называются векторными молекулами. Таким образом, векторы позволяют осуществить введение в клетку дополнительной генетической информации. В качестве векторов используют, как правило, плазмиды, бактериофаги, мобильные элементы, вирусы животных. Первые плазмиды-векторы были выделены из бактерий; в последующем большинство векторов было сконструировано при помощи методов генетической инженерии в соответствии с задачами экспериментаторов. К векторной молекуле предъявляются следующие основные требования: 1) она должна иметь область, чувствительную к определенной эндонуклеазе рестрикции, которая расщепляет вектор, как правило, в одном участке, превращая его кольцевую форму в линейную. К линейной ДНК «пришивают» ген или гены и затем снова замыкают ее в кольцо и рекомбинантную ДНК вводят в клетки; 2) вектор должен реплицироваться в определенных клетках. Репликация осуществляется посредством специфического уча- стка ДНК-репликатора, где сосредоточен реплицирующий аппарат клетки и начинается репликация; 3) в составе векторной молекулы должен быть маркерный ген, который после проникновения вектора в клетку придает ей фенотип, свидетельствующий о присутствии вектора. Иными словами, вектор должен иметь селективный генетический признак. Часто в качестве селективных используют широко распространенные в природе гены ферментов, модифицирующих антибиотики и инактивирующие их действие. Например, в присутствии гена β-лактамазы бактериальная клетка приобретает устойчивость к пенициллину и на среде с этим антибиотиком образует клон или колонию клеток, несущих данный ген; обычные клетки на данной среде погибают. Значит, если вектор содержит ген β-лактамазы, то при помощи среды с антибиотиком легко обнаруживаются клетки, содержащие его, т. е. «трансформированные вектором». Использование плазмид в качестве векторов клонирования. Бактериальные плазмиды в качестве векторов для клонирования. Основная масса клеточной ДНК бактерий содержится в хромосоме (в хромосоме Е. coli, например, 4 млн. пар нуклеотидов). Однако кроме хромосом бактерии содержат большое число очень маленьких кольцевых молекул ДНК длиной несколько тысяч пар оснований. Такие минихромосомы называют плазмидами. Как правило, плазмиды имеют в своем составе гены устойчивости к антибиотикам. Эти гены находятся в плазмидах, а не в главной хромосоме, поскольку в этом случае они представлены гораздо большим числом копий. Высокая копий-ность плазмид обеспечивает клетке синтез большого количества ферментов, химически нейтрализующих антибиотики, что и обеспечивает устойчивость к последним. Некоторые плазмиды, называемые эписомами, могут интегрировать в главную хромосому и передаваться от одной бактерии к другой при конъюгации, когда копия «мужской» хромосомы переходит в «женскую» клетку. Такие плазмиды называются трансмиссибельными, и они легко передают свои гены. Поскольку плазмидная ДНК значительно меньше хромосомной, ее довольно легко выделить в чистом виде. В присутствии ионов Са плазмиды легко поглощаются бактериями, которые их не содержали, и в клетках бактериального потомства можно обнаружить мноғо копий поглощенной плазмиды. Однако бактериальная клетка обычно может содержать в своем составе плазмиды одного типа. Число копий плазмиды в клетке может существенно варьировать. Это зависит от генетических особенностей как клетки,
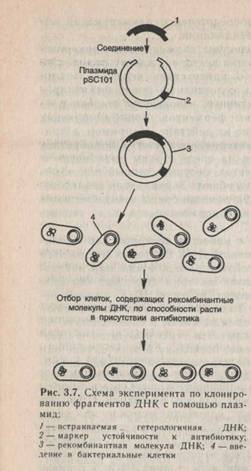
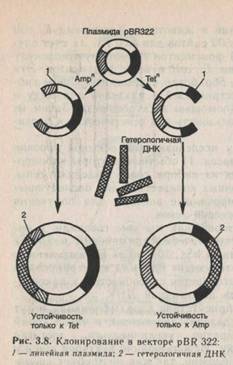
так и плазмиды. Плазмиды, находящиеся «под ослабленным контролем», могут раз множаться до тех пор, пока их число не достигнет10—200 копий на клетку. Если же плазмида находится «под строгим контролем», она реплицируется с той же скоростью, что и главная хромосома. Такие плазмиды содержатся в клетке в одной или в нескольких копиях. Естественно, что для клонирования рекомбинантных ДНК стараются использовать плазмиды первого типа. В качестве вектора впервые плазмида была использована в 1973 г. Эксперименты проводились с маленькой плазмидой Е. colipSC 101, поскольку она содержит только один сайт расщепления EcoR1 (рис. 3.7). Под действием фермента плазмида превращалась в линейную молекулу с липкими концами. Такую плаз-мидную ДНК смешивали в оптимальных концентрациях и отношениях с фрагментами чужеродной ДНК, также обработанной EcoRI и имеющей такие же липкиеконцы. Фрагменты сшивали ферментом ДНК-лигазой из фага Т4. В результате получились новые гибридные плазмиды, содержащие в своем составе фрагменты чужеродной ДНК. Затем бактериальные клетки трансформировали гибридными плазми-дами и по способности расти в присутствии антибиотика отбирали клоны, содержащие рекомбинантные молекулы ДНК. Стало ясно, что можно проводить дальнейшие эксперименты, в которых эти плазмиды будут встраиваться в самые разнообразные чужеродные ДНК, происходящие как из микробов, так и из тканей высших растений и животных. Хромосома Е. coli содержит, например, около 500 сайтов для EcoRI. За счет случайного встраивания EcoRI фрагментов в векторную молекулу можно клонировать все гены Е. coliв виде фрагментов. Эти фрагменты легко выделить, обработав выделенные клоны гибридных плазмид той же рестриктазой и разделив плазмиду и хромосомные фрагменты с помощью электрофореза. Затем их легко извлечь из геля и использовать для генетических и биохимических исследований. В зависимости от задач исследователей векторы условно можно разделить на два класса: 1) обычные векторы клонирования, при помощи которых из набора генов выделяют гены, размножающиеся в достаточных количествах для последующего изучения; 2) специализированные векторы для получения клонотек генов и для экспрессии генов. Из класса обычных векторов, как мы уже говорили, в начальный период развития генетической инженерии наиболее широко использовали плазмиды hSC 101 и ColEI, выделенные из Е. coli . Большинство последующих плазмид конструировали на основе CoiEl, которая отличается способностью к накоплению значительных количеств плазмидной ДНК. Плазмидные векторы в присутствии хлорамфеникола могут умножаться независимо от деления хромосомы, и число копий плазмиды может многократно увеличиваться, достигая (10—20)* 102 копий на клетку. Использование векторов общего назначения методически не сложно, так как не требует специального оборудования, и в связи с этим они получили широкое распространение во многих лабораториях мира. Одна из наиболее часто употребимых плазмид для клонирования HBR 322 создана на основе плазмид природного происхождения, выделенных из Е. coli(рис. 3.8). Эта плазмида содержит гены устойчивости к двум антибиотикам: ампициллину и тетрациклину, причем в генах устойчивости к этим антибиотикам имеются сайты рестрикции. Если фрагмент чужеродной ДНК встраивается в один из генов устойчивости, то последний инактивируется. Следовательно, успешное встраивание фрагмента чужеродной ДНК в один из этих генов легко детектировать по исчезновению у бактерий устойчивости к данному антибиотику. Но при этом сохраняется устойчивость к другому антибиотику. Таким образом вектор дает возможность детектировать только те клоны бактерий, которые содержат рекомбинантную плазмиду. Создание рекомбинантных молекул дало возможность анализа ДНК растений и животных. Теперь путем случайного
встраивания множества рестрикционных фрагментов ДНК в подходящие бактериальные плазмиды (эта процедура была названа «методом дробовика») можно с большой вероятностью получить клон, содержащий интересующий нас ген или какую-либо регуляторную последовательность. При этом нужно уметь из множества клонов отобрать интересующий исследователя. |