биотехнология. Вопросы Биотехнология. Генетическая инженерия растений, ее сущность и задачи
 Скачать 480.5 Kb. Скачать 480.5 Kb.
|
|
Векторы для хлоропластной трансформации Векторные конструкции построены на основе плазмиды Е. соli (см. рис. 1.7) и содержат гены селективного маркера, а также целевой ген(ы). Кроме того, так как в основе трансформации пластома лежит тот факт, что интефация в хлоропластный геном проходит по механизмам гомологичной рекомбинации, участок векторной плазмиды, несущий ген(ы), который необходимо встроить в хлоропластный геном, фланкирован (окружен) последовательностями, гомологичными двум фрагментам хлоропластной ДНК. Длина таких фланкирующих последовательностей может достигать 400–2000 н. п. Такая протяженность гомологии значительно увеличивает частоту рекомбинации между векторной конструкцией и гомологичными участками хлоропластного генома и, соответственно, увеличивается вероятность интеграции части вектора в хлоропластный геном и получения транспластомных растений. Для встраивания трансгенов выбираются межгенные районы пластома. В качестве селективных маркеров в конструкциях для хлоропластной трансформации обычно использовался бактериальный ген ααdA, определяющий устойчивость растения к антибиотику стрептомицину, под контролем промотора рибосомного оперона пластид и теминаторной последовательностью также пластидного гена psbA (см. рис. 2.5). В присутствии стрептомицина в среде для регенерации растения с трансформированными хпоропластами, несущими ген устойчивости ααdA, остаются зелеными, в то время как нетрансформированные – белые. В последние годы в связи с возможным риском переноса антибиотической устойчивости от трансгенов к почвенным микроорганизмам в качестве селективного маркера эффективно используется выделенный из шпината растительный ген бетаин альдегиддегидрогеназы (BADH), который переводиттоксичный глицинальдегид (селективный агент) в нетоксичный для растений глицинбетаин. В качестве функциональных используются гены различного, как бактериального (cry, аrо, bаr гены), так и животного, и растительного (гены GH1, gvgvp) происхождения, что определяется целями получения транспластомных растений. В ряде случаев д ля получения активного белкового продукта несколько генов объединяются в один оперон под контроль сильных пластидных промоторов, как это было сделано при введении кодирующего bt-токсин трехгенного оперона сrу2Аα2 в геном хлоропластов табака. Методы трансформации пластидного генома В настоящее время для трансформации хлоропластов используются три метода: биобаллистики, трансформация с помощью полиэтиленгликоля (ПЭГа) и с помощью микроинъекций с использованием жидкого металла галистана. Наиболее широко применяемым и наиболее эффективным методом трансформации хлоропластов является метод биобалпистики. Методика проведения биобаллистической трансформации пластид аналогична проводимой при трансформации ядерного генома. Высокая эффективность, скорость регенерации трансформированных тканей и возможность использования для различных типов эксплантов и д ля разных видов растений, как однодольных, так и двудольных, сделала этот метод приоритетным для получения транспластомных растений. Выход трансформированных этим методом растений табака может достигать до 5–8 на один обстрелянный эксплант. Единственным ограничением применения этого метода является наличие дорогостоящей биобаллистической пушки. Для ПЭГ-опосредованной трансформации необходимо получить протопласты. Протопласты в присутствии ПЭГа могут всасывать векторную ДНК, и изменения в мембране протопласта позволяют ДНК проникать внутрь цитоплазмы. Векторная ДНК транспортируется из цитоплазмы в хлоропласт, где и встраивается в геном последнего. Эффективность этого метода при трансформации хлоропластов не очень высока. Кроме того, не все растения могут регенерировать из протопластов, что довольно сильно сужает возможности применения этого метода. Трансформация с помощью микроинъекций с использованием жидкого металла галистана является новейшей разработкой, однако пока не очень распространенной. Этот метод основан на микроинъекциях векторной ДНК непосредственно в хлоропласты с помощью стеклянной иглы диаметром 0,1 мм. Введение векторной конструкции происходит в результате теплового расширения жидкого металла галистана в шприце. Дальнейшие этапы отбора транспластомных растений аналогичны таковым у ядерных трансгенов и проводятся в присутствии высоких концентраций селективного агента. Существенным отличием является то, что при пластидиой трансформации проводят несколько дополнительных раундов (до 4) селекции и регенерации. Это связано с плоидностью генома и мультикопийностью пластид в клетке. Так как интеграция векторной конструкции происходит лишь в несколько хлоропластов, проведение нескольких последовательных 3–4 этапов регенерации при очень жесткой селекции приводит к тому, что размножаются лишь трансформированные хлоропласты и в результате все хлоропласты в клетке и растении будут нести фрагмент векторной конструкции (рис.). 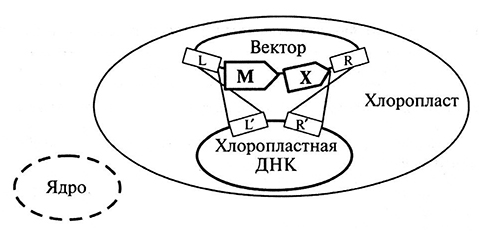 Трансформация хлоропластов В состав векторной конструкции для трансформации входят маркерный ген (M) и функциональный ген (X), окруженные последовательностями L и R, гомологичными хлоропластной ДНК. Трансформация хлоропластов основана на гомологичной рекомбинации между последовательностями L и R векторной конструкции и соответствующими последовательностями L' и R' хлоропластной ДНК. В настоящее время хлоропласты все шире используются в качестве биореакторов и публикуется все больше работ, показывающих перспективность использования пластид для наработки белковых продуктов. Введение в пластидный геном гена cry1Ас и экспрессия bt-токсина в несколько раз повысила устойчивость таких транспластомных растений табака и картофеля к насекомым по сравнению с трансгенными, трансформированными аналогичным геном, но находящимся в ядерном геноме. Дальнейший анализ показал, что в листьях транспластомных растений bt-токсин может составлять до 5 % суммарного растворимого белка. Введение же в хлоропластную ДНК трехгенного оперона сrу2Аа2, включающего также два белка-помощника, достигало максимального количества 46 % от всех белков листа. В настоящее время получены транспластомные растения табака, картофеля, томатов устойчивые к различным биотическим и абиотическим факторам. Отдельным направлением является использование транспластомных растений для производства лекарственных препаратов и съедобных вакцин. Так, введенный в хлоропластнй геном растения табака ген GH1 приводит к синтезу белка соматотропина (гормон роста), количество которого в листьях составляет до 7 % всех растворимых белков. При этом была показана высокая биологическая активность полученного белка соматотропина. Другой пример – это синтез бета-субъединицы холерного токсина в хлоропластах табака, который может быть использован в качестве вакцины. Было показано, что полученный белок был антигенно идентичен природному СТВ токсину. При этом в листьях синтезированный белок мог составлять более 4 % от всех белков, в то время как экспрессия аналогичной конструкции у ядерных трансгенов в лучшем случае достигала 0,1 %. Аналогично были получены транспластомные растения табака, экспрессирующие вакцину против сибирской язвы. Рядом исследователей было показана возможность экспрессии белка помимо листьев в хромопластах плодов томата и амилопластах клубней картофеля, хотя нужно отметить, что количество ожидаемого продукта было значительно ниже. Однако возможность экспрессии целевых генов в съедобных частях транспластомных растений открывает перспективы новому направлению–получению съедобных вакцин. |
