биотехнология. Вопросы Биотехнология. Генетическая инженерия растений, ее сущность и задачи
 Скачать 480.5 Kb. Скачать 480.5 Kb.
|
|
Однако вирусы в качестве векторов обладают и существенным^ недостатками: имеют небольшую емкость, патогенны и неспособ ны встраиваться в хромосомы хозяина. Небольшую емкость можно увеличить, если инфицировать вирусом (например, ВМЦК растительные протопласты, а не клетки. В этом случае инфекция не передается от клетки к клетке, нет необходимости в упаковке ДНК в вирусные частицы. Следовательно, часть вирусного генома, ответственная за упаковку в вирусные частицы, может быть удалена и замещена до, полнительной чужеродной ДНК. Другой недостаток — отсутствий способности встраиваться в геном растительной клетки — удается обойти (по крайней мере для ВМЦК) благодаря специальном® методическому приему — агроинфекции. Для этого геном ВМЦ1 встраивают в Т-область Ti-плазмиды и в ее составе интегрируют ядерный геном различных растений. Методы прямого переноса генов в растение. Методы прямого переноса генов в растение. Эти методы стали использоваться для растений благодаря появлению специфического объекта — изолированных протопластов, т. е. клеток, лишенных целлюлозной стенки. Методы прямого переноса генов довольно многочисленны: Трансформация растительных протопластов. Метод осуществляется благодаря комбинации методик кальциевой преципитации ДНК и слияния протопластов. Для трансформации может быть использован практически любой ДНК-вектор. Донорная ДНК может не содержать специальных биологических сигналов (vir-областей, пограничных областей Т-ДНК). Заражение культуры протопластов на начальной стадии ее роста агробактериями, которые используют в качестве векторов. Микроинъекции ДНК. Этот метод аналогичен методу микроинъекций животных клеток. Его можно рассматривать как наиболее универсальный. Эффективность трансформации растительных клеток — 10 — 20 % независимо от типа вектора. Трансформация не видоспецифична, возможен перенос генов в любое растение. Электропорация. Метод основан на повышении проницаемости биомембран за счет действия импульсов высокого напряжения. В результате молекулы ДНК проникают в клетки через поры в клеточной мембране. Упаковка в липосомы. Это один из методов, позволяющих защитить экзогенный генетический материал от разрушения нуклеазами растительной клетки. Липосомы — сферические тельца, оболочки которых образованы фосфолипидами. Метод биологической баллистики. Это один из самых эффективных методов трансформации однодольных растений. Исходный материал для трансформации — суспензионная культура, каллусная ткань или 4 — 5-дневные культивируемые незрелые зародыши однодольных. Метод основан на напылении ДНК-вектора на мельчайшие частички вольфрама, которыми затем бомбардируют клетки. Бомбардировка осуществляется с помощью биолистической пушки за счет перепада давления. Часть клеток гибнет, а выжившие клетки трансформируются, затем их культивируют и используют для регенерации растений. Получение продуктивности и улучшение их качества методами клеточной инженерии. Одной из основных задач улучшения растений является повышение качества синтезируемых продуктов: белков, жиров, полисахаридов и других веществ, определяющих их питательную и техническую ценность. У злаков наибольший интерес представляют запасные белки эндосперма. Запасные белки в основном кодируются несколькими, сходными по своей структуре и по нуклеотидному составу, генами, объединяемыми в мультигенные семейства. Обычно экспрессия этих генов строго тканеспецифична и происходит на определенной стадии развития семени. В большинстве случаев запасные белки растений имеют несбалансированный для питания человека и животных аминокислотный состав. Так, запасные белки бобовых – легумины – характеризуются низким уровнем аминокислоты метионина, а запасные белки злаков – проламины – бедны лизином, триптофаном и треонином. Дефицит этих аминокислот снижает питательную и кормовую ценность семян. Улучшение аминокислотного состава белка методами традиционной селекции довольно затруднительно в связи с тем, что гены, определяющие эти важные сельскохозяйственные признаки, часто бывают сцеплены и наследуются вместе с генами, вызывающими нежелательные признаки. Так, использование в селекции кукурузы и ячменя мутантов типа опак-2, хайпроли, имеющих относительно высокое содержание лизина в зерне, не привело к значительному улучшению качества, так как у мутантных форм повышенное содержание лизина коррелировало с уменьшением синтеза основных запасных белков зеина и гордеина и, в конечном итоге, с уменьшением продуктивности растений и урожайности посевов. В связи с этим наиболее перспективным является использование генно-инженерных методов при создании новых сортов, что позволяет ввести в геном только полезный признак, без сцепления с отрицательными свойствами. Так, например, введение дополнительных кодонов лизина в гены проламинов может привести к синтезу белков, обогащенных лизином, и улучшению кормовой и питательной ценности белка. Технология генно-инженерного улучшения качества растений и получаемой из них продукции включает ряд этапов: 1) клонирование генов запасных белков; 2) изучение механизмов тканеспецифичной и временной экспрессии белков и определение последовательностей ДНК, определяющих и регулирующих такую специфическую экспрессию; 3) целенаправленное изменение последовательности генов запасных белков с целью улучшения аминокислотного состава; 4) создание векторов, содержащих измененный ген; 5) введение модифицированных генов в растения; 6) тестирование экспрессии генов и качества продукции. Получение трансгенных растений с улучшенными качествами зерна невозможно без подготовительного этапа, включающего детальное изучение как последовательности самого гена, так и его элементов, участвующих в регуляции синтеза белка. Учеными уже охарактеризованы десятки генов запасных белков злаков, бобовых и ряда других растений, изучены структура и регуляция экспрессии генов. Исследователи уже клонировали 10 генов гордеинов ячменя, гены α - и β-глиадинов и глютенина пшеницы, зеинов кукурузы, легуминов бобовых, пататина картофеля и др. Для некоторых генов определена их нуклеотидная последовательность. Общий план изолирования генов запасных белков включает следующие этапы: 1) получение и частичная очистка соответствующей мРНК; 2) синтез и клонирование кДНК; 3) выделение из геномных библиотек последовательности гена запасного белка. Синтез запасных белков имеет жесткую регуляцию: гены экспрессируются только в единственной ткани (проламины злаков только в эндосперме зерна) и в течение короткого периода развития зерна. Исследование генов запасных белков показало общность их строения, что представляется логичным, так как они выполняют одинаковую функцию. Так, общим для подавляющего большинства генов запасных белков является отсутствие интронов. Кроме этого, у них на расстоянии 300 н. п. отточки начала транскрипции расположена специфическая последовательность в 25 н. п., названная эндосперм-боксом. Была определена функция эндосперм-бокса и показано, что именно от присутствия этой 25-нуклеотидной последовательности зависит тканеспецифичная экспрессия генов запасных белков в эндосперме зерна. Более того, продукт любого гена, перед которым находится последовательность эндосперм-бокса, синтезируется только в семенах или зернах, и представлялось логичным включение ее в состав векторов, содержащих модифицированную последовательность генов проламиновых белков с целью их последующего депонирования в семенах или зернах. Следующий этап в получении трансгенных растений с улучшенным аминокислотным составом белка можно представить на примере модифицированного α-зеина. Белок α-зеина кукурузы характеризуется низким содержанием лизина, что значительно снижает его питательную ценность. В последовательность гена α-зеина при помощи олигонуклеотид-направленного мутагенеза вводили дополнительные кодоны лизина. Полученный модифицированный ген α-зеина экспрессировал белок, содержащий лизин. Впервые такая работа была проведена по введению новых кодонов в последовательность α-зеина. Теперь такое введение новых триплетов для изменения (улучшения) аминокислотного состава белков является обычным. Модифицированный ген α-зеина был клонирован в область Т-ДНК вектора для трансформации. В состав конструкции также входила последовательность эндосперм-бокса, что приводило к тканеспецифичной экспрессии α-зеина в семенах. Были получены растения кукурузы, трансформированные геном модифицированного α-зеина, обогащенного лизином (рис.). Модифицированный белок активно синтезировался в семенах трансгенных растений кукурузы. В результате получены линии кукурузы с улучшенным качеством зерна. В дальнейшем такие трансгенные линии могут использоваться для выведения новых гибридов и сортов методами классической селекции. 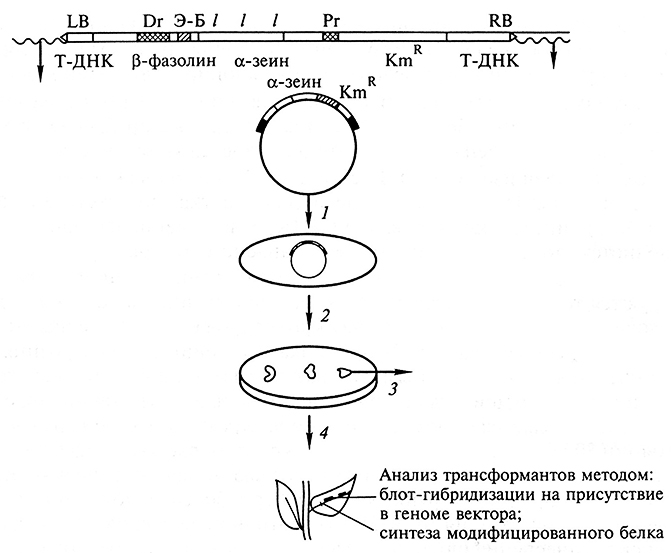 Схема получения трансгенного растения табака с интегрированным геном α -зеина, обогащенного лизиновыми кодонами: 1 – трансформация агробакгерии; 2 – трансформация растительных клеток; 3 – селекция на среде с антибиотиком канамицином; 4 – регенерация Аналогично были получены трансгенные растения пшеницы. Введение в геном растения модифицированного гена высокомолекулярной субъединицы белка глютенина с измененной последовательностью приводит к активному синтезу модифицированного белка и влияет на состав и уровень соответствующих запасных белков, что приводит к улучшению хлебопекарного качества пшеничной муки. Одним из новых подходов к улучшению состава белков является конструирование химерных генов на основе известной последовательности генов запасных белков одно- и двудольных. В качестве исходных были использованы гены гордеина В1 ячменя и легумина В4 бобов. Конструкцией, содержащей такой химерный ген, были трансформированы растения табака и получены трансгенные линии растений. Таким образом, реальной становится возможность манипулирования белковым составом эндосперма зерновых методами генетической инженерии. Помимо получения растений с измененными запасными белками было показано, что трансгенные растения могут быть использованы в качестве производителей «съедобных» вакцин. Так, получены растения табака и картофеля, синтезирующие иммуноглобулин А – G, энтеротоксин, В-токсин холеры, белок поверхностного антигена гепатита В. Белок, полученный из трансгенных растений, обладал такими же антигенными и физиологическими свойствами, как и белок, полученный из животных клеток. В настоящее время проводятся испытания по вакцинированию человека против гепатита В при помощи трансгенных растений. Из этого следует, что использование трансгенных растений может привести в будущем к получению дешевых и биологически высокоактивных вакцин. Помимо получения трансгенных растений с модифицированными запасными белками зерновых и бобовых проводятся работы по улучшению состава жирных кислот ряда масличных культур, и в первую очередь рапса. Семена рапса характеризуются высоким содержанием масла, однако из-за большого количества в нем специфической длинноцепочечной эруковой кислоты, а также глюкозинолатов вкусовые и питательные качества рапсового масла резко снижаются. С помощью генетической инженерии и последующей селекции были получены сорта рапса, содержащие гены, контролирующие длину молекулы жирных кислот, что привело к снижению доли эруковой кислоты и улучшению качества рапсового масла. Аналогичные работы ведутся по получению модифицированных жирных кислот с повышенным содержанием ненасыщенных связей, что позволит получать растения, синтезирующие новые ценные жирные кислоты. Кроме того, в последнее время было показано, что изменение состава жирных кислот может приводить к повышению устойчивости растений кряду насекомых, а также к действию пониженных температур. К 2001 г. уже прошли полевые испытания сорта трансгенных растений сои, рапса и кукурузы с модифицированным составом жирных кислот. Одним из приоритетных направлений в селекции является повышение урожайности новых сортов. Генно-инженерные разработки активно ведутся в следующих направлениях: увеличение фотосинтетической активности и увеличение синтеза отдельных веществ. Работы по увеличению фотосинтетической активности проводятся в направлении введения генов С4 фотосинтеза в С3-растения. Ген фосфоенолпируваткарбоксилазы (РЕРС) фотосинтетической системы кукурузы С4, кодирующий основной фермент, участвующий в фиксации атмосферного СО2 в клетках мезофилла листа, был клонирован и перенесен методом агробактериальной трансформации в С3-растения риса. Анализ полученных трансгенных растений показал, что активность фермента в клетках риса в 2–3 раза выше, чем у кукурузы, что привело к увеличению фотосинтетической активности и урожайности. Кроме клонирования и использования генов, непосредственно участвующих в процессах фотосинтеза, были идентифицированы гены, контролирующие количество хлоропластов в клетке. Использование таких генов также приводит к изменению уровня фотосинтеза. Другой подход основан на увеличении содержания хлорофилла в каждом хлоропласте. Были получены модифицированные белки, специфически связывающие хлорофилл а/Ь, и было показано, что повышенная экспрессия таких белков в трансгенных растениях приводит к значительному увеличению биомассы. Другое направление проводимых работ касается возможностей изменения метаболизма у трансгенных растений. Введение гена сахарозофосфатсинтетазы кукурузы (SPS-гена), являющегося ключевым ферментом в регуляции углеводного метаболизма, в геном других растений приводило к изменению углеводного обмена и повышению продуктивности растений. В настоящее время получены такие трансгенные растения томата, картофеля, рапса, хлопчатника. В 1999–2000 гг. в США, Канаде и ряде других стран, где разрешено использование трансгенных растений, уже прошли полевые испытания и используются в сельскохозяйственном производстве семь трансгенных сортов кукурузы и один сорт пшеницы, трансформированные различными генами, повышающими урожайность и качество полученной продукции. Помимо трансформации генами, приводящими к улучшению качества и повышенной продуктивности растений, в 1998–2001 гг. были получены первые четыре коммерческих сорта трансгенных цветов: сорт гвоздики с геном АСС-синтетазы, вызывающим ускоренное цветение, и три сорта (две – гвоздики и один – хризантемы) – с измененными генами биосинтеза антоциана, что привело к нетрадиционной окраске лепестков венчика. Также получены сорта петуньи и львиного зева, трансформированные конструкциями, содержащими мобильные элементы. Трансформация пластомного генома растений. Пластиды представляют собой цитоплазматические органеллы и присутствуют в каждой растительной клетке. Эволюционно пластиды произошли из цианобактерий в результате их захвата эукариотической клеткой и до настоящего времени сохранили многие характерные черты прокариотического организма, такие как прокариотический тип промотора, объединение генов в опероны, специфический генетический код, прокариотический тип механизмов транскрипции и трансляции. Функционально и морфологически пластиды могут различаться. В целом можно выявить несколько основных типов пластид, присутствующих в различных органах и тканях растения: хлоропласты (фотосинтезирующие пластиды листьев и других зеленых тканей растения), хромопласты (окрашенные пластиды цветков и зрелых плодов) и амилопласты (пластиды запасающих органов растения). Геном пластид представлен кольцевой молекулой ДНК длиной 120–180т. н. п. При этом геном всех пластид одного растения одинаков и межвидовые отличия незначительны. Пластидные гены в молекуле ДНК расположены очень компактно и функционально разделяются на два основных класса: гены, связанные с фотосинтетическим аппаратом, и гены генетических систем, включающие гены рибосомных РНК и белков, тРНК, РНК полимеразы и т. д. Большинство пластидных генов организованы вопероны и экспрессируются совместно с образованием гигантской полицистройной мРНК. Каждая клетка мезофилла листа содержит до 100 пластид. Каждая пластида полиплоидна и содержит 10–100 копий кольцевой ДНК. Таким образом, каждая клетка может содержать до 10 тыс. копий каждого гена пластидного генома. В последнее время интерес к пластидам резко возрос в связи с возможностью использования их для генной инженерии. Это прежде всего связано с высоким уровнем белкового синтеза в пластоме, материнским типом наследования и отсутствием эпигенетических процессов, таких как эффект положения и замолкание гена, значительно осложняющих экспрессию трансгенов в ядерном геноме. Однако активное использование пластид в генной инженерии сдерживалось рядом факторов и, прежде всего, трудностью доставки чужеродной ДНК через двойную мембрану пластид, а также полиплоидностью пластидного генома, так как для получения генетически стабильных трансформантов необходимо, чтобы трансген присутствовал в каждой копии пластидного генома. Впервые стабильная интеграция чужеродного гена в геном хлоропластов растений была получена в лаборатории П. Малиги в 1990 г. При помощи метода биобаллистики в геном хлоропластов табака был введен ген ααdA, определяющий устойчивость к антибиотику стрептомицину, и получено первое транспластомное растение. В настоящее время хлоропластная трансформация начинает составлять конкуренцию и является серьезной альтернативой трансформации ядерного генома растений. Причиной этого является то, что транспластомные растения имеют значительные преимущества над трансгенными растениями с трансформированным ядерном геномом с позиций более высокой эффективности продуцирования белков и большей биобезопасности для окружающей среды. В качестве основных преимуществ хлоропластной трансформации можно указать следующие: 10–50-кратное увеличение уровней экспрессии встроенного пластомного трансгена, при котором количество полученного чужеродного белка может достигать 46 % от всего количество растворимых белков клетки. Причиной такой величины экспрессии является высокая полиплоидность каждой из пластид и большое их количество в клетке, и, таким образом, при введении трансгена в хлоропластный геном число его копий в цитоплазме одной клетки может составлять 5000–10000. В то время как ядро в клетке только одно при обычной 1–4 копийности встроенного в ядерный геном трансгена; экспрессия трансгена в хлоропластах более стабильная, чем в случае ядерных трансформантов. Как указывалось выше, интеграция трансгенов в ядерный геном происходит случайно и в непредсказуемые места на хромосомах. Это часто приводит к значительным различиям в уровнях экспрессии, изменениям в уровне синтеза трансгенного белка в течение времени до полного его прекращения. В случае хлоропластной трансформации встраивание трансгена идет по конкретным и выбранным экспериментатором местам хлоропластного генома. Это исключает возможность влияния на экспрессию трансгена окружающих фрагментов хлоропластной ДНК и уменьшения синтеза трансгенного белка; все транспластомные растения, полученные при трансформации одной векторной конструкцией, всегда будут генетически и фенотипически идентичны. Это также связано с тем, что интеграция трансгена в хлоропластную ДНК может проходить только по определенным последовательностям, присутствующим как в векторной конструкции, так и хлоропластном геноме путем гомологичной рекомбинации между ними. В случае же трансформации ядерного генома трансген встраивается в состав векторной конструкции в хромосомы ядра случайным образом и получить две независимые трансформации в один и тот же участок ядерной ДНК практически невозможно из-за огромного количества (сотни тысяч и более) потенциальных мест интеграции; возможности мультигенной экспрессии трансгенов в хлоропластах с одного полицистронного транскрипта мРНК. Это связано с особенностями хлоропластных генов, которые сходны с оперонной структурой бактериальных генов, когда несколько генов транскрибируются совместно с одного промотора в виде одной мРНК. Возможность создания вектора с таким искусственным мультигенным опероном увеличивает количество генов, которые могут экспрессироваться в растениях в результате одного акта трансформации. Кроме того, значительно повышается биобезопасность таких трансгенных растений, в связи с тем, что такие мультигенные векторные конструкции не могут работать в эукариотических геномах, в том числе и у насекомых, которые могут потенциально быть вовлеченными в горизонтальный перенос; рекомбинантные белки, и прежде всего белки человека, могут нормально процессироваться в хлоропластах, образуя вторичные структуры. В случае ядерных трансгенов чужеродные белки должны вовлекаться во вторичные метаболистические пути для правильного процессинга. При этом рекомбинантные токсичные белки при экспрессии в больших количествах в цитозоле растительной клетки часто бывают нетоксичны при аккумуляции их в хлоропластах; риск распространения трансгенов в случае транспластомных растений минимален. Это связано с тем, что зрелая пыльца не содержит пластид, которые могут передаваться только от яйца к эмбриону. Таким образом, значительно повышается биобезопасность таких растений в связи с невозможностью переноса трансгена на другие растения при переопылении. |
