биотехнология. Вопросы Биотехнология. Генетическая инженерия растений, ее сущность и задачи
 Скачать 480.5 Kb. Скачать 480.5 Kb.
|
|
Фаговые векторы, космиды, BAC- и YAC- векторы. Фаговые векторы позволяют клонировать фрагменты ДНК длиной 15–25 т. П.о. Однако этого явно недостаточно, чтобы клонировать целиком многие гены животных и растений, длина которых зачастую превышает 35–40 т. П.о. Требуемой емкостью обладают векторные молекулы, называемые космидами. Космиды представляют собой небольшие плазмиды, в которые in vitro введены cos-сайты ДНК фага l. В ДНК нормальных фаговых частиц cos-сайты расположены на концах молекул, они разделяют мономеры фаговой ДНК в конкатемерах, объединяющих несколько соединенных «голова к хвосту» мономеров, которые являются предшественниками зрелых фаговых ДНК перед упаковкой в фаговые частицы. В таких конкатемерах соседние cos-сайты располагаются на расстоянии 35–45 т. П.о. Друг от друга и заключают между собой весь фаговый геном. Таким образом, наличие cos-сайтов в ДНК является, по существу, единственным необходимым условием упаковываемости ДНК в фаговые частицы. Это означает, что последовательность нуклеотидов l-ДНК, расположенная между двумя cos-сайтами, которая заключает в себе весь фаговый геном (35–45 т. П.о.), может быть замещена in vitro на аналогичный по длине (38–52 т. П.о.) Фрагмент чужеродной ДНК и эффективно упакована в фаговые частицы (такова максимальная емкость головки фага). Естественно, что такая искусственная фаговая частица оказывается нежизнеспособной. Стадия упаковки ДНК космид в фаговые частицы используется лишь для облегчения процесса введения рекомбинантных ДНК большого размера внутрь бактериальных клеток. Такой процесс имитирует проникновение фаговой хромосомы в бактерии во время фаговой инфекции. В случае космид сходство между их проникновением в бактериальные клетки и фаговой инфекцией на этом заканчивается. Однако сходство является более глубоким в случае векторов, называемых фазмидами. Фазмиды представляют собой векторные молекулы ДНК, которые содержат в себе генетические элементы плазмид и хромосом бактериофагов. Они могут обладать емкостью в отношении клонируемой ДНК, характерной для l-векторов, и существовать в определенных условиях в бактериальных клетках в виде плазмиды или же упаковываться в фаговые частицы in vivo при изменении этих условий. Сверхъемкие векторы YAC, BAC Мини-хромосомы дрожжей YAC представляют собой кольцевые молекулы ДНК, содержащие большинство вышеупомянутых генетических элементов, которые позволяют им стабильно существовать во внехромосомном состоянии в клетках дрожжей. Векторы семейства YAC являются челночными, т. Е. Обладают последовательностями нуклеотидов, необходимыми для их репликации в бактериальных клетках. Векторы YAC, содержащие клонируемые последовательности, существуют в среднем в виде одной копии на клетку, и даже в отсутствие селектирующих условий утрачиваются с очень низкой частотой (10-3-10-5 за клеточную генерацию). При увеличении общего размера вектора до 140 т. П.о. И выше, частота потери его молекул не превышает таковую, характерную для обычных хромосом дрожжей. Для преодоления трудностей, возникающих при использовании искусственных хромосом дрожжей, были сконструированы альтернативные векторные системы, среди которых наиболее популярными в настоящее время являются системы, основанные на искусственных хромосомах бактерий – BAC (bacterial artificial chromosome). В векторных системах BAC используется ДНК полового фактора (F-фактора) E. Coli – гигантской плазмиды мужских бактериальных клеток, которые являются донорами бактериальной ДНК при конъюгации с женскими клетками (рис.). Типичный F-фактор содержит гены oris, repe, para и parb, регулирующие его собственную репликацию и контролирующие число его копий в бактериальных клетках. В частности, гены oris и repe обеспечивают однонаправленную репликацию F-фактора, а гены para и parb поддерживают число его копий на уровне одной-двух на бактериальную клетку. Классический вектор BAC (pbac108l) включает в себя все эти гены, а также ген устойчивости к хлорамфениколу, используемый в качестве селектируемого маркера. Вектор содержит также фрагмент ДНК, по которому производится клонирование. В этом фрагменте имеются типичный полилинкер, а также два уникальных сайта рестрикции hindiii и bamhi, фланкированные промоторами T7- и Sp6-РНК-полимераз. Такие промоторы могут быть использованы для получения РНК-зондов, необходимых для осуществления «прогулок по хромосомам», а также прямого секвенирования клонированной ДНК в месте стыковки с вектором. Характеристика агробактерий, инфицирование растений. Agrobacterium (лат.) — группа грамотрицательных бактерий, впервые выделенная как самостоятельный род Г. Дж. Конном в 1942 году. Представители рода способны к горизонтальному переносу генов при помощи которого вызывают опухоли у растений. Наиболее исследованным и хорошо изученным видом этого рода является Agrobacterium tumefaciens. Agrobacterium широко известен своей способностью осуществлять взаимообратный перенос ДНК между собой и растениями. Благодаря этому свойству представители этого рода стали важным инструментом генной инженерии. Род Agrobacterium гетерогенен по своему составу. В 1998 году была проведена реклассификация, в результате которой всех представителей Agrobacterium разделили на четыре новых рода: Ahrensia, Pseudorhodobacter, Ruegeria и Stappia. Однако, более поздние исследования 2001—2003 годов пришли к выводу, что большую часть видов следует причислить к роду Rhizobium A. tumefaciens вызывает образование у растений злокачественных опухолей — галл. Обычно они возникают в месте смыкания корня и побега. Такие опухоли возникают в результате конъюгационного переноса бактериальной Ti-плазмиды (Т-ДНК) в клетки растения. Близкородственный вид A. rhizogenes также вызывает корневые опухоли и обладает специальной Ri-плазмидой (англ. root-inducing — индуцирующая корни). Хотя таксономическое положение Agrobacterium постоянно пересматривается, всё же можно разделить этот род на три биовара: A. tumefaciens, A. rhizogenes и A. vitis. Штаммы в группе A. tumefaciens и A. rhizogenes могут обладать либо Ti либо Ri-плазмидой, в то время как штаммы из группы A. vitis, обычно поражающие только виноград, несут Ti-плазмиду. Из природных образцов были выделены штаммы не относящиеся к Agrobacterium, которые несли Ri-плазмиду, а лабораторные исследования показали, что штаммы не относящиеся к Agrobacterium также могут нести Ti-плазмиду. Многие природные штаммы Agrobacterium не обладают ни Ti ни Ri-плазмидой и, поэтому, не являются вирулентными. Плазмидная T-ДНК полуслучайным образом внедряется в геном клетки хозяина[6], и происходит экспрессия генов, ответственных за образование опухоли, что в конечном итоге приводит к образованию галла. T-ДНК содержит гены, кодирующие ферменты, необходимые для синтеза нестандартных аминокислот, обычно октопина или нопалина. Здесь же закодированы ферменты для синтеза растительных гормонов ауксина и цитокинина, а также для биосинтеза разного рода опинов, которые обеспечивают бактериям источник углерода и азота, недоступный для других микроорганизмов. Такая стратегия даёт Agrobacterium селективное преимущество[7]. Изменение гормонального баланса растения, приводит к нарушению деления клеток и образованию опухоли. Соотношение ауксина к цитокину определяет морфологию опухоли (корнеобразная, бесформенная или побегообразная). Характеристика Ti плазмид и Т-ДНК. Ti-плазми́да (англ. Ti plasmid от англ. tumor inducing — индуцирующая образование опухолей) — плазмида почвенной бактерии Agrobacterium tumefaciens, с помощью которой она вызывает опухоли у растений. Участок Ti-плазмиды, известный как T-ДНК[en] (от англ. transfer DNA), может встраиваться в геном растений и содержит гены биосинтеза фитогормонов и опинов[en], которые запускают образование опухоли. Ti-плазмида представляет собой кольцевую[en] двуцепочечную молекулу ДНК, состоящую из 214 233 пар оснований (п. о.) и содержащую 199 генов. В состав плазмиды входит участок длиной от 12 до 22 тысяч п. о., известный как T-ДНК, который может интегрироваться в геном растения. Шесть генов, локализованных в T-ДНК — iaaM1, iaaH2, ipt, tml6, 6a, 6b, — отвечают за биосинтез опинов и некоторых фитогормонов, причём гены iaaM, iaaH2 и ipt являются онкогенами. Экспрессия этих генов запускает образование опухоли — клубенька на корне заражённого растения. Помимо T-ДНК, в состав Ti-плазмиды входит область vir, представленная опероном virABCDEFG. Гены vir отвечают за вырезание и перенос T-ДНК в клетки растения. Ген virA кодирует рецептор (гистидинкиназу[en]), который реагирует на такие фенольные соединения, как ацетосирингон[en], сирингальдегид[en] и апоцинин, которые выходят наружу из повреждённых клеток растения. Ген virB кодирует белки, образующие подобие пилей, продукт гена virC связывается с последовательностью, которая будет перенесена, а белки, кодируемые генами virD1 и virD2, являются эндонуклеазами, которые распознают прямые повторы на концах T-ДНК и вносят разрезы в этих областях при участии вспомогательного белка virD4. Продукт гена virE опосредует собственно перенос T-ДНК в растительную клетку, а белок, кодируемый геном virG, запускает экспрессию генов vir, после того как его фосфорилирует активированный белок virA. Также Ti-плазмида содержит гены переработки опинов и tra-область, которая обеспечивает конъюгативный перенос плазмиды между двумя бактериями[7]. Внедрение T-ДНК в растительный геном протекает в четыре этапа: формирование контакта между бактерией и стенкой растительной клетки; проникновение T-ДНК внутрь клетки растения; встраивание T-ДНК в растительный геном; экспрессия генов T-ДНК в растительной клетке. T-ДНК может попасть внутрь растения только в месте повреждения ввиду особенностей рецептора virA, описанных выше. Кроме того, на проникновение влияет кислотность окружающей среды и температура. Проникновение T-ДНК опосредовано особыми T-пилями, которые в виде пучка тонких гибких фибрилл располагаются на одном из полюсов бактериальной клетки. Вырезание и интеграцию T-ДНК в растительный геном опосредуют продукты генов vir. Процесс переноса T-ДНК в цитоплазму бактериальной клетки занимает 30 минут, причём сама бактерия внутрь растительной клетки не попадает, а находится в межклеточном пространстве и использует инфицированные T-ДНК клетки в качестве поставщика опинов, которые служат источником углерода и азота для бактерии. В индукции экспрессии генов вирулентности также задействованы особые внутриклеточные метаболиты растения, образующиеся при раневых повреждениях. Использование агробактерий для введения чужеродных генов. Самый эффективный метод переноса генов в растения — использование в качестве вектора почвенной бактерии Agrobacterium tumefaciens. Эта бактерия содержит плазмиду, в которую можно встроить необходимый для переноса ген. Agrobacterium tumefaciens заражает большинство двудольных растений и вызывает у них образование больших наростов, называемых корончатыми галлами, которые представляют собой подобие раковой опухоли (рис. 25.13). В норме в ответ на повреждение растение выделяет химические вещества, стимулирующие клеточное деление; при этом образуется группа клеток, называемых каллусом, которые быстро закрывают рану. Химические вещества, выделяемые поврежденными клетками растения, стимулируют и клетки Agrobacterium, которые заражают рану и вызывают образование галла. Этот процесс контролируется бактериальной плазмидой (Ti-плазмида; от англ. tumor-inducing). Она проникает в растительную клетку и встраивается в ДНК растения. Это приводит к нерегулируемому росту. Сама бактерия не попадает в клетки, но может жить между ними, используя питательные вещества, которые производят растительные клетки под контролем плазмидной ДНК. Клетки растений, содержащие встроенную в их геном Ti-плазмиду с чужеродным геном, называются трансформированными. К сожалению этот метод долгое время был неприменим к однодольным растениям, к которым относятся такие важные сельскохозяйственные культуры, как кукуруза и пшеница. Однако сейчас эта проблема решена. Метод трансформации используется для улучшения сортов томатов, картофеля и многих древесных растений. С помощью техники клонирования, описанной в разд. 21.3, из одной трансформированной клетки можно получить целое растение. Для этого клетки сначала выращивают в жидкой культуре, затем образовавшуюся недифференцированную массу, называемую каллусом, помещают на питательный агар. При правильном соотношении гормонов формируются побеги, корни и вырастает новое растение. Другой способ получения трансформированных растений подразумевает использование Agrobacterium. Диски, нарезанные из листьев, заражают бактерией и раскладывают на питательном агаре. В процессе роста трансформированные клетки формируют корни и побеги. 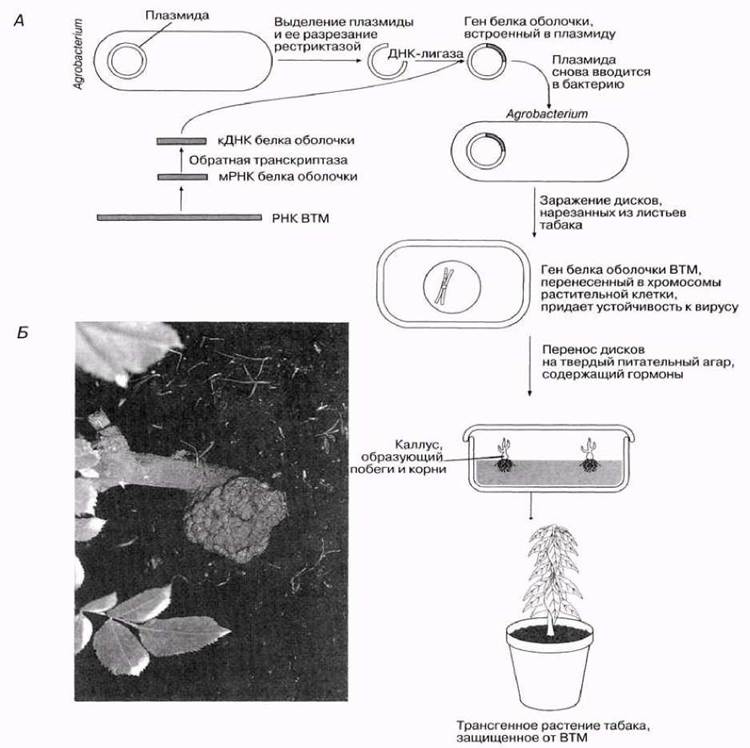 Рис. 25.13 А. Введение нового гена в растительную клетку с помощью Agrobacterium. Б. Корончатый галл, образующийся при заражении раны бактерией Agrobacterium. Использование вирусов В генной инженерии бактерий роль векторов обычно играют бактериофаги (вирусы бактерий); вероятно, для трансформации растений можно использовать растительные вирусы. Использование «ружья» Неожиданно эффективным оказалось введение чужеродной ДНК в клетки растений с помощью специального ружья. Нужная ДНК упаковывается в золотые или вольфрамовые бусинки диаметром 1 мм. Их размещают на кончике пластиковой пули, которую вставляют в ствол специально сконструированного ружья. В первоначальном варианте пуля выстреливалась обычным способом, т. е. с помощью взрывного заряда, однако сейчас для выстрела используют сжатый газ. Пуля разрывается в камере на поверхности, имеющей микроскопические отверстия. Некоторые из частичек упакованной ДНК попадают через эти отверстия в мишень, которой являются растительные клетки или ткани. Выстрел производится в вакууме, поэтому частички ДНК не оседают. Они обнаруживаются в цитоплазме трансформированных клеток. Векторы на основе ДНК-содержащих вирусов растений Вирусы можно рассматривать как разновидности чужеродной нуклеиновой кислоты, которые реплицируются и экспрессируются в клетках растений. Подавляющее большинство фитовирусов в качестве носителя генетической информации содержат РНК. Только 1 — 2 % чирусов, инфицирующих растения, относятся к ДНК-содержа- щим. Именно эти вирусы удобны для использования в технологии Рекомбинантных ДНК, а также в качестве векторов. ДНК-содержащие вирусы могут включать одноцепочечную или двухцепочечную ДНК. В качестве представителей первой группы можно назвать вирус золотистой мозаики фасоли (ВЗМФ| или вирус полосатости кукурузы. Наиболее изученный представитель группы вирусов с двухцепечечной ДНК — вирус мозаики цветной капусты (ВМЦК), поражающий в основном растения’ семейства крестоцветные. Обычно фитовирусы реплицируются с образованием большое го числа копий молекул нуклеиновых кислот — 106 и более молекул на зараженную клетку. Поэтому фитовирусы представляют собой очень эффективные средства для получения хорошей экспрессии чужеродного гена. Кроме высокой копийности вирусной нуклеиновой кислоты вирусные векторные системы имеют еще ряд преимуществ: малый размер генома (возможность легкой манипуляций вирусной ДНК) и сильные промоторы, обеспечивающие эффективную экспрессию чужеродных генов. |
