микра для 3 занятия. Различают простые и сложные методы окраски
 Скачать 0.68 Mb. Скачать 0.68 Mb.
|
|
Для изучения морфологии бактерий можно готовить из них прижизненные (нативные) препараты и наблюдать бактерии в неокрашенном состоянии или делать мазки из фиксированных культур с последующей окраской различными анилиновыми красителями. Различают простые и сложные методы окраски. • Простые методы заключаются в применении одного вида красителей и предназначены главным образом для изучения морфологии бактерий. • Сложные методы требуют последовательного использования различных видов красителей и в некоторых случаях применения обесцвечивающих веществ. Сложные методы разделяют на дифференциальные, позволяющие различать бактерии по результатам окраски (например, методы Грама и Циля-Нельсена), и структурные, которые применяют для выявления различных структур бактерий. Применение сложных методов окраски позволяет определить тинкториальные свойства бактерий, т.е. их отношение к красителям. Процесс приготовления препарата для микроскопии включает следующие основные этапы: • приготовление мазка; • высушивание мазка на воздухе; • фиксацию мазка в пламени спиртовки; • окраску фиксированного мазка анилиновыми красителями. При приготовлении микроскопических препаратов исследуемую культуру бактерий обычно забирают из пробирки или чашки Петри с плотной питательной средой с помощью бактериологической петли (рис. 2.2). Жидкую (бульонную) культуру бактерий можно наносить на предметное стекло с помощью стерильной пипетки. Техника приготовления мазка из чистой культуры бактерий Для приготовления мазка на чистое, обезжиренное предметное стекло (ближе к одному концу) непосредственно проволочной петлей наносят небольшую каплю водопроводной воды или стерильного физиологического раствора. Можно также наносить воду с помощью пипетки Пастера. Пробирку берут в одну руку, а бактериальную петлю удерживают в другой руке, затем ее стерилизуют в пламени горелки, нагревая докрасна. После этого открывают пробирку двумя свободными пальцами руки с петлей (безымянным пальцем и мизинцем) и, удерживая пробку в руке, аккуратно обжигают горлышко пробирки. Затем, предварительно остудив петлю на воздухе, снимают небольшое количество культуры бактерий с поверхности питательной среды и равномерно распределяют петлей в капле воды, чтобы получить тонкий, овальной формы мазок размером до 2 см2. Остаток культуры бактерий на петле следует сжечь в пламени спиртовки. Мазок должен быть тонким, и материал в нем должен быть распределен равномерно, так как только при этом условии препарат удобен для изучения окрашенных микроорганизмов. После этого пробирку закрывают (см. рис. 2.2). После приготовления мазок высушивают на воздухе или для ускорения процесса в струе теплого воздуха над пламенем спиртовки, не давая капле закипеть. Маркером или восковым карандашом отмечают участок с нанесенным мазком с обратной стороны стекла. Для фиксации мазка предметное стекло (мазком вверх) медленно проносят 3 раза (в течение 5-6 с) через верхнюю часть пламени горелки. При фиксации бактерии погибают, приклеиваются к стеклу и не смываются при дальнейшей обработке. Более длительное нагревание может вызвать деформацию клеточных структур. Для того чтобы проверить, достаточно ли зафиксирован препарат, следует прикоснуться стеклом к тыльной поверхности ладони руки. Ощущение чувства легкого жжения свидетельствует о том, что препарат хорошо зафиксирован. 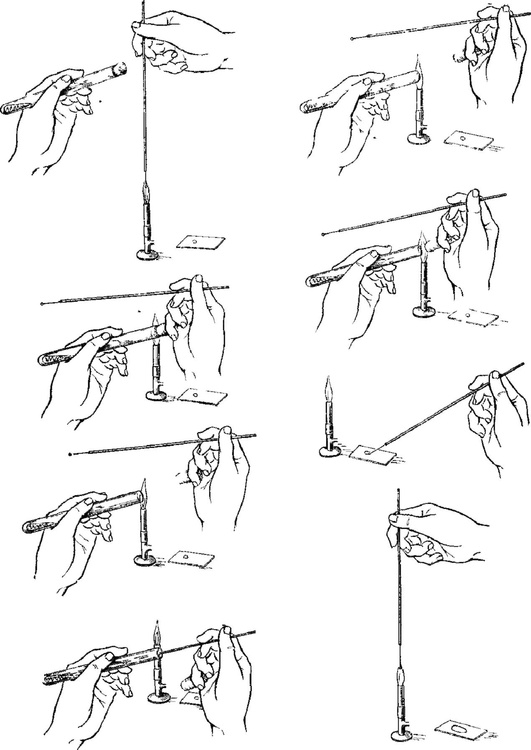 Рис. 2.2. Техника приготовления мазка (пояснения см. в тексте) Методика окраски мазка простым методом После охлаждения предметного стекла производят окраску мазка. Для простого метода окраски на поверхность фиксированного мазка пипеткой наносят водный фуксин (краситель красного цвета) на 1-2 мин или метиленовый синий, который выдерживают 3-5 мин. Затем краситель сливают, мазок тщательно промывают водопроводной водой, снова высушивают на воздухе или фильтровальной бумагой (осторожно его промокая). Приготовленные препараты из чистых культур бактерий микроскопируют с помощью светового микроскопа с иммерсионной системой (см. раздел 2.6). Если препарат правильно приготовлен, то поле зрения должно быть бесцветным, а бактерии интенсивно окрашены в цвет красителя. 2.2.2. Строение бактериальной клетки В строении бактериальной клетки различают (рис. 2.3): • основные, жизненно необходимые структуры (клеточную стенку, цитоплазматическую мембрану с мезосомами, цитоплазму, рибосомы и нуклеоид); • дополнительные структуры (пили, жгутики, капсулу, споры, плазмиды и различные виды цитоплазматических включений), которые встречаются не у всех бактерий, но дают им преимущества, поскольку позволяют адаптироваться к различным условиям существования в окружающей среде. Клеточная стенка - четко очерченная, относительно прочная структура, обладающая эластичностью и упругостью: • обеспечивает стабильность формы бактерий, сдерживает высокое осмотическое давление в клетке; • защищает бактерии от механических воздействий; • участвует в процессе деления бактерий и спорообразовании, транспорте метаболитов; • является рецептором для бактериофагов; • контактирует с внешней средой. 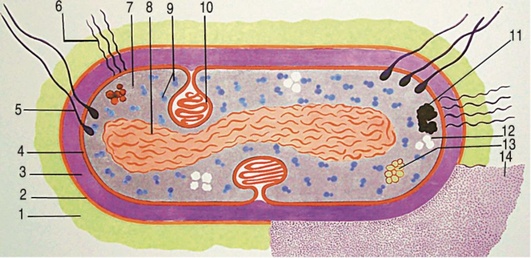 Рис. 2.3. Структура бактериальной клетки: 1-2 - капсула*; 3 - клеточная стенка; 4 - цитоплазматическая мембрана; 5 - жгутики*; 6 - пили*; 7 - цитоплазма; 8 - нуклеоид; 9 - рибосомы; 10 - мезосома; 11-13 - цитоплазматические включения*; 14 - слизь* (пояснения см. в тексте); * - дополнительные структуры По строению клеточной стенки различают грамположительные и грамотрицательные бактерии (методику окраски по Граму см. в разделе 2.2.3). Цитоплазматическая мембрана прилежит к внутренней поверхности клеточной стенки бактерий и окружает цитоплазму. Цитоплазматическая мембрана состоит из двойного слоя фосфолипидов и интегральных белков, пронизывающих ее насквозь. Эта структура участвует в регуляции осмотического давления, транспорте веществ и энергетическом метаболизме клетки. Выросты цитоплазматической мембраны представляют собой сложно закрученные мембранные структуры - мезосомы, которые участвуют в энергетическом обмене клетки, а также в процессах деления и спорообразования бактерий. Цитоплазма - внутренняя среда клетки, содержит большое количество воды, растворимых белков, рибонуклеиновых кислот и других органических и неорганических веществ и микроэлементов. В цитоплазме расположены рибосомы бактерий, нуклеоид, а также различные включения: гранулы гликогена, полисахаридов, полифосфатов (зерна волютина). Рибосомы бактерий состоят из двух субъединиц (30S и 50S) и имеют константу седиментации 70S, в отличие от эукариот, размер рибосом которых 80S. Рибосомы принимают участие в синтезе белка. Нуклеоид (хромосома бактерий) - ядерный аппарат бактерий, представлен двунитевой ДНК, обычно замкнутой в кольцо, но может быть и линейной формы. Нуклеоид бактерий не имеет ядерной оболочки, ядрышка и белков гистонов. Капсула - слизистая структура, которая может закрывать клеточную стенку снаружи и имеет четко очерченные границы. Капсула состоит из полисахаридов или полипептидов, защищает бактерии от высушивания и препятствует фагоцитозу. Капсулы присущи некоторым видам бактерий или могут образовываться при попадании микроорганизма в макроорганизм. Капсулы выявляют методами негативного контрастирования (см. раздел 2.2.4). Жгутики - дополнительные структурные образования, придающие бактериям подвижность. Они состоят из белка флагеллина и прикрепляются к цитоплазматической мембране и клеточной стенке с помощью специальных дисков. В длину жгутики значительно превышают размер бактериальной клетки, но значительно тоньше ее. Жгутики обычно обнаруживают у палочковидных бактерий. В зависимости от числа и расположения жгутиков бактерии подразделяют (рис. 2.4) на: 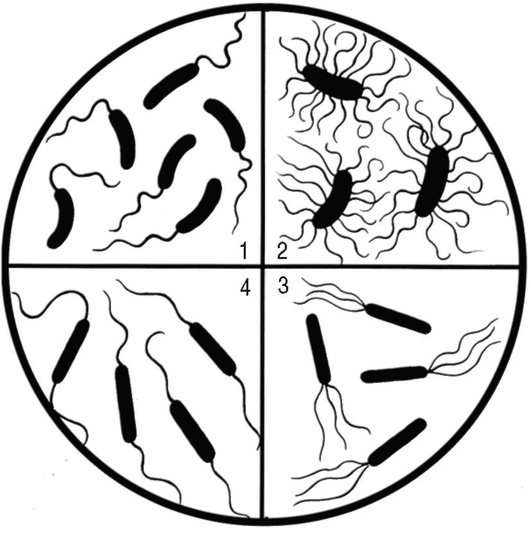 Рис. 2.4. Классификация бактерий по расположению жгутиков: 1 - монотрихи; 2 - перитрихи; 3 - лофотрихи; 4 - амфитрихи • монотрихи, имеющие один жгутик на одном из полюсов клетки; • перитрихи, обладающие десятками жгутиков, отходящих по периметру бактерии; • лофотрихи, имеющие пучок жгутиков на одном из полюсов клетки; • амфитрихи, имеющие жгутики на обоих полюсах клетки (по одному или в виде пучков). Жгутики можно обнаружить у бактерий по их подвижности в нативном препарате (висячей или раздавленной капле) либо при окраске методами Леффлера или серебрения (см. ниже). Пили (фимбрии) - нитевидные структуры, более тонкие и короткие, чем жгутики, которые отходят от поверхности клетки и состоят из белка пилина. Пили служат для прикрепления (адгезии) бактерий к клетке-мишени, ответственны также за питание, водно-солевой обмен, являются рецептором для бактериофагов. F-пили участвуют в процессе передачи генетического материала при конъюгации. Пили у бактерий можно увидеть с помощью электронного микроскопа. Споры - своеобразная покоящаяся форма существования некоторых грамположительных бактерий (клостридий и бацилл). Они образуются во внешней среде при неблагоприятных условиях существования бактерий (высушивании, дефиците питательных веществ и др.). Споры не служат для размножения бактерий, поэтому из одной бактериальной клетки формируется только одна спора (эндоспора). Споры бактерий могут длительное время (десятки лет) сохраняться в объектах окружающей среды, например в почве, поскольку имеют плотную, многослойную оболочку, содержащую дипиколинат кальция, обусловливающий устойчивость спор. Споры различных бактерий отличаются по форме, размеру и расположению (центральному, терминальному или субтерминальному) в вегетативной части клетки, что является дифференциально-диагностическим видовым свойством бактерий (рис. 2.5). У бактерий рода Bacillus диаметр споры не превышает поперечника вегетативной клетки, а у бактерий рода Clostridium размер споры больше диаметра клетки. Споры бактерий окрашивают по методу Ауески, а также по методу Циля-Нильсена (см. раздел 2.2.4). В цитоплазме некоторых бактерий можно обнаружить включения в виде зерен гликогена, крахмала, поли-β-масляной кислоты или волютина, которые представляют собой запас питательных веществ, метаболитов или источников энергии для бактерий. У дифтерийной палочки такие включения носят название зерен волютина и располагаются на концах клетки, что придает им вид булавы. Эти включения у Corynebacterium diphtheriae состоят из полифосфатов и проявляют феномен метахромазии: волютин окрашивается в иной цвет, чем цитоплазма бактерии. Для обнаружения зерен волютина применяют окраску по Нейссеру.  Рис. 2.5. Варианты расположения спор у бактерий (окраска по Ауески): 1 - центральное расположение у бацилл; 2 - терминальное расположение у клостридий столбняка; 3 - субтерминальное расположение у клостридий ботулизма 2.2.3. Дифференциальные методы окраски бактерий (окраска по Граму и методу Циля-Нильсена) Сложные дифференциальные методы окраски широко применяют в микробиологии, поскольку позволяют отличить бактерии друг от друга по тинкториальным свойствам. При использовании этих методов окраски последовательно применяют красители контрастного цвета и обесцвечивающие (дифференцирующие) вещества (спирт или кислоту). Методика окраски по Граму (модификация по Синеву) • На фиксированный мазок кладут сухую полоску фильтровальной бумаги, пропитанной карболово-спиртовым раствором генцианового фиолетового (по Синеву), наносят на нее 2-3 капли воды и выдерживают 1-2 мин. • Бумагу снимают пинцетом и, не промывая водой, наносят на мазок раствор Люголя (содержит йод) на 1 мин; мазок при этом чернеет. • Сливают раствор Люголя, обесцвечивают 95% этиловым спиртом, наливая его 2-3 раза или погружая стекло в стаканчик со спиртом в течение 30-40 с до прекращения отхождения фиолетовых струек красителя. • Тщательно промывают мазок водой для удаления спирта. • Наносят на мазок водный раствор фуксина на 1-2 мин. • Сливают краску, промывают мазок водой, высушивают фильтровальной бумагой и микроскопируют. Грамположительные бактерии окрашиваются основным красителем в темно-фиолетовый цвет в начале окраски, грамотрицательные - контрастным красителем в красный цвет на последнем этапе окрашивания (рис. 2.6). 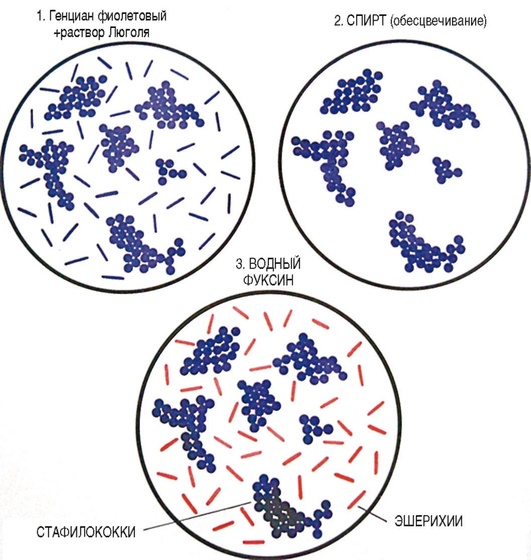 Рис. 2.6. Механизм и этапы окраски по Граму. Фиолетовым цветом показаны грамположительные бактерии, красным - грамотрицательные (пояснения см. в тексте) В основе дифференциации бактерий лежит строение клеточной стенки грамположительных (толстостенных) и грамотрицательных (тонкостенных) бактерий, вследствие чего они неодинаково воспринимают красители при окраске по методу Грама. Способность грамположительных бактерий удерживать краситель генциановый фиолетовый в комплексе с йодом связана со значительным содержанием в их клеточной стенке многослойного пептидогликана, наличием тейхоевых и липотейхоевых кислот (которые отсутствуют у грамотрицательных бактерий) и особенностями структурной организации клеточной стенки, поры в которой сужаются при обработке спиртом, задерживая краску. В связи с тем что грамотрицательные бактерии имеют один слой пептидогликана и большое количество липидов в составе их клеточной стенки, она имеет более высокую проницаемость и при обесцвечивании спиртом комплекс «генциановый фиолетовый-йод» легко удаляется через поры клеточной стенки, в результате чего грамотрицательные бактерии приобретают цвет контрастного (дополнительного) красителя - водного фуксина. Подавляющее большинство бактерий хорошо окрашиваются по методу Грама, поэтому его считают основным в микробиологии. Исключение составляют спирохеты, плохо воспринимающие анилиновые красители, внутриклеточные паразиты (риккетсии и хламидии), а также бактерии, не имеющие клеточной стенки (микоплазмы и L-формы бактерий). Микобактерии в связи с особенностями строения их клеточной стенки обычно окрашивают по методу Циля-Нильсена. Методика окраски по Цилю-Нильсену Метод также относят к сложным дифференциальным способам окраски бактерий и применяют для окрашивания кислотоустойчивых микобактерий - возбудителей туберкулеза (Mycobacterium tuberculosis и других микобактериозов) и лепры (Mycobacterium leprae). В связи со значительным количеством липидов, миколовых кислот и восков в их клеточной стенке кислотоустойчивые бактерии слабо воспринимают анилиновые красители, поэтому по Граму окрашиваются плохо. Для выявления этих бактерий можно применять флюорохромы (аурамин) или концентрированные растворы красителей, содержащие протравители (например, карболовую кислоту). Для увеличения проницаемости клеточной стенки первый этап окрашивания проводят при подогревании мазка. При последующем воздействии минеральных кислот окрашенные микобактерии не обесцвечиваются, так как являются кислотоустойчивыми. Техника окраски по Цилю-Нильсену • На высушенный и фиксированный мазок кладут кусочек фильтровальной бумаги (по размеру мазка), наливают карболовый раствор фуксина Циля и, удерживая стекло пинцетом, подогревают над пламенем спиртовки (но не в пламени!) до появления паров. При подсыхании красителя вследствие его испарения осторожно доливают карболовый фуксин на полоску фильтровальной бумаги. Манипуляцию повторяют 2-3 раза, каждый раз отставляя стекло в сторону для охлаждения (наблюдать за появлением паров удобнее, глядя на мазок сбоку). • Снимают бумагу пинцетом. Дают препарату остыть и после этого промывают водой. • Обесцвечивают мазок 5% раствором серной кислоты, погружая в стаканчик с кислотой 3-5 раз, не задерживая в кислоте. Можно также наносить кислоту на препарат на 1-2 мин до полного обесцвечивания. На этом этапе мазок становится бесцветным, почти таким, каким был до окрашивания карболовым фуксином. • Мазок тщательно промывают водой, чтобы прекратить обесцвечивание. • Окрашивают препарат метиленовым синим в течение 5-7 мин. Мазок становится интенсивно голубым. • Промывают водой, высушивают, микроскопируют. При микроскопии голубой фон облегчает обнаружение кислотоустойчивых бактерий. Микобактерии (тонкие, длинные, слегка изогнутые или толстые, короткие, прямые палочки) приобретают рубиново-красную окраску на первом этапе, когда препарат окрашивают горячим карболовым фуксином Циля, и не обесцвечиваются раствором серной кислоты. Некислотоустойчивые бактерии легко теряют окраску при обработке кислотой и окрашиваются в синий цвет метиленовым синим на последнем этапе окрашивания по Цилю-Нильсену (рис. 2.7). 2.2.4. Дополнительные структуры бактерий и их выявление Сложные методы окраски для обнаружения различных структур бактерий применяют реже, чем дифференциальные методы. Среди них наиболее часто используют выявление капсул, спор и зерен волютина у бактерий.  Рис. 2.7. Препарат мокроты, окрашенный по методу Циля-Нельсена. Красным цветом показаны кислотоустойчивые микобактерии (пояснения см. в тексте) Капсула бактерий не воспринимает анилиновые красители вследствие большого содержания воды и отсутствия у нее жесткой структуры. В связи с этим для выявления капсул применяют методы негативного контрастирования, когда окрашивают фон (предметное стекло, ткань органа, слизь мокроты и др.) и клеточную стенку бактерий, а капсула остается неокрашенной. При этом в мазках из органов зараженного животного или из патологического материала, взятого от больного человека (например, мокроты), капсулы бактерий можно выявить с помощью простого метода окраски или метода Грама. В препарате, окрашенном, например, водным фуксином, на розовом фоне будут видны бактерии красного цвета, окруженные бесцветной капсулой. При окраске по Граму грамположительные бактерии, окрашенные в сине-фиолетовый цвет, располагаются на красном фоне и также окружены бесцветной капсулой (рис. 2.8). Для окраски чистой культуры бактерий, выращенных на питательной среде, используют метод Бурри-Гинса. Техника окраски по Бурри-Гинсу для выявления капсул у бактерий • На предметное стекло (ближе к одному концу) наносят каплю черной туши, а рядом с ней - каплю воды, в которую вносят культуру бактерий, образующих капсулу. Обе капли тщательно перемешивают узким краем другого чистого предметного стекла, ставят его под углом 45° и, когда капля смеси растечется вдоль его ребра, приготовляют мазок по типу мазка крови. Тушевый мазок высушивают и фиксируют в пламени спиртовки. 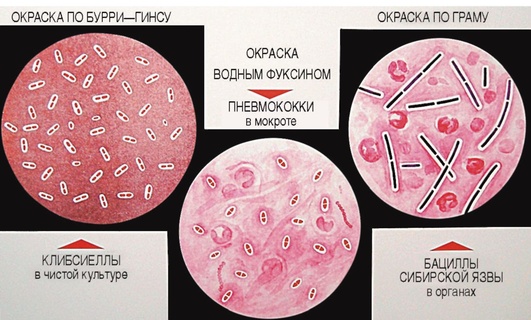 Рис. 2.8. Выявление капсул у бактерий методами негативного контрастирования (пояснения см. в тексте) • Наносят карболовый фуксин Циля (в разведении 1:3) на 2-3 мин. Промывают водой, высушивают на воздухе и микроскопируют. В препарате из чистой культуры, окрашенном по методу Бурри-Гинса, видны бактерии красного цвета, вокруг которых контрастно выделяются неокрашенные капсулы на коричнево-черном фоне (см. рис. 2.8). Выявление капсул у бактерий, находящихся в тканях макроорганизма, проводят по методу Романовского-Гимзы. Техника окраски по Романовскому-Гимзе • Приготовленный препарат высушивают и фиксируют жидким фиксатором (метанолом, этиловым спиртом) в течение 5-20 мин. • Фиксированный препарат подсушивают и помещают в стаканчик с красителем на 20-25 мин. Краситель (сухая краска Романовского-Гимзы) состоит из азура, метиленового синего и эозина, которые отдельно растворяют в 1 л дистиллированной воды и перед употреблением смешивают в соотношении 10 мл дистиллированной воды, 4 мл эозина, 8 мл краски Романовского-Гимзы. Жгутики бактерий настолько тонки (толщина 12-20 нм), что их не удается увидеть при световой микроскопии при обычных способах окраски. Жгутики у бактерий можно обнаружить в электронном, световом микроскопе с помощью окраски методом Леффлера или методом серебрения по Морозову либо по подвижности бактерий в препарате раздавленной или висячей капли (косвенный метод выявления жгутиков). Жгутики бактерии окрашиваются плохо, поэтому для их выявления применяют различные протравы, которые вызывают их разбухание в результате денатурации белка флагеллина, увеличивая визуально их толщину. При окраске, например, по методу Леффлера молодую культуру бактерий, выращенную при оптимальных условиях в течение 12-18 ч, протравливают смесью спиртового раствора фуксина, танина и раствора сернокислого железа с подогревом. Затем докрашивают карболовым фуксином Циля. При микроскопии препарата видны крупные красные палочки, окруженные длинными жгутиками розового цвета (рис. 2.9). Для обнаружения подвижности живых бактерий готовят препараты висячей или раздавленной капли. 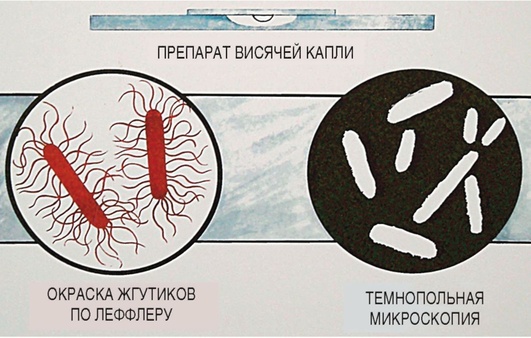 Рис. 2.9. Выявление жгутиков у бактерий (пояснения см. в тексте) Для приготовления препарата висячей капли используют специальные предметные стекла с углублением (лункой) в центре. Небольшую каплю исследуемого материала наносят на середину покровного стекла. Края лунки предметного стекла смазывают вазелином и накрывают им покровное стекло так, чтобы капля находилась в центре лунки. Быстро переворачивают препарат покровным стеклом вверх. Капля должна свободно свисать над центром герметично закрытой полости лунки, не касаясь ее дна и краев. При приготовлении препарата раздавленной капли на середину чистого, обезжиренного предметного стекла стерильной петлей или пастеровской пипеткой наносят каплю исследуемого материала и накрывают ее покровным стеклом так, чтобы не образовалось пузырьков воздуха (т.е. раздавливают каплю). Необходимо следить, чтобы капля была небольшой: жидкость должна заполнить все пространство под покровным стеклом, но не вытекать за его края. Приготовленные нативные препараты в виде раздавленной или висячей капли рассматривают в затемненном поле зрения светового микроскопа при опущенном конденсоре и суженной диафрагме (для уменьшения интенсивности освещения). Сначала микроскопируют с помощью объектива с увеличением х8, а после обнаружения края капли устанавливают объектив х40 или иммерсионный. В поле зрения должны быть видны хорошо освещенные подвижные бактерии на темном фоне (см. рис. 2.9). Форма, величина и характер расположения спор в клетке - видовой признак бактерий, и их обнаружение используют при постановке микробиологического диагноза. Споры бактерий имеют толстую оболочку (кортекс) и поэтому не воспринимают водные растворы анилиновых красителей. При окраске простыми методами или по Граму они остаются бесцветными структурами внутри окрашенных вегетативных клеток бактерий, поэтому для окраски спор используют сложные, специальные методы окраски - методы Ауески1 или Циля-Нельсена. Техника приготовления препарата и окраска спор бактерий по методу Ауески. Метод Ауески основан на предварительном протравливании нефиксированного мазка из спорообразующих бактерий в кислоте для повышения проницаемости оболочки спор и последующем воздействии концентрированных растворов красителей при высокой температуре. • На предметном стекле готовят густой мазок из бактерий. Мазок высушивают и, не фиксируя, наливают на него 0,5% раствор хлористоводородной кислоты для протравы; осторожно подогревают над пламенем горелки в течение 1-2 мин до закипания. • Остатки кислоты сливают. Мазок (после охлаждения) промывают водой, высушивают, фиксируют в пламени горелки. • Далее фиксированный препарат окрашивают по методу Циля-Нельсена (см. выше). Споры окрашиваются фуксином Циля в красный цвет и вследствие их кислотоустойчивости не обесцвечиваются в последующем серной кислотой. Цитоплазма вегетативных форм бактерий обесцвечивается кислотой и окрашивается метиленовым синим (см. рис. 2.5). Выявление зерен волютина у Corynebacterium diphtheriae имеет важное диагностическое значение при постановке диагноза дифтерии и для дифференциации дифтерийной и ложнодифтерийной бактерий. 1 Метод Ауески (Anjesky) в некоторых вариантах транскрипции читают как метод Ожешко (Ожешки). Выявление зерен волютина по Нейссеру • Фиксированный препарат в течение 1-2 мин окрашивают ацетатом синьки Нейссера. • Краситель смывают и на препарат наносят несколько капель раствора Люголя на 1 мин. • Мазок промывают водой и подсушивают. • Докрашивают препарат раствором везувина или хризоидина в течение 2-3 мин. По окончании окрашивания мазок промывают водой, высушивают и исследуют под микроскопом. Зерна волютина, имеющие щелочную реакцию, окрашиваются ацетатом синьки в темно-синий цвет. Цитоплазма клеток, имеющая кислое значение pH, воспринимает щелочной краситель везувин (хризоидин) и окрашивается в желтый или светло-коричневый цвет. У возбудителя дифтерии зерна волютина расположены строго на обоих полюсах клетки (рис. 2.10). |
