кристалы. Развитие многих отраслей современной техники тесно связано с использованием кристаллов
 Скачать 0.72 Mb. Скачать 0.72 Mb.
|
|
Введение Развитие многих отраслей современной техники тесно связано с использованием кристаллов. Растущая потребность в кристаллах, обладающих определенным комплексом свойств: высоким структурным совершенством, отсутствием нежелательных примесей, сложным химическим составом, четко реагирующим на многие физические воздействия, – обусловила интенсивное развитие новой отрасли – выращивание кристаллов. Кристаллизация – это сложный физико-химический процесс, протекание которого зависит от большого числа факторов. Сложность описания такого процесса определяется как количеством и разнообразием этих факторов, так и недостаточностью, во многих случаях, знаний о механизме роста кристаллов. Тем не менее уже в настоящее время успех в получении кристаллов с заданными свойствами во многом связан с пониманием атомно-молекулярного механизма кристаллизации. В ряде отраслей промышленности (химической, строительной и др.) в основе технологии лежат процессы массовой кристаллизации. Это многотоннажные производства минеральных удобрений, цементного клинкера, многочисленных солей, пигментов, металлов, керамики, люминофоров. Возникающие проблемы получения продуктов, со-стоящих из кристаллов заданной формы и размеров, имеют важное практическое значение. Процессы рекристаллизации поликристаллических материалов (керамики, металлов), так же как и кристаллизация стеклообразных веществ, протекающая при их старении, влияют на ряд эксплуатационных характеристик этих материалов. В практической работе методам выращивания кристаллов, особое внимание уделено методам выращивания объемных кристаллов из водных растворов, растворов в расплавах, стехиометрических расплавов (методы Чохральского, гидротермальной, направлен-ной кристаллизации и др.), так как именно этими методами выращивают лазерные матрицы, материалы-модуляторы оптического излучения, многие пьезо- и сегнетоэлектрики. Нашли отражение и вопросы аппаратурного оформления процессов кристаллизации, являющегося неотъемлемой частью технологии выращивания кристаллов. Физико-химические основы кристаллизации 1.1. Классификация процессов кристаллизации Образование кристаллов происходит в определенном физическом пространстве . Поэтому наиболее простая и распространенная классификация кристаллизационных процессов сводится к указанию агрегатного (фазового) состояния этой среды – среды кристаллизации. Рассматривают следующие основные случаи: а) кристаллизация в твердой фазе (твердофазная кристаллизация в аморфной и кристаллической среде, рекристаллизация); б) кристаллизация в жидкой среде (из водных и неводных растворов, растворов в расплавах, гидротермальных растворах, кристаллизация в расплавах, гелях, электрокристаллизация и т. д.); в) кристаллизация в газовой (паровой) среде (кристаллизация в процессе физической конденсации, с участием химической реакции, через слой жидкой фазы и т. д.). Образование и рост кристаллов, в какой бы среде они не происходили, подчиняются некоторым общим закономерностям. Однако процессы кристаллизации в каждой из этих сред характеризуются специфическими особенностями, что оправдывает данную классификацию. 1.2. Термодинамические основы кристаллизации При теоретическом рассмотрении процессов кристаллизации различают две взаимосвязанные стадии: на первой происходит образование зародышей новой фазы, а на второй стадии при благоприятных внешних условиях наблюдаются разрастание ранее образовавшихся зародышей и формирование всей массы кристалла. В соответствии с современными представлениями зародышеобразование может быть гомогенным и гетерогенным. В первом случае речь идет об относительно редко встречающемся процессе образования зародышей новой фазы в гомогенной жидкой или газообразной среде. Такая среда должна находиться в условиях, исключающих присутствие каких-либо посторонних частиц. В большинстве случаев зародышеобразование является гетерогенным. Такой процесс протекает в присутствии уже готовых поверхностей жидких капель, частиц пыли, стенок контейнеров, специально вводимых затравочных кристаллов или подложек. При анализе сложных процессов гомогенного и гетерогенного зародышеобразования могут быть использованы различные подходы. Образование зародыша новой фазы в жидкой или газообразной гомогенной среде является результатом фазовых переходов пар – жид-кость, пар – твердое или жидкость – твердое, относящихся к фазовым переходам 1-го рода. В соответствии с известными законами термодинамики переход может происходить самопроизвольно, если он сопровождается убылью свободной энергии системы. На рис. 1 представлена температурная зависимость энергии Гиб-бса вещества в твердой фазе (GS) и расплаве (GL). 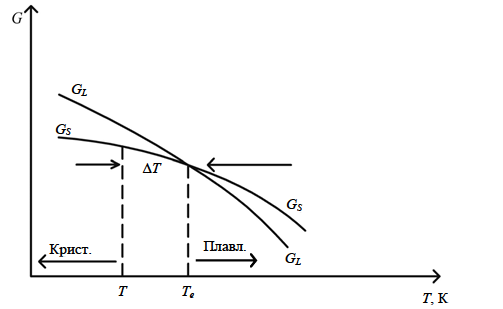 Рис. 1. Температурная зависимость энергии Гиббса для кристалла (GS) и окружающего его расплава (GL). Взаимное расположение кривых свидетельствует о том, что при температурах ниже Тe (температура плавления) должен самопроизвольно происходить переход вещества в твердое состояние, поскольку именно в этом состоянии энергия Гиббса имеет относительно меньшую величину. Наоборот, при температурах выше Тe единственно возможным самопроизвольно протекающим процессом является переход вещества в жидкое состояние. Кинетика кристаллизации Скорость гомогенного зародышеобразования Спонтанное зародышеобразование (нуклеация) рассматривается термодинамической теорией Гиббса – Фольмера – Френкеля – Зельдовича как флуктуационный процесс, который характеризуется скоростью или частотой I (см-3·с-1) появления зародышей в метастабильной фазе: 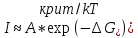 где А – частота столкновения частиц, приводящая к образованию зародышей; 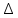 Gкрит – энергия образования зародыша критического размера. Gкрит – энергия образования зародыша критического размера. В газовой фазе А определяется поверхностью зародыша 4  rкр2; n – числом атомов в 1 см3 газообразной фазы; Р / (2 rкр2; n – числом атомов в 1 см3 газообразной фазы; Р / (2 mkT)1/2 – потоком газа к зародышу; m – массой молекулы. mkT)1/2 – потоком газа к зародышу; m – массой молекулы. Скорость образования зародышей:  Предэкспоненциальный множитель А для кубического или другого кристаллического зародыша имеет ту же структуру, которая приведена выше, с той только разницей, что вместо поверхности сферы 4  rкрит2 надо подставить поверхность куба 6L2. rкрит2 надо подставить поверхность куба 6L2. Формула показывает большую зависимость скорости образования зародышей от пересыщения системы по кристаллизуемому веществу, бурное зарождение, начиная с некоторого его значения, и возможность решающим образом влиять на зарождение путем изменения 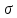 (т. е. выбором подложки, подходящих примесей и др.). (т. е. выбором подложки, подходящих примесей и др.). Среднее значение А для газов составляет 1023 см -3 с -1 При 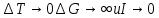 И наоборот, если 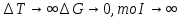 Таким образом, прослеживается тесная взаимосвязь кинетики и термодинамики. Зависимость скорости зарождения от пересыщения схематически изображена на рис. 2. Численные расчеты, выполненные для конденсации воды, дают результаты, приведенные в табл. 1.  Рис. 2. Зависимость скорости зародышеобразования от пересыщения Отметим также, что имеется некоторый интервал пересыщений (критическое пересыщение), выше которого происходит лавинообразное возрастание скорости образования зародышей (в табл. 1 значения от 4 до 5). Критическое пересыщение, очевидно, соответствует границе метастабильной области среды кристаллизации. Таблица 1 Скорость зарождения капель воды при разных пересыщениях по данным Фольмера и Паунда
Кинетика зародышеобразования в жидкостях в значительной мере определяется экспоненциальным членом exp(–E / kT), где Е – энергия перестройки ближнего порядка и присоединения атома к зародышу. В растворах через Е выражают энергию разрыва сольватных оболочек, окружающих и частицы, и кристаллические агрегаты; в расплавах же Е приравнивается к энергии активации вязкого течения и самодиффузии. Основные методы выращивания монокристаллов По признаку фазового перехода, в результате которого происходит рост кристаллов, известные методы можно разделить на три группы: 1. Выращивание из стехиометрических расплавов. 2. Выращивание из раствора (водного или раствора в расплаве). 3. Выращивание из газовой фазы. В каждом из этих случаев возможны два принципиально различных варианта. 1. Температурный градиент в системе отсутствует (dT / dx = 0). Все участки системы находятся при одинаковой температуре, которая, однако, может постепенно повышаться или понижаться с течением времени. Выращивание монокристаллов из раствора в результате испарения растворителя, понижения температуры или изменения рН среды. 2. В системе создается температурный градиент, обычно локализованный на определенном ее участке. Выбор метода выращивания кристалла определяется физико-химическими особенностями кристаллизуемого вещества. Так, на-пример, наличие полиморфных превращений не позволяет выращивать кристаллы СuСl из стехиометрического расплава, по этой же причине и из-за ничтожной растворимости кварца в воде при комнат-ной температуре его монокристаллы выращивают гидротермальным методом, а инконгруэнтное (с разложением) плавление ряда соединений АIIIBV заставляет применять при их кристаллизации повышенное давление, избыток легколетучего компонента, метод флюса. С другой стороны, кристаллы ряда соединений можно выращивать различными методами. Возьмем, например, корунд, кристаллы которого можно растить из стехиометрического расплава, из раствора в расплаве, гидротермальным методом и из газовой фазы. В этом случае выбор метода определяется требованиями, предъявляемыми к совершенству и размеру монокристаллов, возможностями ростовой лаборатории, технико-экономическими соображениями. Выращивание монокристаллов из растворов Под кристаллизацией из растворов подразумевается рост кристалла соединения, химический состав которого заметно отличается от химического состава исходной жидкой фазы. Широко распространенным растворителем является вода. Растворителями могут также служить многокомпонентные водные или неводные растворы (ацетон, толуол, бензин) и, наконец, расплавы каких-либо других химических соединений или элементарных веществ. В зависимости от температуры процесса и химической природы растворителя различают процессы выращивания из низкотемпературных водных растворов (как правило, при температуре не выше 80–90°С), перегретых водных растворов (гидротермальный метод, Т < 800°С), солевых и несолевых расплавов (методы кристаллизации из раствора в расплаве, температура кристаллизации обычно не превышает 1200–1300°С, но иногда достигает 1500°С). Кристаллизация из растворов является, по-видимому, самым распространенным способом выращивания кристаллов. Данный метод применяют, если кристаллизуемое вещество плавится инконгруэнтно; разлагается при Т ниже точки плавления; существует заметная зависимость растворимости вещества от Т и Р, концентрации растворителя. Преимущества метода – относительная простота аппаратуры, высокое структурное совершенство кристаллов, возможности широкого варьирования условий кристаллизации: температуры, состава кристаллизационной среды, типа примесей. Поскольку рост кристаллов, как правило, осуществляется при температурах намного более низких, чем Тплавл, кристаллы лишены многих дефектов, характерных для расплавленных образцов. Недостатки и особенности метода – рост кристалла протекает в многокомпонентной системе, и присутствие других компонентов (растворителя) оказывает существенное влияние на кинетику кристаллизации и механизм роста кристалла. В частности, затрудняется миграция питающего вещества к кристаллическим граням, и поэтому важную роль играют диффузионные процессы. Адсорбция растворителя на растущей поверхности кристалла и взаимодействие частиц кристаллизующегося вещества с растворителем (гидратация в водных растворах, сольватация в неводных) усложняют характер гетерогенных реакций на межфазной границе кристалл – раствор. Необходимым условием роста кристалла из раствора является создание пересыщения. По принципу создания пересыщений способы кристаллизации из растворов разделяются на несколько групп. 1. Кристаллизация за счет изменения температуры раствора. Сюда относятся методы кристаллизации, связанные с перепадом температур в растворе, а также кристаллизация в изотермическом объеме при общем снижении или подъеме температуры. 2. Кристаллизация за счет изменения состава раствора (испарение растворителя). 3. Кристаллизация при химической реакции. Остановимся на основных предпосылках протекания процесса кристаллизации из водных растворов. Рассмотрим участок диаграммы Т – С для наиболее типичного случая, когда растворимость исследуемого вещества возрастает с увеличением температуры (рис. 3). Кривые растворимости разделяют все поля диаграммы на три главные области: область ненасыщенных растворов 3, область пересыщенных растворов 2 и лабильная область 1. В стабильной области 3 кристаллизация невозможна. Образование метастабильной области 2 связано с необходимостью затраты энергии на образование кристаллического зародыша критического размера. Лабильные растворы – это неустойчивые сильно пересыщенные растворы, в силу чего в них легко образуются кристаллические зародыши за счет самопроизвольных флуктуаций концентрации вещества. Граница, разделяющая метастабильную область и лабильную зоны, характеризует максимальное пересыщение, при котором избыток (относительно равновесной растворимости) растворенного вещества еще не кристаллизуется.  Рис. 3. Диаграмма «концентрация – температура»: 1 – лабильная; 2 – метастабильная; 3 – стабильная области В метастабильном состоянии растворы являются относительно устойчивыми. Это связано с высокими значениями работы образования зародышей критического размера, в силу чего энергетический барьер не может быть преодолен за счет естественных флуктуаций концентрации вещества. Наиболее простой способ инициировать кристаллизацию из пересыщенного раствора – ввести в него затравку – кристаллики растворенного вещества или какую-нибудь механическую примесь, которые являются центрами зарождения. Последними могут быть и коллоидные частицы. Некоторые метастабильные растворы теряют устойчивость под влиянием светового и механического воздействия, электрического разряда и т. д. Поскольку устойчивость пересыщенных растворов зависит от многих факторов, то положение границы между лабильной и метастабильной зонами обычно не может быть четко зафиксировано. В частности, оно определяется не только природой растворов и характером протекающих в них процессов, но и степенью очистки исходных веществ от примесей. Обычно растворы выдерживают пересыщения, создаваемые переохлаждением на несколько градусов. Специально очищенные растворы выдерживают переохлаждения на десятки градусов. Управляемое выращивание монокристаллов возможно только из метастабильных растворов. Если раствор, представленный точкой А (рис. 3), охлаждается без испарения растворителя (линия АВС), то спонтанная кристаллизация не произойдет до тех пор, пока не будут достигнуты условия, представленные точкой С. Здесь кристаллизация может происходить спонтанно либо ее можно вызвать затравкой. Для начала кристаллизации может потребоваться переохлаждение до некоторой точки D. Пересыщение может достигаться также при испарении из раствора некоторого количества растворителя. Линия АВ’С’’ представляет данный процесс, осуществляемый при постоянной температуре. Процесс одновременного охлаждения и испарения представлен линией АВ’’С’’. Очевидно, что при кристаллизации веществ со значительной растворимостью и высоким температурным коэффициентом растворимости (т. к. р.) наиболее эффективным методом создания пересыщения является переохлаждение раствора (рис. 111, а), а для веществ со средней или малой растворимостью и небольшим т. к. р. – метод испарения растворителя (рис. 4, б). Метод кристаллизации в условиях температурного градиента оказывается эффективным при значительном т. к. р., и даже если растворимость относительно невелика. Как правило, т. к. р., представляющий собой, в сущности, dC / dT, часто выражают в граммах на градус 100 г растворителя, что весьма удобно для практических расчетов процесса кристаллизации. Очевидно, что при такой размерности т. к. р. вещества, обладающие невысокой растворимостью, формально будут неизбежно обладать и малым т. к. р. Тем не менее относительное изменение их растворимости может оказаться весьма значительным (например, при гидротермальном синтезе кристаллов), что и оправдывает применение метода температурного градиента. Как правило, выращивание из раствора ведут на готовой затравке, но иногда, особенно при кристаллизации из раствора в расплаве, пользуются методом спонтанной кристаллизации. В этом последнем случае желательно иметь достаточно емкий кристаллизатор – это увеличивает вероятность образования зародышей и тем самым позволяет начать процесс кристаллизации при меньшем переохлаждении; в результате критический радиус зародыша оказывается достаточно большим и опасность возникновения паразитных зародышей уменьшается.  Рис. 4. Выбор метода выращивания кристаллов из раствора на основе диаграммы «температура – растворимость»: а – предпочтителен метод охлаждения раствора; б – предпочтителен метод испарения растворителя; В непосредственной близости от поверхности растущего кристалла находится неподвижный слой раствора, сквозь который вещество переносится к поверхности растущего кристалла только в результате диффузии, – так называемый диффузионный слой. Концентрация пересыщенного раствора С в этом слое, имеющем толщину d, уменьшается до некоторой величины Сi, превышающей, однако, концентрацию насыщенного раствора С0 (рис. 5). 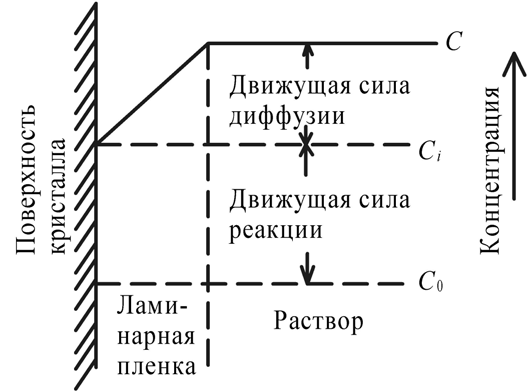 Рис. 5. Схема движущих сил процесса кристаллизации из раствора Скорость роста кристалла dn / d 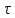 определяется переносом вещества сквозь диффузионный слой: определяется переносом вещества сквозь диффузионный слой: dn / d 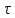 = SD / d (C – Ci), = SD / d (C – Ci), где S – поверхность кристалла; D – коэффициент диффузии. К сожалению, истинное значение Ci определить трудно (или даже невозможно). Поэтому пользуются формулой dn / d 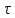 = KS(C – C0), = KS(C – C0), где K – общий коэффициент массопередачи. Если при выращивании отсутствует какое-либо механическое перемешивание раствора (хотя бы за счет вращения кристалла), рост кристалла происходит в статическом режиме. Перенос вещества в этом случае осуществляется за счет конвекции или диффузии. Над кристаллом, растущим в прозрачном кристаллизаторе, нетрудно заметить восходящие токи роста – это всплывает раствор, отдавший часть растворенного вещества кристаллу и ставший менее пересыщенным (рис. 6) 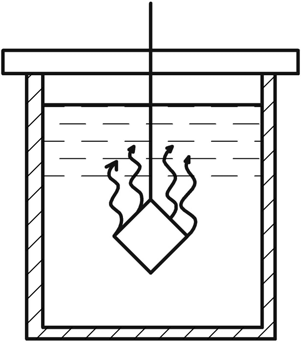 Рис. 6. Восходящие токи роста над кристаллом, растущим в растворе При повышении температуры движение токов роста прекращается и затем сменяется токами растворения – раствор становится ненасыщенным и начинается растворение кристалла. Отмечая момент прекращения движения концентрационных потоков, можно довольно точно определить температуру насыщения раствора данной концентрации, особенно если наблюдать на экране теневое изображение концентрационных потоков. Методы перемешивания наиболее разработаны для выращивания из водных растворов. Чаще всего применяют перемешивание раствора под растущим кристаллом при помощи магнитной мешалки, перемешивание раствора над растущим кристаллом посредством лопастной мешалки с односторонним или реверсивным вращением, одностороннее или реверсивное вращение самого кристалла и, наконец, перемешивание раствора при помощи центробежной помпы (рис. 7). Реверсивное вращение делает более равномерной подачу вещества к различным граням кристалла и позволяет избавиться от включений раствора. 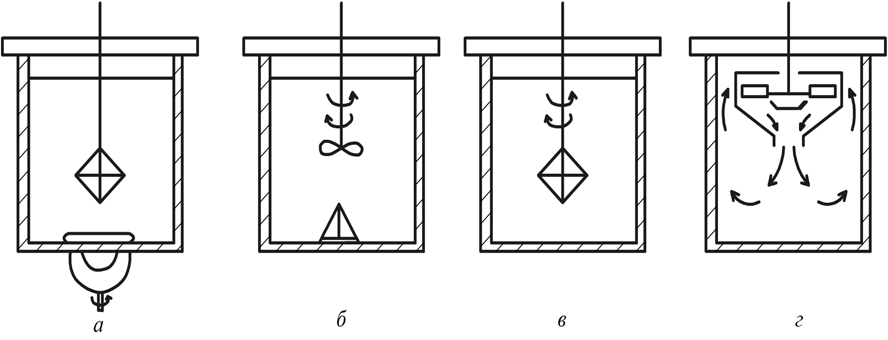 Рис. 7. Наиболее распространенные способы перемешивания раствора: магнитной мешалкой (а), лопастной мешалкой (б), вращением кристалла (в), центробежной помпой (г) Выбор того или иного варианта выращивания монокристалла зависит от величины растворимости вещества и величины т. к. р. (dC / dT). Можно сформулировать ряд правил, которыми следует руководствоваться при выборе того или иного метода кристаллизации. 1. Если т. к. р. заметно отличается от 0, возможно использование методов кристаллизации путем изменения температуры раствора. Здесь следует различать несколько вариантов: а) при т. к. р., равном 0,01–0,10 г/л град, независимо от абсолютной величины растворимости предпочтительнее методы кристаллизации за счет перепада температуры. Эти методы обеспечивают длительный непрерывный рост кристаллов в одной части кристаллизатора за счет постоянного растворения в другой его части. Методы охлаждения здесь мало пригодны, поскольку для выделения из раствора заметных количеств вещества требуется охлаждение в большом температурном интервале; б) при высоком т. к. р. (более 1 г/л град), но низкой абсолютной величине растворимости вещества (несколько мас. %) также предпочтительнее пользоваться методом температурного перепада, поскольку охлаждение раствора даже в широком температурном интервале при-ведет к выделению лишь небольших количеств вещества; в) при высокой растворимости и высоком т. к. р. целесообразнее использовать метод охлаждения раствора (соответственно нагрева, если т. к. р. отрицательный). Методы температурного перепада здесь тем менее пригодны, чем выше т. к. р., поскольку трудно регулировать бурный процесс спонтанного зарождения кристаллов. 2. Если т. к. р. очень мал, кристаллизацию можно проводить методом испарения растворителя или за счет химической реакции. Абсолютная величина растворимости при этом не очень важна, но в методах испарения не должна быть очень низкой. 3. Для слаборастворимых веществ целесообразно использовать кристаллизацию при химической реакции. 4. Рост при Т = const и 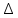 C = const в зоне роста лучше всего обеспечивается методами подпитки. При их использовании вещество непрерывно подается в кристаллизатор по мере роста кристалла. В других вариантах возможно добавление пересыщенного раствора в кристаллизатор, кристаллизация в режиме вынужденной конвекции раствора. Кроме величины растворимости и т. к. р., на выбор методов выращивания часто оказывают влияние и другие факторы. Например, для вязких растворов мало применимы методы кристаллизации за счет перепада температуры, поскольку затруднена конвекция раствора. Поэтому эти методы сравнительно редко используются при выращивании из раствора в расплавленных солях. В гидротермальных условиях из-за ограниченного объема кристаллизатора и относительно слабой растворимости веществ выращивание путем снижения общей температуры раствора малоэффективно, и поэтому применяются в основном методы, использующие конвекцию под действием перепада температур. C = const в зоне роста лучше всего обеспечивается методами подпитки. При их использовании вещество непрерывно подается в кристаллизатор по мере роста кристалла. В других вариантах возможно добавление пересыщенного раствора в кристаллизатор, кристаллизация в режиме вынужденной конвекции раствора. Кроме величины растворимости и т. к. р., на выбор методов выращивания часто оказывают влияние и другие факторы. Например, для вязких растворов мало применимы методы кристаллизации за счет перепада температуры, поскольку затруднена конвекция раствора. Поэтому эти методы сравнительно редко используются при выращивании из раствора в расплавленных солях. В гидротермальных условиях из-за ограниченного объема кристаллизатора и относительно слабой растворимости веществ выращивание путем снижения общей температуры раствора малоэффективно, и поэтому применяются в основном методы, использующие конвекцию под действием перепада температур.Кристаллизация из водных растворов и растворов органических жидкостей при нормальном давлении 1. Кристаллизация путем изменения температуры раствора. На рис. 8 схематически изображен кристаллизатор, применяемый для выращивания кристаллов методом охлаждения раствора. Стеклянная банка с раствором, герметически закрытая крышкой 4, помещена на подставке 9 в наполненный водой стеклянный сосуд-термостат. Гайки 3, перемещаясь по резьбе шпилек 2, пропущенных сквозь крышку термостата, регулируют положение сосуда – кристаллизатора в термостате. Температуру в термостате контролируют термометром 1 и поддерживают на заданном уровне при помощи контактного термометра 5. Нагрев воды в термостате осуществляют при помощи наружного нагревателя 6 и внутреннего нагревателя 7. При необходимости устанавливают дополнительный наружный нагреватель 8. Примерно 75% потребляемой мощности подается на нагреватель 6, остальное – на нагреватель 7 или 8. 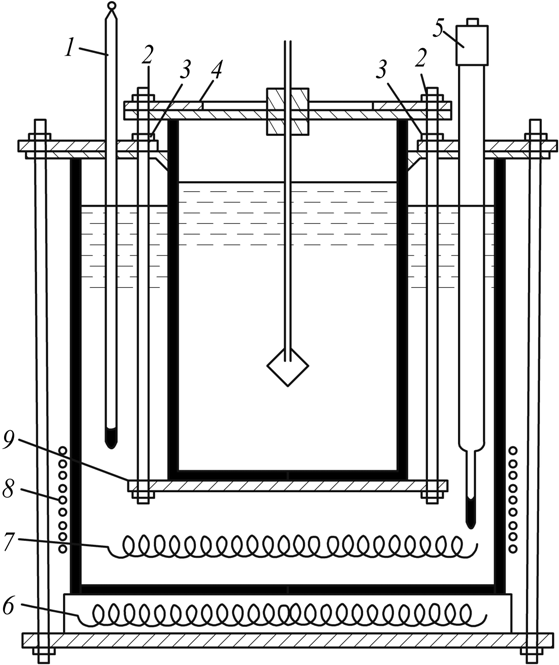 Рис. 8. Схема установки для выращивания кристаллов методом изменения температуры раствора Нагреватель 7, включением и выключением которого через реле управляет контактный термометр 5, служит для поддержания температуры на заданном уровне. Если аппарат изготовлен из органического стекла, нагревателями могут служить электролампы, малая инерционность которых обеспечивает весьма точное термостатирование. Вода в термостате перемешивается пропеллерной мешалкой (на рисунке не показана). Если требуется вести кристаллизацию при температуре свыше 70°С, воду в термостате заменяют маслом. Для хорошего термостатирования термостат должен иметь достаточно большой объем – до 10 л и более. В первые несколько суток, пока растущий кристалл имеет небольшие размеры, температуру снижают медленно – со скоростью примерно 0,1 град/сут, затем ускоряют охлаждение до 0,5–1,0 град/сут. В течение одного – двух месяцев этим методом можно вырастить кристаллы дигидрофосфата калия (КДР), триглицинсульфата (ТГС), бен-зофенона и других веществ, растворимость которых сильно меняется с температурой, весом в несколько сотен граммов. Некоторый недостаток метода заключается в том, что для выращивания крупного кристалла приходится существенно снижать температуру, благодаря чему разные участки одного и того же кристалла образуются при разных температурах. Это обстоятельство, вообще говоря, сказывается на коэффициенте распределения примесей и тем самым вызывает известную неравномерность свойств кристалла. Для того чтобы вырастить кристалл данного размера при меньшем понижении температуры, необходимо увеличить размеры кристаллизатора. 2. Метод испарения растворителя. Как уже отмечалось, этим методом выращивают кристаллы веществ со средней и малой растворимостью и незначительным или отрицательным температурным коэффициентом растворимости. Схема простейшего кристаллизатора для выращивания кристаллов в статическом режиме настолько ясно представлена на рис. 9, что не нуждается в каких-либо комментариях. Вместе с тем из вышеизложенного столь же очевидно, что, пользуясь подобным кристаллизатором, невозможно получить кристаллы высокого качества.  Рис. 9. Кристаллизатор в эксикаторе: 1 – крышка, регулирующая скорость испарения; 2 – концентрированная серная кислота или хлористый кальций для поглощения паров воды 3. Методы температурного перепада. Основаны на том, что в кристаллизаторе создаются две области с разными температурами. В одной из них происходит растворение вещества, которое всегда находится в избытке в виде твердой фазы, а в другой – рост кристалла. Простейшим вариантом является высокий сосуд, в нижней части которого помещается исходное вещество, а в верхней подвешивается затравка. Температура в нижней части сосуда поддерживается более высокой, чем в верхней. В результате возникает конвекция раствора, обеспечивающая постоянный перенос вещества снизу вверх, в зону роста. В таком варианте метод температурного перепада применяется при гидротермальном выращивании кристаллов и подробнее будет рассмотрен ниже. Для кристаллизации из низкотемпературных водных растворов чаще используются два сосуда, соединенных трубками. В одном сосуде с более высокой температурой происходит растворение вещества, в другом – рост (рис. 10). Обмен между сосудами осуществляется как за счет естественной конвекции раствора, так и путем перемешивания мешалкой. В начале опыта в обоих сосудах устанавливают одинаковую температуру и поддерживают ее до полного насыщения раствора. Затем раствор в сосуде роста перегревается на несколько градусов и вводится затравка. После непродолжительной выдержки этот сосуд охлаждается до тех пор, пока не установится требуемая разность температур между обоими объемами.  Рис. 10. Выращивание кристаллов из раствора методом температурного перепада: 1 – термостат для растворения с температурой Т1; 2, 6 – соединительные трубки; 3 – термостат для роста с Т2, Т2 < Т1; 4 – лопастная мешалка; 5 – растущий кристалл; 7 – исходное вещество; При естественной конвекции в описанной установке раствор из камеры растворения по верхней трубе движется в камеру роста, а по нижней – в обратном направлении. Чтобы избежать кристаллизации в узких соединительных трубках, их теплоизолируют. С помощью мешалки можно заставить раствор течь в камеру роста по нижней трубке. 4. Кристаллизация при концентрационной конвекции. В отличие от описанных выше способов при кристаллизации в случаях концентрационной конвекции обмен раствором между зонами растворения и роста обеспечивается за счет разности плотностей насыщенного и ненасыщенного раствора. Питающее вещество помещается в верхнюю часть кристаллизатора, а затравки подвешиваются внизу. Температура в верхней зоне поддерживается более высокой, чем в нижней. Таким образом, тепловая конвекция полностью подавляется (рис. 11). Рост кристалла происходит в стеклянной трубке с D = 40–50 мм, нижняя часть которой сужена на конце, чтобы предотвратить разрастание падающих паразитных кристаллов. Более плотный насыщенный раствор опускается из верхней камеры в нижнюю, здесь он становится пересыщенным и происходит рост кристаллов.  Рис. 11. Схема установки для выращивания кристаллов методом концентрационной конвекции раствора: 1 – сосуд для пополнения термостата водой; 2 – камера растворения с веществом для подпитки; 3 – кристаллодержатели; 4 – паразитные кристаллы; 5 – резиновая прокладка 6.Гидротермальный метод выращивания кристаллов Общие признаки данного метода: наличие водной среды, температура выше 100°С и давление выше атмосферного. Существенной особенностью гидротермального способа выращивания кристаллов является применение минерализатора В, вводимого в систему А + Н2О для увеличения растворимости труднорастворимого компонента. Ростовые системы как минимум трехкомпонентные типа А–В–Н2О, где А – соединение, кристаллы которого желательно вырастить, В – хорошо растворимое соединение, минерализатор. Чаще всего в качестве минерализатора используют углекислые соли и гидроксиды щелочных металлов, а также фториды (аммония, калия, натрия). Сущность гидротермального метода выращивания кристаллов – создание условий, позволяющих перевести в растворимое состояние кристаллизуемое вещество, обеспечить необходимое пересыщение раствора и кристаллизацию вещества. Величиной пересыщения можно управлять, варьируя следующие параметры: температуру, давление, тип и концентрацию минерализатора, а также температурный градиент между зоной растворения и зоной роста. Гидротермальный метод позволяет выращивать монокристаллы тугоплавких соединений при Т < Тпл, иногда он является единственно возможным методом роста. Наиболее характерные примеры: выращивание монокристаллов  -кварца и ZnS (сфалерита). -кварца и ZnS (сфалерита). Рассмотрим возможные варианты выращивания кристаллов из гидротермальных растворов. Метод температурного перепада. Исходный материал (шихту) помещают в нижнюю часть сосуда высокого давления – автоклава, заполняемого определенным количеством растворителя. Автоклав нагревают таким образом, чтобы создать по высоте его две температурные зоны; температура в нижней части автоклава (зоне растворения) Т1 выше температуры верхней зоны (зоны роста) Т2. Обозначим через С1 и С2 концентрации кристаллизуемого вещества А в нижней и верхней частях автоклава. Плотность раствора с определяется температурой и концентрацией раствора и меняется вдоль оси автоклава. Обычно увеличение концентрации С приводит к возрастанию плотности, а увеличение температуры – к ее уменьшению. Если  с(С1,Т1) < с(С1,Т1) <  с( (С2,Т2), т. е. с( (С2,Т2), т. е. d  с( / dC(C1 – C2) + d с( / dC(C1 – C2) + d с( / dT(T1 – T2) < 0, с( / dT(T1 – T2) < 0,то более холодный и, соответственно, более плотный раствор в верхней части автоклава опускается вниз, а встречный поток более легкого раствора поднимается вверх. Таким образом, по достижении определенного перепада температур 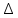 Т = Т1 – Т2, специфического для каждого из соединений, в зоне растворения тепловое расширение жидкости будет сильнее уменьшать плотность раствора, чем растворение шихты будет увеличивать ее, и в автоклаве возникает конвекционное движение раствора снизу вверх, где он из насыщенного становится пересыщенным. Т = Т1 – Т2, специфического для каждого из соединений, в зоне растворения тепловое расширение жидкости будет сильнее уменьшать плотность раствора, чем растворение шихты будет увеличивать ее, и в автоклаве возникает конвекционное движение раствора снизу вверх, где он из насыщенного становится пересыщенным.Для лучшего понимания особенностей гидротермального синтеза кристаллов целесообразно обратиться к диаграмме состояния воды (рис. 12). На рис. 12, а приведена диаграмма р–Т воды без учета кристаллизующихся фаз.   Рис. 12. Р – Т (а) и Т – V (б) диаграммы воды Нанесенные линии одинаковых плотностей (обозначенных через степень заполнения), или изохоры, позволяют определить состояние системы в автоклавах при известной начальной степени заполнения. Если при нормальных условиях автоклав заполнен водой на 20 об. %, то при нагревании вода переходит в состояние пара, при 370°С остается одна фаза с плотностью 0,2 г/см3. Если же, напротив, выбрана высокая степень заполнения (80 об. %), то при 245°С наступает полное заполнение, т. к. изохора кривой давления пара АК, соответствующая плотности 0,8 г /см3, берет начало у 245°С. Дальнейшее повышение температуры при степени заполнения 80 об. % способствует увеличению давления, которое при 300°С достигает 2000 атм. Так как автоклавы в термодинамическом смысле представляют собой изохорную систему, часто в качестве независимых термодинамических переменных вместо Т и Р используются температура и объем V (или плотность). На рис. 12, б показана диаграмма V–T воды, на которой в противоположность диаграмме Р–Т имеется двухфазная область Д. Вдоль кривой равновесия плотность фазы Ж до точки К снижается медленнее, чем возрастает плотность фазы Г в направлении К. Вблизи критической точки небольшие изменения температуры вызывают очень сильные колебания плотности, которые обусловливают интенсивные хаотические течения, и тем самым можно достичь хорошего перемешивания. Критическая точка К для чистой воды имеет координаты: Рк = 225,65 атм; Тк = 374,15°С; Vк = 3,2 см3/г. Кривая равновесия АК разделяет газообразное (сверху) и жидкое (снизу) состояние. На диаграмму нанесены линии одинаковой плотности, они отвечают линиям одинакового объема (изохорам). Диаграммы состояния разбавленных водных растворов, находящихся в автоклаве, имеют вид, приближающийся к диаграмме состояния воды. Отличие заключается в том, что данной температуре соответствует меньшее давление, и с возрастанием концентрации минерализатора расхождение между диаграммами увеличивается. К настоящему времени исследованы P–F–T–C-соотношения водных растворов и ряда других соединений. По данным P–F–T–C-соотношений, зная коэффициент заполнения автоклава F, температуру опыта и концентрацию растворителя, можно оценить давление в автоклавах, в которых нет манометров или каких-либо иных датчиков для определения давления. Взаимодействие кристаллизуемого вещества с растворителем. Управляемое выращивание монокристаллов из высокотемпературных водных растворов возможно, когда при взаимодействии кристаллизуемого вещества А с растворителем обеспечивается выполнение следующих условий. 1. Конгруэнтность растворения кристаллизуемого вещества. 2. Достаточно высокое значение растворимости кристаллизуемого вещества, необходимое для роста кристалла с заметной скоростью. В подавляющем большинстве случаев растворимость веществ в условиях гидротермального выращивания кристаллов колеблется в пределах 1–5 мас. %, например, растворимость кварца в растворах NaOH составляет 2–4 мас. %, корунда в растворах Na2CO3 – 3–4 мас. % при 500оС. Лишь в редких случаях, например для YFeO3, растворимость не превышает 0,3–0,4 мас. %. По-видимому, эта величина близка к нижнему пределу, ниже которого вещество практически не кристаллизуется на затравке в гидротермальных условиях. 3. Достаточно резкое изменение растворимости кристаллизуемого соединения с изменением температуры или давления. Исследование зависимости растворимости вещества от Т и Р составляет необходимую подготовительную стадию работы при выращивании любого нового кристалла. Экспериментально определив растворимость вещества, затем по уравнению (dlnK0 / dT) = –  H / RT 2, H / RT 2,где K0 – константа равновесия реакции, в данном случае равновесная растворимость соединения;  H – теплота растворения, оценивают теплоту растворения и используют для подбора теплового режима выращивания. H – теплота растворения, оценивают теплоту растворения и используют для подбора теплового режима выращивания. Зависимость растворимости большинства соединений от давления обычно более слабая, чем от температуры, и описывается уравнением dlnX 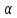 / dP = (V / dP = (V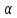 ж – V ж – V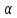 т) / RT –dln т) / RT –dln /dP, /dP,где X 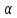 – мольная доля данного компонента в системе; V – мольная доля данного компонента в системе; V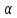 ж – парциальный мольный объем компонента в насыщенном растворе; V ж – парциальный мольный объем компонента в насыщенном растворе; V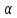 т – мольный объем твердого компонента т – мольный объем твердого компонента 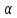 при тех же Т и Р; при тех же Т и Р;  – коэффициент активности компонента – коэффициент активности компонента 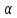 . Влияние давления на растворимость определяется величиной разности V . Влияние давления на растворимость определяется величиной разности V ж – V ж – V т. Поскольку эта разность обычно мала, то растворимость слабо зависит от давления. В общем случае, если энергия взаимодействия частиц соли и Н2О при низких температурах высока, а растворимость соли мала, то, как правило, увеличение давления приводит к повышению растворимости. т. Поскольку эта разность обычно мала, то растворимость слабо зависит от давления. В общем случае, если энергия взаимодействия частиц соли и Н2О при низких температурах высока, а растворимость соли мала, то, как правило, увеличение давления приводит к повышению растворимости.4. Образование в растворе подвижных комплексов, легко разлагающихся при изменении температуры. Максимальный перенос вещества обеспечивается тогда, когда константа равновесия реакции образования комплекса близка к 1. Как правило, выращивание крупных монокристаллов осуществляют путем непосредственной перекристаллизации шихты того же со-става, что и требуемый кристалл, в ранее найденных P–F–T–C-условиях. Для получения крупных монокристаллов нужной ориентации ис-пользуют ориентированный рост на затравке. Затравки помещают в верхней зоне автоклава, отделенной от «горячей» зоны специальными перегородками с отверстиями или со струенаправляющими трубками. Перегородки служат для дополнительного регулирования направления и скоростей движения раствора и создания Т-градиента. В условиях непрерывного равномерного поступления питательного раствора в зону роста кристалл растет на затравку с определенной скоростью, постоянной для данных условий кристаллизации. Основные параметры, влияющие на скорость роста кристалла на затравке, следующие: кристаллографическая ориентация затравки, величина пересыщения, температура, давление, концентрация минерализатора, значение т. к. р., химическая природа растворителя, отношение площади поверхности шихты S к площади поверхности затравки S1, величина и расположение отверстий во внутренней перегородке автоклава. Два последних параметра определяют количество поступающего в зону роста материала. Отношение S / S1 выбирается исходя из соотношения между скоростями роста и растворения. На примере кварца и корунда при S / S1*5 (SiO2), S / S1*20 (Al2O3) показано, что скорость роста не лимитируется процессами растворения шихты. По этой причине целесообразно использовать достаточно крупнозернистую пористую шихту. Аморфная и мелкопористая шихта может конвекционными потоками увлекаться в камеру роста и ухудшать качество выращиваемых кристаллов, а также спрессовываться, существенно уменьшая поверхность контакта с раствором. Суммарная площадь отверстий в перегородке f влияет на скорость конвекции раствора и тем самым на перенос вещества в зону роста. При f < 1% от площади поперечного сечения автоклава в сосуде могут создаваться как бы две зоны конвекционного движения раствора – ниже и выше перегородки, массообмен между которыми ограничен. В этих условиях кристалл либо растет с очень малой скоростью либо вообще наблюдается рас-творение затравки. В большинстве случаев f составляет 3–8% от Sвнутр сечения автоклава, что, видимо, близко к оптимальному значению. Наличие трещин – один из наиболее распространенных дефектов в кристаллах, полученных гидротермальным методом. Одной из главных причин возникновения дефектов в гидротермальных кристаллах являются дефекты затравки. Как правило, структурные дефекты затравочного материала наследуются растущим кристаллом. Поэтому наличие высококачественных затравок является важным условием получения совершенных кристаллов. Наиболее целесообразно использовать в качестве затравок кристаллы, ранее выращенные гидротермальным методом. Помимо перечисленных специфических дефектов, которые можно отнести к разряду трехмерных, кристаллам, выращенным в автоклаве, присущи также точечные, одномерные и двумерные дефекты, встречающиеся при выращивании кристаллов всеми остальными методами. Точечные дефекты связаны обычно с захватом посторонних атомов, который оказывается неодинаковым для разных граней и, следовательно, неравновесным. Одномерные дефекты представляют собой дислокации, а двумерные – граничные поверхности, отделяющие монокристалл от трехмерных включений. Строение этих граничных поверхностей пока не установлено. |
