Реферат по теме Фенолы. ФЕНОЛЫ. Реферат по направлению подготовки 44. 03. 05. Педагогическое образование (с двумя профилями подготовки)
 Скачать 312.75 Kb. Скачать 312.75 Kb.
|
|
МИНИСТЕРСТВО ПРОСВЕЩЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ ПЕДАГОГИЧЕСКИЙ УНИВЕРСИТЕТ» КАФЕДРА ХИМИИ ФЕНОЛЫ РЕФЕРАТ по направлению подготовки 44.03.05. Педагогическое образование (с двумя профилями подготовки) профили «Химия», «Экология» Выполнил: студент очной формы обучения 2 курса, 1 группы Тинина Татьяна Андреевна Научный руководитель: кандидат химических наук, доцент кафедры химии Алферова Светлана Ивановна Воронеж – 2022 ФенолыФенолы - кислородсодержащие ароматические соединения, в молекулах которых содержится одна или несколько гидроксильных групп (OH), присоединенных к бензольному кольцу. Номенклатура феноловНумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название "фенол". 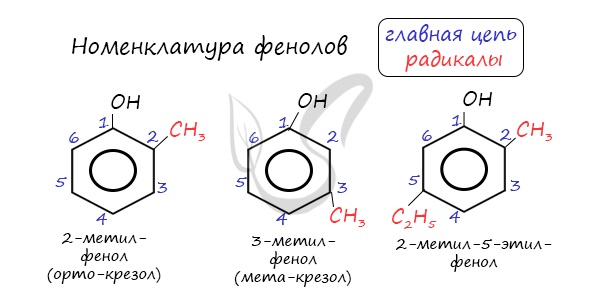 Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования, нитрования протекают в орто- и пара-положениях. Получение феноловГидролиз галогенбензолов При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена. 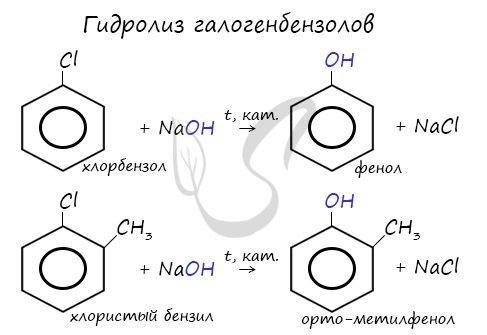 Кумольный способ Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению, в результате получается фенол и ацетон.  Химические свойства феноловКислотные свойства Щелочные металлы (Li, Na, K) способны вытеснять водород из фенолов с образованием солей - фенолятов. В отличие от алифатических одноатомных спиртов, фенолы способны вступать в реакцию с щелочами (KOH, LiOH, NaOH)  Галогенирование Реакция фенола с бромной водой является качественной: в ходе нее выпадает белая взвесь - осадок трибромфенола. 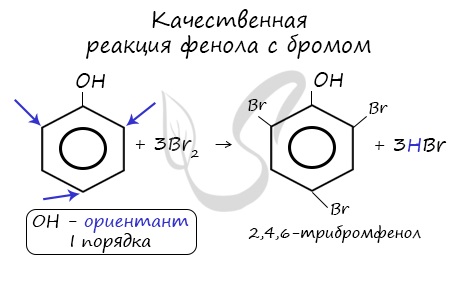 Реакции с кислотами Реакция между фенолом и азотной кислотой происходит по типу замещения. В бензольном кольце появляется новый радикал - нитрогруппа. Важно учитывать, что OH группа фенола является ориентантом I порядка: замещение идет в орто-, пара-положении.  Гидрирование При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.  Поликонденсация фенолов с формальдегидом В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию смолообразных полимеров (фенолформальдегидные смолы) и воды.  Применение фенола Растворы фенола используются как бактерицидное средство для дезинфекции помещений. Большое количество фенола расходуется для производства полимеров, из которых изготавливают пластмассы и синтетические волокна. Из фенола получают лекарственные препараты, красители, ядохимикаты, взрывчатые вещества. Фенол — ядовитое вещество. Опасны также его производные. |
