химия. Задачи 109. Решение По методу валентных связей пространственная конфигурация частицы определяется пространственным распределением гибридных орбиталей вокруг центрального атома.
 Скачать 288.46 Kb. Скачать 288.46 Kb.
|
|
Задачи 109—151 (табл. 1.10). Объясните экспериментально установленное строение молекулы или иона, используя метод валентных связей. Укажите тип гибридизации орбиталей центрального атома, изобразите перекрывание орбиталей и определите, полярна ли эта частица.
Решение: По методу валентных связей пространственная конфигурация частицы определяется пространственным распределением гибридных орбиталей вокруг центрального атома. В молекуле HOF - центральный атом кислорода образует две связи с водородом и фтором. Число электронов, участвующих в образовании связей, можно определить из электронного строения атомов. Атом водорода имеет один неспаренный электрон, который образует ковалентную полярную связь с одним из неспаренным электроном кислорода, второй неспаренный электрон кислорода образует с электроном фтора также ковалентную полярную связь. Представим схему образования ковалентных связей в молекуле: 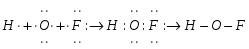 Кислород в молекуле находится в состоянии sp3 – гибридизации: 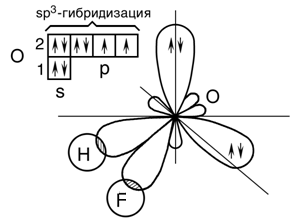 В молекуле HOF имеются две гибридные орбитали с неподеленными парами электронов и две гибридные орбитали, имеющие по одному электрону. Валентный угол между связями равен 97о при тетраэдрическом их расположении. Углы между связями отклоняются от тетраэдрического 109о29′ и прямого 90о. Это обусловлено различием сил взаимного отталкивания орбиталей, заполненных только парой электронов, и орбиталей, перекрывающихся с атомами водорода и фтора. Орбитали с парой электронов, т.е. не имеющие области перекрывания, обладают бόльшим отталкивающим эффектов по сравнению с орбиталями, образующими связь. В молекуле HOF - две орбитали с парами электронов. Их влияние на орбитали связи еще сильнее, и угол H-O-F уменьшается до 97о. Молекула HOF полярна, так как имеет несимметричное строение. Задачи 83—88 (табл. 1.7). Используя метод молекулярных орбиталей, изо- бразите энергетическую диаграмму и объясните различную длину связи в молекулах и молекулярных ионах.
Решение: Процесс образования частицы Cl2 можно представить записью: Cl[K3s22p5] + Cl[K3s22p5] → → Cl2+[ККσ(3s)2σ*(3s)2σ(3px)2π(3py)2π(3pz)2π*(3py)2π*(3pz)2], где уровни 1s2s2p обозначены К. Перекрывание 1s-, 2s-, 2p-атомных орбиталей приводит к заполнению σ(1s)- σ(2s)-, σ(2p)-связывающей и σ*(1s)- σ*(2s)-, σ*(2p)- разрыхляющей молекулярных орбиталей двумя электронами с антипараллельными спинами и не изменяет энергию связывающихся атомов, поэтому их можно не учитывать. В молекуле Cl2 имеется избыток двух электронов на связывающих орбиталях, что соответствует одинарной связи или порядку связи n, равному единице, который для двухатомной частицы рассчитывается по следующей формуле: 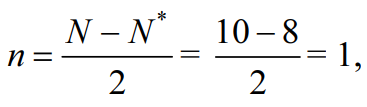 где N, N* — число электронов на связывающих и разрыхляющих орбиталях соответственно. 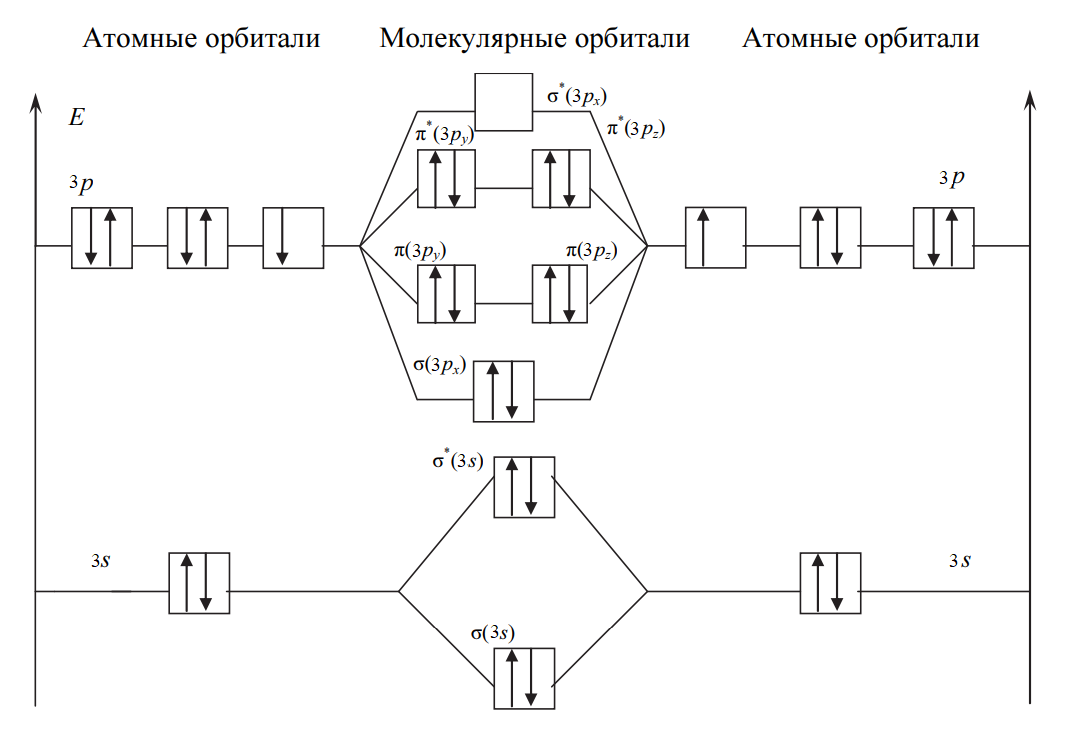 Рис. 1. Энергетическая диаграмма молекулы Cl2 Все электроны в молекуле Cl2 спарены (спины электронов на отдельных молекулярных орбиталях параллельны) и частица не обладает магнитными свойствами (диамагнитна). На рис. 1 представлена энергетическая диаграмма образования молекулы Cl2. Процесс образования частицы Cl2+ можно представить так: Cl[К3s23p5]+Cl+[К3s23p4] → →Cl2+[ККσ(3s)2σ*(3s)2σ(3px)2π(3py)2π(3pz)2π*(3py)2π*(3pz)1], где уровни 1s2s2p обозначены К. В молекулярном ионе Cl2+ имеется избыток трех электронов на связывающих орбиталях, что соответствует полуторной связи или порядку связи, равному 1,5: 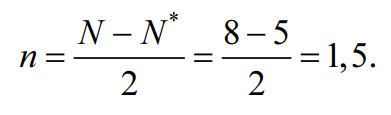 Уменьшение числа электронов на разрыхляющих орбиталях приводит к упрочнению связи и уменьшению межъядерного расстояния (длины связи), порядок связи при этом возрастает. В молекулярном ионе Cl2+ имеется один неспаренный электрон, и частица обладает магнитными свойствами (парамагнитна). На рис. 2 представлена энергетическая диаграмма образования молекулярного иона Cl2+: 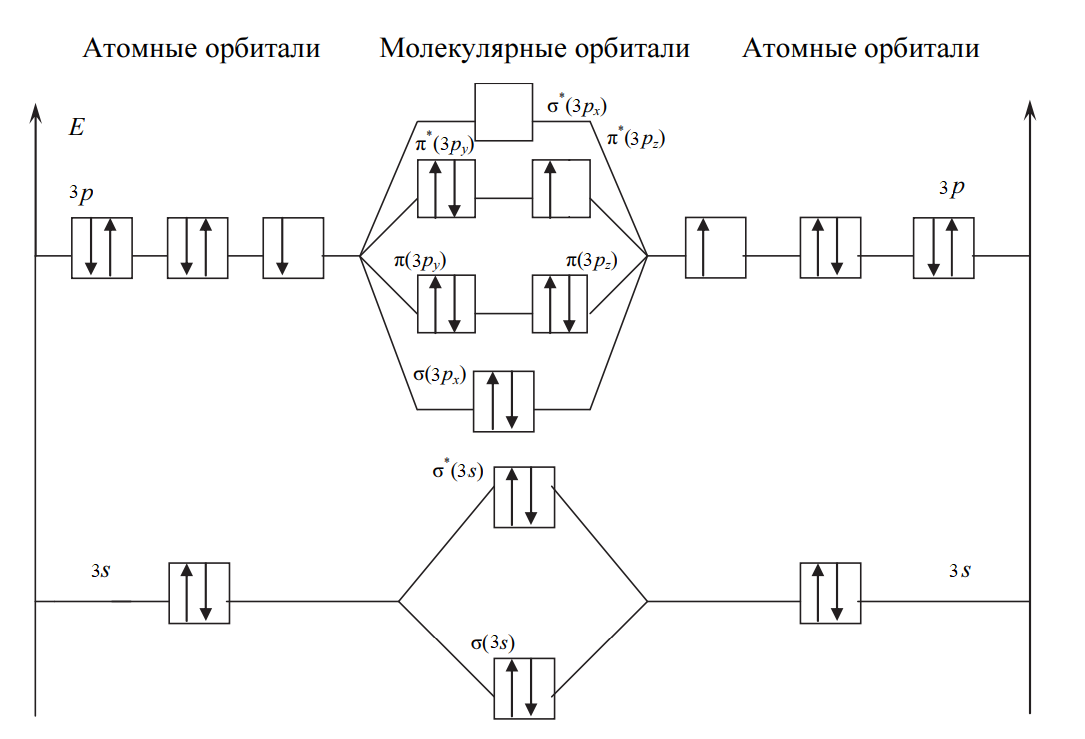 Рис. 2. Энергетическая диаграмма молекулярного иона Cl2+ Задачи 663—674 (табл. 1.43). Рассчитайте, какой объем водорода (н.у.) выделится при действии избытка соляной кислоты на сплав массой 2 г, состав которого задан массовыми долями компонентов
Решение: Выпишем стандартные электродные потенциалы олова, марганца и водорода в реакциях восстановления ионов:
Так как стандартные потенциалы металлов ниже, чем у водорода, металлы вступают в реакцию с разбавленной соляной кислотой с выделением водорода: Mn + 2HCl → MnCl2 + H2 Sn + 2HCl → SnCl2 + H2 По уравнению реакции при взаимодействии кислоты с 1 моль металла выделяется 1 моль водорода. По условию задачи, если масса сплава равна 2 г, то масса марганца равна 2*55/100 = 1,1 г, тогда масса олова равна 2 – 1,1 = 0,9 г. Определим количества моль металлов: n(Mn) = m(Mn)/M(Mn) = 1,1/55 = 0,02 моль. n(Sn) = m(Sn)/M(Sn) = 0,9/118,7 = 0,0076 моль. Тогда водорода образуется 0,02+0,0076 = 0,0276 моль. При нормальных условиях 1 моль любого газа занимает объем, равный 22,4 л. Тогда 0,0276 моль займет объем 0,0276*22,4 = 0,62 л. Ответ: 0,62 л. Задачи 31—44 (табл. 1.4). Объясните изменение первой энергии ионизации в ряду атомов элементов. Составьте полные электронные формулы атомов элементов, покажите распределение электронов по энергетическим ячейкам.
Решение: Энергией ионизации называют энергию, которую нужно затратить для отрыва электрона от атома с превращением его в положительно заряжённый ион. Первый потенциал ионизации соответствует энергии отрыва первого электрона, второй – энергии отрыва второго электрона и т.д. В главных подгруппах радиусы атомов элементов одинаково возрастают с увеличением заряда ядра. Кроме того, увеличение числа электронных слоёв, промежуточных между ядром атома и внешними электронами, приводит к более сильному экранированию ядра, т.е. к уменьшению его эффективного заряда. Оба эти фактора (растущее удаление внешних электронов от ядра и уменьшение его эффективного заряда) приводит к ослаблению связи внешнего электрона с ядром и, следовательно, к уменьшению потенциала ионизации. При переходе от Al к Ga радиус атома уменьшается. Это связано с тем, что у Ga заполнение р -подуровня начинается после того, как заполняется 3 d 10-подуровень. Заполнение d -оболочки сопровождается последовательным сжатием атомов, оно оказывается настолько сильным, что компенсирует возрастание радиуса при появлении четвертого энергетического уровня. В результате d -сжатия при переходе от алюминия к галлию наблюдается уменьшение атомного радиуса. Вследствие этого энергии ионизации алюминия и галлия близки по значению, и свойства соединений алюминий +3 во многом схожи со свойствами соединений галлия +3. Металлические свойства резко усиливаются при переходе от бора к алюминию, несколько ослабевают у галлия и вновь постепенно растут при переходе к таллию. Бор: 5B 1s22s22p1  Алюминий: 13Al 1s22s22p63s23p1  Галлий: 31Ga 1s22s22p63s23p63d104s24p1 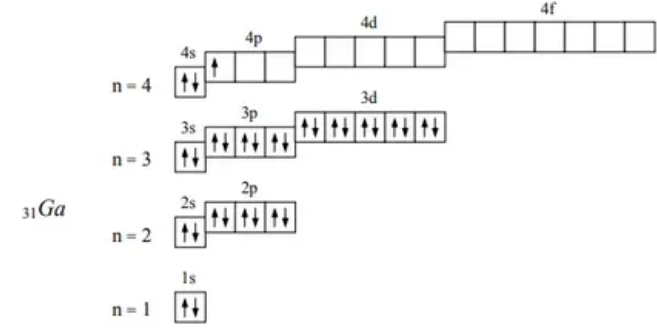 Задачи 249—289 (табл. 1.15). Подберите коэффициенты к уравнениям окислительно-восстановительных реакций, используя метод полуреакций; укажите тип ОВР и сопряженные окислительно-восстановительные пары.
Решение:  Реакция относится к межмолекулярным окислительно-восстановительным реакциям. | ||||||||||||||||||||||||||||||||||||||||||||||||||
