Контрольная работа по кинетике. кинетика1. Решение По второму закону Рауля понижение температуры замерзания раствора выражается уравнением
 Скачать 91.58 Kb. Скачать 91.58 Kb.
|
|
13.1[A1]. КИНЕТИКА Контрольная работа № 1 1. (1.1). Раствор, содержащий 1,5 г. KCl в 100 г. воды, замерзает при –0,684 °С. Определите изотонический коэффициент и давление паров воды над этим раствором при 25 °С. Давление паров чистой воды при 25 °С равно 23,76 мм рт.ст. Решение: По второму закону Рауля понижение температуры замерзания раствора выражается уравнением: 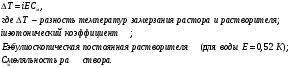 Моляльность раствора определяется как отношение количества молей растворенного вещества к массе растворителя в кг. Количество молей растворенного вещества определяется отношением его массы к молекулярной массе (М(KCl) = 74,55 г/моль). Отсюда получаем уравнение для расчета изотонического коэффициента: 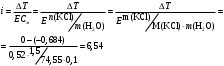 С учетом изотонического коэффициента давление пара над растворов выразим через первый закон Рауля: давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе: 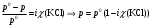 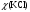 - мольная доля растворенного вещества, равная отношению количества молей его вещества в растворе к сумме молей всех веществ в растворе: - мольная доля растворенного вещества, равная отношению количества молей его вещества в растворе к сумме молей всех веществ в растворе: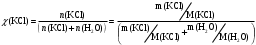 Отсюда: 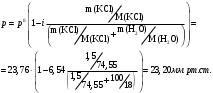 2. (1.1). Через разбавленный раствор азотнокислого серебра пропускался постоянный ток между платиновыми электродами. Убыль серебра в катодном слое оказалась равной 0,3105 г, а в анодном – 0,2777 г. Определите числа переноса Ag+и NO3-. Решение: Рассчитаем концентрацию убили серебра при аноде и катоде, считая, что объем раствора равен 1 л: 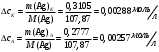 Общую убыль серебра в растворе 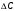 рассчитываем как сумму убыли в катодном слое и анодном слое: рассчитываем как сумму убыли в катодном слое и анодном слое: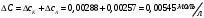 Числа переноса находим как отношение концентрации серебра при аноде и катоде к общей убыли: 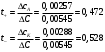 3. (1.1). Эквивалентная электропроводность 0,1-н. раствора NaOH при 18 °С равна 183 Ом-1см2. Подвижности ионов Na+ и OH- при бесконечном разведении соответственно равны 42,5 и 174 Ом-1см2. Определите степень диссоциации электролита и его константу диссоциации. Решение: Степень диссоциации определяем как отношение эквивалентной электропроводности раствора к эквивалентной электропроводности при бесконечном разведении: 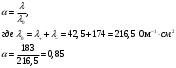 Константу диссоциации рассчитываем по уравнению: 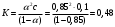 4. (1.2). Найдите активность и среднюю активность электролита ZnCl2, если его моляльность равна 0,01 и γ ± =0,71. Решение: Рассчитаем среднюю моляльность, где n – общее количество катионов и анионов, n+ - количество катионов, n- - количество анионов: 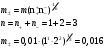 Средняя ионная активность определяется как произведение средней моляльности и коэффициента активности: 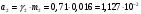 Общая активность электролита равна: 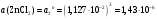 5. (1.2). Вычислите ионную силу раствора, содержащего Na2SO4 (m=0,001), NaCl (m=0,005), LaCl3 (m=0,02), La2(SO4)3 (m=0,015). Решение: Запишем уравнения диссоциации солей: 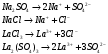 Находим моляльности катионов и анионов: 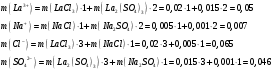 Рассчитываем ионную силу раствора: 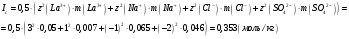 6. (2.1). ЭДС элемента, работающего за счёт реакции 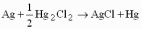 , равна 0,0455 В при 25 °С и 0,0421 В при 20 °С. Определите тепловой эффект реакции, изменение энтропии и энергии Гиббса. , равна 0,0455 В при 25 °С и 0,0421 В при 20 °С. Определите тепловой эффект реакции, изменение энтропии и энергии Гиббса.Решение: Энергия Гиббса электрохимической реакции рассчитывается по уравнению:  По уравнению реакции определяем, что n = 1, так как участвует только один электрон. При 25 °С: 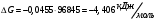 Изменение энтропии реакции рассчитывается через температурный коэффициент: 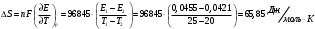 Тепловой эффект при 25 °С: 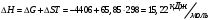 7. (2.2). ). ЭДС элемента Cd | CdI2, AgI (тв) | Ag равна 0,2860 В при 25 °С. Определите активность йодистого кадмия в растворе. Решение: Составим уравнения реакций на электродах: 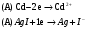 Суммарная реакция: 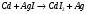 ЭДС элемента вычисляется по уравнению:  Активность твердых веществ считаем постоянной и равной 1. По таблице определяем стандартные электродные потенциалы восстановления ионов кадмия и йодида серебра: 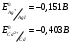 Отсюда 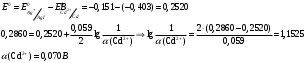 Составитель: доцент кафедры физической химии Апыхтина И.В. |
