ХИМИЯ. химия 03.11. Решение Составим уравнение реакции горения серы с образованием оксида серы (IV)
 Скачать 20.22 Kb. Скачать 20.22 Kb.
|
|
1) Определите объём оксида серы (IV), который выделится при сгорании 1 кг серы (н. у.). Решение: Составим уравнение реакции горения серы с образованием оксида серы (IV): 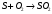 Рассчитаем количество моль вступившей в реакцию серы: 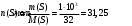 Столько же моль образуется оксида серы (IV): 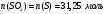 При н.у. 1 моль любого газа занимает объем, равный 22,4 л. Тогда 31,25 моль займет объем: 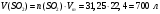 Ответ: 700 л. 2) 36. Какая из функций состояния ∆U или ∆Н более применима для изучения химических реакций и почему? Дайте обоснованный ответ, приведите примеры. Решение: Энергетический эффект химической реакции может проявляться как чисто тепловой, связанный с изменением внутренней энергии системы, например, реакция нейтрализации в разбавленном растворе: H+ + OH- = H2O + 57 кДж Для этого случая можно записать, что весь тепловой эффект ∆Q при постоянном объеме равен изменению внутренней энергии ∆U: ∆Qv = ∆U Однако если смешать в пробирке водные растворы карбоната натрия и соляной кислоты и быстро закрыть пробирку пробкой, то через некоторое время система совершит механическую работу, «выстрелив» пробкой. При этом температура растворов после реакции практически не изменяется. Работа совершается, когда повышенное давление в закрытой пробирке уравнивается с атмосферным после вылетания пробки. Таким образом, можно описать работу, как работу расширения газа, совершенную при постоянном давлении (изобарный процесс): p∆V. В общем случае, работа, совершаемая химической реакцией при постоянном давлении, состоит из изменения внутренней энергии и работы расширения: ∆Qp = ∆U + p∆V Для большинства химических реакций, проводимых в открытых сосудах, удобно использовать функцию состояния, приращение которой равно теплоте, полученной системой в изобарном процессе, то есть при постоянном атмосферном давлении. Поэтому для изучения химических реакций наиболее применима функция энтальпия: ∆Qp = ∆H = ∆U + p∆V. |
